Коррозией металлов называют самопроизвольное разрушение металлов под действием различных окислителей из окружающей среды.
В реальных условиях коррозии обычно подвергаются технические металлы, содержащие примеси других металлов и неметаллических веществ.
Механизм электрохимической коррозии в таких металлах аналогичен механизму процессов, протекающих в короткозамкнутых гальванических элементах, в которых на участках с более отрицательным потенциалом идет процесс окисления (разрушение металлов), а на участках с более положительным потенциалом процесс восстановления окислителя (коррозионной среды).
Наиболее часто встречаются окислители (деполяризаторы):
· ионы водорода (коррозия с водородной деполяризацией)
2Н + + 2 ē = Н 2 (в кислой среде),
2Н2О + 2 ē = Н2 + 2ОН — (в нейтральной и щелочной средах);
O2 + 4 ē + 4Н + = 2Н2О (в кислой среде);
О2 +4 ē + 2Н2О = 4ОН — (в щелочной и нейтральной средах).
Методика рассмотрения работы гальванопары при электрохимической коррозии.
· Составляют схему гальванопары:
· Выписывают стандартные потенциалы металлов и окислителей коррозионной среды (табл.П.7), определяют восстановитель (меньший потенциал), окислитель (больший потенциал).
· Записывают уравнения процессов окисления и восстановления и суммарное уравнение окислительно-восстановительной реакции, протекающей при гальванокоррозии.
· Указывают направление движения электронов.
Пример 1.Гальванопара алюминий —железо в воде (среда нейтральная). В воде растворен кислород.
· Схема гальванопары Al / H2O, O2 / Fe
· Потенциалы 


Восстановитель – Al, окислитель — О2.


· Направление движения электронов от участка с меньшим потенциалом к участку с большим потенциалом:


Пример 2. Определить процессы, протекающие при коррозии луженого железа (среда – влажный воздух, содержащий кислород, пары воды и ионы Н + ), если нарушена сплошность покрытия.
· Потенциалы: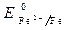


Восстановитель – железо, окислитель – кислород.


2Fe + О2 + 4Н + = 2Fe 2+ + 2Н2О
При нарушении целостности покрытия будет разрушаться Fe.
· Электроны движутся от участка с меньшим потенциалом к участку с большим потенциалом:


Пример 3. Рассмотреть коррозию детали из железа и алюминия в щелочной среде (КОН), если растворенный кислород отсутствует.
· Схема гальванопары: Al / КОН/ Fe
· Потенциалы: 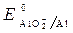


· 
Fe(+): 3 2 H2O + 2 ē = 2 OH — + H2 – процесс восстановления
2 Al + 2 OH — + 2H2O = 2 AlO2 — + 3 H2
· Направление перемещения электронов в системе:


Задание к подразделу 4.4
Рассмотрите коррозию гальванопары, используя потенциалы (табл. П.7), укажите анод и катод соответствующей гальванопары в различной коррозионной среде, рассчитайте ЭДС, напишите уравнения анодного и катодного процессов, молекулярное уравнение реакции коррозии, укажите направление перемещения электронов в системе.
| Номер задания | Коррозионная среда | ||
| а) H2O + O2 | б) NaOH + H2O | в) H2O + Н + | |
| 321. | Fe / Zn | Zn / Al | Pb / Zn |
| 322. | Fe / Ni | Fe / Zn | Al / Cu |
| 323. | Pb / Fe | Cd / Cr | Al / Ni |
| 324. | Cu / Zn | Al / Cu | Sn / Cu |
| 325. | Zn / Fe | Fe / Cr | Co / Al |
| 326. | Zn / Al | Pb / Zn | Cr / Ni |
| 327. | Cr / Cu | Pb / Cr | Bi / Ni |
| 328. | Cu / Al | Cr / Zn | Fe / Mg |
| 329. | Zn / Sn | Mg / Cd | Cr / Bi |
| 330. | Co / Mg | Zn / Fe | Pb / Al |
| 331. | Pb / Zn | Bi / Ni | Cd / Al |
| 332. | Bi / Ni | Cu / Zn | Fe / Ni |
| 333. | Fe / Mg | Fe / Cu | Co / Cd |
| 334. | Sn / Fe | Pb / Zn | Cr / Fe |
| 335. | Cr / Fe | Fe / Mg | Co / Cu |
| 336. | Fe / Cr | Cr / Cu | Cr / Cu |
| 337. | Fe / Cu | Cd/ Zn | Cd/ Zn |
| 338. | Zn / Cu | Cr / Ni | Cr / Cd |
| 339. | Mg / Cu | Cr / Cd | Zn / Al |
| 340. | Sn / Cu | Bi / Ni | Bi / Ni |
Электролиз растворов
Электролиз – это совокупность окислительно-восстановительных процессов, происходящих при прохождении электрического тока через электрохимическую систему, состоящую из двух электродов и электролита.
Электрод, на котором происходит восстановление, называется катодом, он заряжен отрицательно. Электрод, на котором происходит окисление, называется анодом, он заряжен положительно.
При электролизе водных растворов могут протекать процессы, связанные с электролизом воды, т.е. растворителя.
Катодные процессы
На катоде возможно восстановление:
· катионов металла Ме n+ + nē = Me;
· катиона водорода (свободного или в составе молекул воды):
2H + + 2ē = H 2 ( в кислой среде) ;
2H2O + 2 ē =H 2+ 2 OH — ( в нейтральной и щелочной средах).
Для выбора приоритетного процесса следует сравнить стандартные электродные потенциалы металла и водорода (табл. П.6, П.7). Потенциал восстановления катионов водорода необходимо использовать с учетом перенапряжения, 
1. Активные металлы (Li — Al) из-за низкой окислительной способности их ионов на катоде не осаждаются, вместо них идет восстановление ионов водорода.
2. Металлы средней активности (Mn, Zn, Fe, Sn) могут осаждаться на катоде с одновременным выделением водорода.
3. Малоактивные металлы (стоящие в ряду напряжений после водорода) из-за высокой окислительной способности их ионов осаждаются на катоде без выделения водорода.
Анодные процессы
На аноде возможны процессы окисления:
· материала анода Ме — nē = Me n +
Анионы кислородосодержащих кислот, имеющие в своем составе атом
элемента в высшей степени окисления (SO4 2 — , NO3 — и др.), при электролизе водных растворов на аноде не разряжаются.
С учетом перенапряжения величину потенциала выделения кислорода нужно считать равной 1,8 В.
Пример 1. Электролиз водного раствора сульфата калия с инертными электродами:


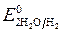
Так как


происходит восстановление воды: 2H2O — 4ē = O2 + 4 H +
среда щелочная среда кислая
Пример 2. Электролиз водного раствора хлорида олова с инертными электродами:
SnCl 2 = Sn 2+ + 2Cl —





Так как


ионов олова: Sn 2+ + 2 ē = S n 2Cl — — 2 ē = Cl 2
Пример 3. Электролиз сульфата меди с медным анодом:

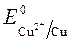



Так как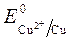

происходит восстановление Так как 
ионов меди:Cu 2+ +2ē = Cu анод растворяется: Cu — 2ē = Cu 2+
Количественные соотношения при электролизе определяют в соответствии с законами, открытыми М. Фарадеем (1834).
Обобщенный закон Фарадея связывает количество вещества, образовавшегося при электролизе, со временем электролиза и силой тока:

где m — масса образовавшегося вещества , г;
М — молярная масса вещества, г/ моль;
n — количество электронов, участвующих в электродном процессе;
t — время электролиза, с;
F — константа Фарадея (96500 Кл/моль).
Для газообразных веществ, выделяющихся при электролизе, формулу использют в виде 
где V— объем газа, выделяющегося на электроде; V 0 — объем 1 моль газообразного вещества при нормальных условиях (22,4 л/моль).
Пример 4. Рассчитать массу олова и объем хлора при нормальных условиях, выделившихся при электролизе раствора хлорида олова с инертными электродами в течение 1 часа при силе тока 4А.
Решение.


Задание к подразделу 4.5
Рассмотрите катодные и анодные процессы при электролизе водных растворов веществ. Процессы на электродах обоснуйте значениями потенциалов (табл. П.6,7,8). Составьте схемы электролиза с инертными электродами водных растворов предложенных соединений (отдельно два раствора) с инертными электродами либо растворимым анодом. Рассчитайте массу или объем (при нормальных условиях для газов) продуктов, выделяющихся на электродах при пропускании через раствор в течение 1 часа тока силой 1 А.
Видео:Гальванические элементы. 1 часть. 10 класс.Скачать

Написать уравнения электрохимической коррозии ni zn в кислой среде
8.4 РЕШЕНИЕ ТИПОВЫХ ЗАДАЧ ПО ТЕМЕ “КОРРОЗИЯ МЕТАЛЛОВ И МЕТОДЫ ЗАЩИТЫ МЕТАЛЛОВ ОТ КОРРОЗИИ”
(для нехимических специальностей)
1. Склепаны два металла. Укажите, какой из металлов подвергается коррозии:
а) Mn – Al ; б) Sn – Bi .
а) Al в ряду напряжений находится перед марганцем и имеет более отрицательное значение стандартного электродного потенциала, поэтому при контакте этих двух металлов Al будет анодом, а Mn — катодом. Окисляться, т.е. подвергаться коррозии, будет алюминий.
б) В этом случае корродировать будет олово, т.к. в ряду напряжений оно расположено впереди висмута и, следовательно, является электрохимически более активным.
2. Какие из нижеперечисленных металлов выполняют для свинца роль анодного покрытия: Pt , Al , Cu , Hg ?
Анодное покрытие – это нанесение на защищаемое изделие электрохимически более активного металла. Из перечисленных металлов электрохимически более активным (по сравнению со свинцом) является алюминий (см. ряд напряжений металлов).
3. Какие из нижеперечисленных металлов выполняют для свинца роль катодного покрытия: Ti , Mn , Ag , Cr ?
Катодное покрытие – это нанесение на защищаемое изделие электрохимически менее активного металла. Из перечисленных металлов электрохимически менее активным (по сравнению со свинцом) является серебро (см. ряд напряжений металлов).
4. Укажите продукт коррозии при контакте Zn – Ni в нейтральной среде.
При контакте двух металлов различной электрохимической активности возникает гальванический элемент. В нейтральной среде его схема выглядит следующим образом:
Так как цинк электрохимически более активен (см. ряд напряжений металлов), он будет окисляться ( корродировать ). На никеле будет протекать восстановительный процесс (в нейтральной среде – кислородная деполяризация):
А (–): Zn – 2e — = Zn 2+
Продукт коррозии – Zn (OH)2.
5. Укажите продукт коррозии при контакте Zn – Ni в кислой среде ( HCl ).
При контакте двух металлов различной электрохимической активности возникает гальванический элемент. Его схема для кислой среды раствора:
Так как цинк электрохимически более активен (см. ряд напряжений металлов), он будет окисляться ( корродировать ). На никеле будет протекать восстановительный процесс (в кислой среде – водородная деполяризация):
Видео:Электрохимическая коррозияСкачать

Задачи к разделу Коррозия металлов
В данном разделе вы найдете задачи по теме Коррозия металлов. Приведены уравнения реакций, протекающих при электрохимической коррозии металлов, а также примеры задач на определение защитных свойств оксидных пленок, определение коррозионной стойкости металлов.
Задача 1. В каком случае цинк корродирует быстрее: в контакте с никелем, железом или с висмутом? Ответ поясните. Напишите для всех случаев уравнение электрохимической коррозии в серной кислоте. Будет ли оксидная пленка, образующаяся на кальции, обладать защитными свойствами?
Решение.
В месте контакта двух металлов корродирует более активный металл. Происходит отток электронов от более активного металла к менее активному. Металл тем активнее, чем более отрицателен его электродный потенциал. В таблице электродных потенциалов найдем:
В данном случае, цинк корродирует быстрее в контакте с висмутом, так как из перечисленных металлов, Bi является самым неактивным. В образовавшейся паре роль анода выполняет цинк.
Запишем уравнения электрохимической коррозии в серной кислоте:
Zn—Bi
К: 2H + +2e — = H2
А : Zn — 2e — = Zn 2+
Zn + 2H + = Zn 2+ + H2
Fe-Bi
К: 2H + +2e — = H2
А : Fe — 3e — = Fe 3+
2Fe + 6H + = Fe 3+ + 3H2
Ni-Bi
К: 2H + +2e — = H2
А : Ni — 2e — = Ni 2+
Ni + 2H + = Ni 2+ + H2
Будет ли оксидная пленка, образующаяся на кальции, обладать защитными свойствами?
Защитные свойства пленки оценивают величине фактора Пиллинга—Бэдвордса: (α = Vок/VМе), значения которого вы найдете в таблице, приведенной в теоретической части данного раздела. Мы рассчитаем значение α по формуле:
т.е α Решение.
Протекторная защита заключается в присоединении к защищаемому металлическому изделию, металла с более отрицательным значением стандартного электродного потенциала E 0 , т.е. более активного металла. Для защиты железа подойдут, например, цинк и бериллий:
Запишем уравнения электрохимической коррозии во влажной среде, насыщенной кислородом:
Fe—Zn
К: O2 + 2H2O + 4e — = 4OH —
А: Zn — 2 e — = Zn 2+
Fe-Be
К: O2 + 2H2O + 4e — = 4OH —
А : Be — 2e — = Be 2+
Будет ли оксидная пленка, образующаяся на алюминии, обладать защитными свойствами?
Защитные свойства пленки оценивают величине фактора Пиллинга—Бэдвордса: (α = Vок/VМе), значения которого вы найдете в таблице, приведенной в теоретической части данного раздела. Мы рассчитаем значение α по формуле:
Мок = 27·2+16·3 = 102 г/моль
т.е 2,5>α>1, а это значит, что оксидная пленка, образующаяся на Al, является сплошной и обладает защитными свойствами.
Задача 3. Деталь сделана из сплава, в состав которого входит магний и марганец. Какой из компонентов сплава будет разрушаться при электрохимической коррозии? Ответ подтвердите уравнениями анодного и катодного процесса коррозии: а) в кислой среде; б) в кислой среде, насыщенной кислородом. Будет ли оксидная пленка, образующаяся на олове, обладать защитными свойствами?
Решение.
При электрохимической коррозии сплава, в первую очередь будет разрушаться более активный металл, т.е. металл, имеющий более отрицательное значение стандартного электродного потенциала. В таблице электродных потенциалов найдем:
По значениям E видно, что магний является более активным металлом, чем марганец, вследствие чего при коррозии Mg будет разрушаться в первую очередь.
Запишем уравнения электрохимической коррозии магния а) в кислой среде; б) в кислой среде, насыщенной кислородом:
а) в кислой среде
А: Mg — 2 e — = Mg 2+
Mg + 2H + = Mg 2+ + H2
б) в кислой среде, насыщенной кислородом
К: O2 + 2H2O + 4e — = 4OH —
А : Mg — 2e — =Mg +
Будет ли оксидная пленка, образующаяся на олове, обладать защитными свойствами?
Защитные свойства пленки оценивают величине фактора Пиллинга—Бэдвордса: (α = Vок/VМе), значения которого вы найдете в таблице, приведенной в теоретической части данного раздела. Мы рассчитаем значение α по формуле:
Олово может образовать два оксида SnO и SnO2, поэтому рассчитаем значение α для каждого случая
МSnO = 119+16 = 135 г/моль
т.е для всех оксидных пленок α лежит в интервале 2,5>α>1, т.е. они являются сплошными и обладают защитными свойствами.
Задача 4. С целью защиты от коррозии цинковое изделие покрыли оловом. Какое это покрытие: анодное или катодное? Напишите уравнение атмосферной коррозии данного изделия при нарушении целостности покрытия. Оценить коррозионную стойкость алюминия в серной кислоте, если убыль массы алюминиевой пластины размером 70х20х1 мм составила после 8 суток испытания 0,0348 г.
Решение.
Если металлическое покрытие изготовлено из металла с более отрицательным потенциалом (более активный), чем защищаемый, то оно называется анодным покрытием. Если металлическое покрытие изготовлено из металла с более положительным потенциалом (менее активный), чем защищаемый, то оно называется катодным покрытием.
В таблице электродных потенциалов найдем:
Олово будет выполнять роль катода и покрытие из него – катодное. При нарушении целостности покрытия, корродировать будет цинк, как более активный металл. При атмосферной коррозии протекают следующие уравнения реакций:
К: O2 + 2H2O + 4e — = 4OH —
А: Zn — 2 e — = Zn 2+
Оценить коррозионную стойкость алюминия в серной кислоте, если убыль массы алюминиевой пластины плотностью ρ = 2,7 г/см 3 , размером 70х20х1 мм составила после 8 суток испытания 0,0348 г.
Оценить коррозионную стойкость металла можно по формуле:
Kн = 365·h/τ
h = Δm/(S·ρ)
Найдем площадь поверхности металла:
S = 2·(7·2) + 2·(7·0,1) + 2·(2·0,1) = 29,8 см 2
h = 0,0348/(29,8·2,7) = 0,00043см = 0,0043 мм
Kн = 365·0,0043/8 = 0,02 мм/год
По десятибалльной шкале коррозионной стойкости металлов, алюминий соответствует 4 баллам и относится к стойким металлам.
Задача 5. Если на стальной предмет нанести каплю воды, то коррозии подвергается средняя, а не внешняя часть смоченного металла. Чем это можно объяснить? Какой участок металла, находящийся под влиянием капли, является анодным, а какой катодным? Составьте электронные уравнения соответствующих процессов. Будет ли оксидная пленка, образующаяся на никеле, обладать защитными свойствами?
Решение .
При нанесении на стальной предмет капли воды, наибольший доступ воздуха будет по краям капли, где протекает процесс восстановления кислорода. Т.е. края капли выступают в качестве катода. Для окисления железа остается центр капли, где доступ воздуха минимален. Здесь центр капли является анодом. В этом случае протекают следующие реакции:
А: Fe – 2e — = Fe 2+
Будет ли оксидная пленка, образующаяся на никеле, обладать защитными свойствами?
Защитные свойства пленки оценивают величине фактора Пиллинга—Бэдвордса: (α = Vок/VМе), значения которого вы найдете в таблице, приведенной в теоретической части данного раздела. Мы рассчитаем значение α по формуле:
Мок = 59+16 = 75 г/моль
Подставим значения в формулу:
α = 75·8,9/(59·1·6,7) = 1,7
т.е α лежит в интервале 2,5>α>1, т.е. оксидная пленка является сплошной и обладает защитными свойствами.
Задача 7. Сплав содержит железо и никель. Какой из названных компонентов будет разрушаться при атмосферной коррозии? Приведите уравнение анодного и катодного процессов. Оценить коррозионную стойкость цинка на воздухе при высоких температурах. Образец цинка размером 50х30х1 мм после 180 часов окисления и снятия продуктов коррозии весил 10,6032 г.
Решение.
Исходя из положения металлов в электрохимическом ряду напряжения металлов, находим, что железо более активный металл, чем никель:
Поэтому в первую очередь при атмосферной коррозии будет разрушаться железо. В этом случае протекают следующие реакции:
А: Fe – 2e — = Fe 2+
Далее Fe(OH)2 переходит в Fe(OH)3
Оценить коррозионную стойкость цинка на воздухе при высоких температурах. Образец цинка плотностью ρ = 7,14 г/см 3 , размером 50х30х1 мм после 180 часов окисления и снятия продуктов коррозии весил 10,6032 г.
Оценить коррозионную стойкость металла можно по формуле:
Kн = 365·h/τ
h = Δm/(S·ρ)
Найдем площадь поверхности металла:
S = 2·(5·3) + 2·(5·0,1) + 2·(3·0,1) = 31,6 см 2
Масса металла до коррозии равна:
Убыль массы:
Δm = m1 – m2 = 10,71 — 10,6032 = 0,1068
h = 0,1068/(31,6·7,14) = 0,00047 см = 0,0047 мм
Kн = 365·0,0047/7,5 = 0,23 мм/год
По десятибалльной шкале коррозионной стойкости металлов, цинк соответствует 6 баллам и относится к пониженностойким металлам.
Задача 8. Почему химически чистое железо является более стойким против коррозии, чем техническое железо? Составьте уравнения анодного и катодного процессов, происходящих при коррозии технического железа во влажном воздухе и в азотной кислоте. Будет ли оксидная пленка, образующаяся на свинце, обладать защитными свойствами?
Решение.
Техническое железо содержит примеси, которые, как правило, выполняют роль катода. Либо, если это углерод, который не передает в раствор положительно заряженных ионов и не имеет заградительного барьера от ионов водорода в кислой среде. Само железо будет служить анодом и подвергаться разрушению.
В химически чистом железе нет примесей, которые образовали бы гальванопару с железом, где бы оно окислялось.
При коррозии технического железа протекают следующие реакции:
Во влажном воздухе
А: Fe – 2e — = Fe 2+
Далее Fe(OH)2 переходит в Fe(OH)3
В азотной кислоте
А: Fe – 2e — = Fe 2+
Будет ли оксидная пленка, образующаяся на свинце, обладать защитными свойствами?
Защитные свойства пленки оценивают величине фактора Пиллинга—Бэдвордса: (α = Vок/VМе), значения которого вы найдете в таблице, приведенной в теоретической части данного раздела. Мы рассчитаем значение α по формуле:
Свинец может образовать оксиды состава PbO и PbO2, поэтому рассчитаем значение α для каждого случая
МPbO = 207+16 = 223 г/моль
т.е для всех оксидных пленок α лежит в интервале 2,5>α>1, т.е. они являются сплошными и обладают защитными свойствами.
Задача 9. Приведите примеры двух металлов, пригодных для протекторной защиты никеля. Для обоих случаев напишите уравнение электрохимической коррозии в среде азотной кислоты. Оценить коррозионную стойкость кадмия на воздухе при высоких температурах. Образец кадмия плотностью ρ = 8,65 г/см 3 , размером 45х25х1 мм после 150 часов окисления и снятия продуктов коррозии весил 10,0031 г.
Решение.
Протекторная защита – один из видов электрохимической защиты – заключается в следующем.
К защищаемому сооружению присоединяют пластины более активного металла, который называется протектором. Протектор – металл с более отрицательным потенциалом – является анодом, а защищаемое сооружение – катодом. Соединение протектора и защищаемого сооружения проводником тока, приводит к разрушению протектора.
Для протекторной защиты никеля подойдут, например, железо и цинк:
При электрохимической коррозии в среде азотной кислоты протекают следующие реакции:
Ni — Fe
А: Fe – 2e — = Fe 2+
Ni — Zn
Оценить коррозионную стойкость кадмия на воздухе при высоких температурах. Образец кадмия плотностью ρ = 8,65 г/см 3 , размером 45х25х1 мм после 150 часов окисления и снятия продуктов коррозии весил 10,0031 г.
Оценить коррозионную стойкость металла можно по формуле:
Kн = 365·h/τ
h = Δm/(S·ρ)
Найдем площадь поверхности металла:
S = 2·(4,5·2,5) + 2·(4,5·0,1) + 2·(2,5·0,1) = 23,9 см 2
Масса металла до начала коррозии равна:
m1 = V·ρ = 4,5·2,5·0,1·8,65 = 9,7313 г
Убыль массы:
Δm = m1 – m2 = 10,0031 – 9,7313 = 0,2718
h = 0,2718/(23,9·8,65) = 0,0013 см = 0,013 мм
Kн = 365·0,013·24/150 = 0,76 мм/год
По десятибалльной шкале коррозионной стойкости металлов, определяем, что в данных условиях, кадмий соответствует 7 баллам и относится к пониженностойким металлам.
🎦 Видео
Электрохимическая коррозия (алюминий — медь)Скачать

§13, 9 кл. Коррозия металловСкачать

Коррозия металлов и способы защиты от нееСкачать

Коррозия металловСкачать

Лабораторная работа "Коррозия металлов"Скачать

Коррозия металлов и меры по ее предупреждению. 8 класс.Скачать

Коррозия металлов (учебный фильм)Скачать

Лабораторная работа «Металлы. Коррозия металлов»Скачать

Коррозия металла. Химия – ПростоСкачать

Лекция 08 :: Электрохимические системы. Электролиз. Коррозия.Скачать

Электрохимическая коррозия металлов и способы защитыСкачать

Урок 22. Коррозия металлов. Химия 11 классСкачать

8. Коррозия металловСкачать

Ингибиторы коррозииСкачать

Химия 9 Коррозия металловСкачать

Химия 11 класс (Урок№9 - Коррозия металлов и её предупреждение.)Скачать

Технологический институт - гальванический элемент, электролиз, коррозия. Задачи.Скачать

Общая и неорганическая химия. Электролиз солей и коррозия металловСкачать