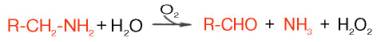Процесс отщепления карбоксильной группы аминокислот в виде СO2 получил название декарбоксилирования. Несмотря на ограниченный круг субстратов (аминокислот и их производных), подвергающихся декарбоксилированию в животных тканях, образующиеся продукты реакции (названные биогенными аминами) обладают сильным фармакологическим действием на множество физиологических функций человека и животных. В животных тканях показано декарбоксилирование следующих аминокислот и их производных: тирозина, триптофана, 5-окситриптофана, валина, серина, гистидина, глутаминовой и γ-оксиглутаминовой кислот, 3, 4-диоксифенилаланина, цистеина и цистеин-сульфиновой кислоты, аргинина, орнитина, S-аденозилметионина и α-аминомалоновой кислоты. Помимо этого, у микроорганизмов и растений открыто декарбоксилирование этих и ряда других аминокислот. Сведения о декарбоксилировании аминокислот в живых организмах суммированы в табл. 39 [показать] .
| Таблица 39. Ферментативное декарбоксилированне аминокислот и их производных | ||||
| Субстрат | Продукт реакции | Распространение | ||
| животные | растения | микроорганизмы | ||
| S-Аденозил-метионин | S-Аденозилгомоцистеамин | + | + | |
| Парааминобенэойная кислота | Анилин | + | ||
| α-Аминомалоновая кислота | Глицин | + | ||
| α-Аминомасляная кислота | Пропиламин | + | ||
| Антраниловая кислота | Анилин | + | ||
| L-Аргинин | Агматин | + | ||
| L-Аспарагиновая кислота | β-Аланин | + (?) | + | |
| L-Аспарагиновая кислота | α-Аланин | + | ||
| L-Валин | 2-Метилпропиламин | + | + | + |
| L-Гистидин | Гистамин | + | + | |
| Две молекулы глицина | 2CO2+2NH3+CH3COOH | + | ||
| L-Глутаминовая кислота | γ-Аминомасляная кислота | + | + | + |
| Мезо-α; ε-диаминопимелиновая кислота | L-Лизин | + | ||
| 3,4- Диоксифенилаланин | 3,4-Диоксифенилэтиламин | + | + | + |
| 3,4-Диоксифенилсерин | Норадреналин | + | ||
| L-Изолейцин | 2-Метилбутиламин | + | + | |
| L-Лейцин | 3-Метилбутиламин | + | + | |
| L-Лизин | Кадаверин | + | ||
| γ-Метилен-L-глутаминовая кислота | γ-Амино-α-метиленмасляная кислота | + | ||
| Норвалин | н-Бутиламин | + | ||
| Алло-β-оксиглутаминовая кислота | γ-Амино-α-оксимасляная кислота | + | ||
| γ-Оксиглутаминовая кислота | α-oкси-γ-аминомасляная кислота | + | + | |
| 5-Оксилиэин | 2-оксикадаверин | + | ||
| 5-Окситриптофан | Серотонин | + | ||
| n-Оксифенилсерин | n-Оксифениламиноэтанол | + | ||
| L-Орнитин | Путресцин | + | + | |
| L-Серин | Этаноламин | + | ||
| L-Тирозин | Тирамин | + | + | + |
| L-Триптофан | Триптамин | + | ||
| L-Фенилаланин | Фенилэтиламин | + | + | |
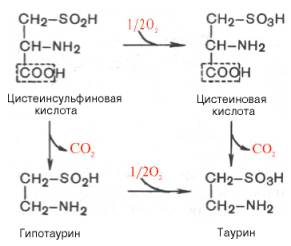
| L-Цистеиновая кислота | Таурин | + | ||
| L-Цистеинсульфиновая кислота | Гипотаурин | + | ||
Общая схема процесса декарбоксилирования аминокислот может быть представлена в следующем виде:
В живых организмах открыто четыре типа декарбоксилирования аминокислот.
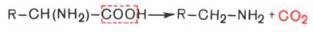
- α-Декарбоксилирование, характерное для большинства природных аминокислот и их производных, при котором отщепляется карбоксильная группа, стоящая по соседству с α-углеродным атомом. Продуктами реакции являются СО2 и биогенные амины:
R-CH(NH2)-COOH —> R-CH2-NH2 + CO2
ω-Декарбоксилированне, характерное для микроорганизмов. Например, из аспарагиновой кислоты этим путем образуется α-аланин:
НООС-СН2-CH(NH2)-СООН —> СН3-CH(NH2)-СООН + СО2
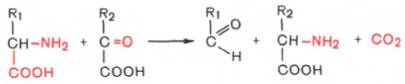
Декарбоксилирование, связанное с реакцией трансаминирования:
В этой реакции образуются альдегид и новая аминокислота, соответствующая исходной кетокислоте.
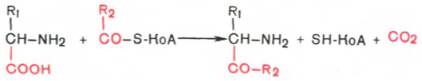
Декарбоксилирование, связанное с реакцией конденсации двух молекул:
Эта реакция в тканях животных осуществляется при синтезе δ-аминолевулиновой кислоты из глицина и сукцинил-КоА (см. Синтез гемоглобина) и при синтезе 3-кетосфинганина (сфинголипидов), а также у растений при синтезе биотина.
| Помимо этих реакций, у Peptococcus glycinophilus открыта еще одна реакция декарбоксилирования, сопряженная с генерацией энергии (синтезом АТФ). Этот анаэробный организм утилизирует глицин в качестве единственного источника углерода, превращая его в ацетат: В этом уравнении реакции участвует множество ферментов, а также тетрагидрофолиевая кислота (ТГФ); первая часть уравнения включает декарбоксилирование одной молекулы глицина: Эта последняя реакция также катализируется комплексом ферментов, одним из которых является пиридоксальфосфатзависимая глициндекарбоксилаза. Аналогичный путь катаболизма глицина доказан (без генерации энергии) в митохондриях печени крыс; таким образом, открыт еще один путь образования одноуглеродных фрагментов, используемых организмом для множества синтетических реакций. |
Реакции декарбоксилирования в отличие от других процессов промежуточного обмена аминокислот являются необратимыми. Они катализируются специфическими ферментами — декарбоксилазами аминокислот, отличающимися от декарбоксилаз α-кетокислот как по белковому компоненту, так и по природе кофермента. Декарбоксилазы аминокислот состоят из белковой части, обеспечивающей специфичность действия, и простетической группы, представленной пиридоксальфосфатом, как и у трансаминаз.
Таким образом, в двух совершенно различных процессах аминокислот участвует один и тот же кофермент- пиридоксальфосфат. Исключение составляют две декарбоксилазы — гистидиндекарбоксилаза Micrococcus и Lactobacillus и S-аденозилметиониндекарбоксилаза Е. coli, содержащие вместо пиридоксальфосфата остаток пировиноградной кислоты (С. Р. Мардашев, Снелл). Соответствующие декарбоксилазы животных тканей содержат пиридоксальфосфат.
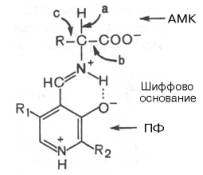
Механизм реакции декарбоксилирования аминокислот в соответствии с общей теорией пиридоксалевого катализа сводится к образованию пиридоксальфосфат-субстратного комплекса в активном центре фермента (представленного, как и в реакциях трансаминирования, шиффовым основанием пиридоксальфосфата и аминокислоты, см. формулу).
Образование подобного комплекса в сочетании с некоторым оттягиванием электронов белковой частью молекулы декарбоксилазы сопровождается лабилизацией связей «а», «б» и «в», благодаря которой аминокислота приобретает способность к различного рода превращениям (декарбоксилирование, трансаминирование, дегидратация и т. д.).
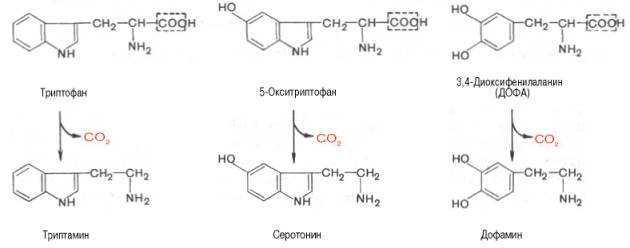
Ниже будут представлены отдельные примеры декарбоксилирования аминокислот (и соответствующих декарбоксилаз), в частности тех аминокислот, продукты реакции которых обладают мощным фармакологическим действием. Одним из хорошо изученных ферментов является декарбоксилаза ароматических аминокислот, не обладающая строгой субстратной специфичностью и катализирующая декарбоксилирование L-изомеров триптофана, 5-гидрокситриптофана и 3,4-диоксифенилаланина (ДОФА); продуктами реакций, помимо СO2, являются соответственно триптамин, серотонин и диоксифенилэтиламин (дофамин):
Декарбоксилаза ароматических аминокислот получена в чистом виде (мол. м. 112 000); кофермент-пиридоксальфосфат. В больших количествах она содержится в надпочечниках и ЦНС. Она играет важную роль в регуляции синтеза биогенных аминов. Образующийся из триптофана под действием этого фермента продукт — триптамин — наделен сосудосуживающим действием.
Другим, более изученным, биогенным амином, образующимся из 5-гидрокситриптофана, является 5-гидрокситриптамин, или серотонин. Помимо сосудосуживающего действия, серотонин участвует в центральной регуляции артериального давления, температуры тела, дыхания и почечной фильтрации. Он является медиатором нервных процессов в ЦНС. Некоторые авторы считают серотонин причастным к развитию аллергии, демпинг-синдрома, токсикоза беременности, карциноидного синдрома и геморрагических диатезов.
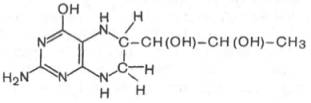
Относительно третьего продукта декарбоксилазной реакции — дофамина — следует прежде всего указать на ферментные системы и промежуточные продукты, ведущие к его образованию. Это важно, так как дофамин является предшественником катехоламинов (норадреналина и адреналина). Источником ДОФА в организме является тирозин, который под действием специфической гидроксилазы превращается в 3,4-диоксифенилаланин. Тирозингидроксилаза открыта в надпочечниках, в ткани мозга и периферической нервной системы. Простетической группой тирозингидроксилазы, как и дофамингидроксилазы (последняя катализирует превращение дофамина в норадреналин) является тетрагидробиоптерин (рис.)
Физиологическая роль тирозингидроксилазы чрезвычайно высока, поскольку катализируемая этим ферментом реакция определяет скорость биосинтеза дофамина и катехоламинов, регулирующих в известной степени деятельность сердечно-сосудистой системы. В медицинской практике широко используются, кроме того, ингибиторы декарбоксилазы ароматических аминокислот, в частности α-метилдофа (альдомет), введение которого способствует снижению кровяного давления.
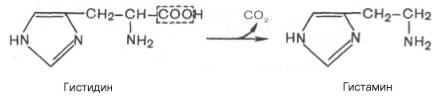
В животных тканях с высокой скоростью протекает реакция декарбоксилирования гистидина, катализируемая специфической гистидиндекарбоксилазой (рис.).
Продукт реакции — гистамин — обладает широким спектром биологического действия. По сосудорасширяющему эффекту на кровеносные сосуды он резко отличается от других биогенных аминов, оказывающих сосудосуживающее действие. Много гистамина образуется в области воспаления, что имеет определенный биологический смысл. Вызывая расширение сосудов в очаге воспаления, гистамин тем самым ускоряет приток лейкоцитов, способствуя борьбе защитных сил организма с инфекцией. Гистамин, кроме того, участвует в секреции НС1 в желудке, что широко используется в клинике при изучении секреторной деятельности желудка (гистаминовая проба). Он имеет прямое отношение к явлениям сенсибилизации и десенсибилизации. При повышенной чувствительности к гистамину в клинике используются антигистаминные препараты (санорин, димедрол и др.), оказывающие влияние на рецепторы сосудов. Гистамину приписывают, кроме того, роль медиатора боли. Болевой синдром, несомненно, является весьма сложным процессом, детали которого пока не выяснены, но участие в нем гистамина не подлежит сомнению.
В клинике широко используются, кроме того, продукт α-декарбоксилирования глутаминовой кислоты — γ-аминомасляная кислота (ГАМК). Фермент, катализирующий эту реакцию (глутаматдекарбоксилаза), является высокоспецифичным:
Интерес к γ-аминомасляной кислоте связан с ее тормозящим действием на деятельность ЦНС. Больше всего γ-аминомасляной кислоты и глутаматдекарбоксилазы обнаружено в сером веществе коры головного мозга, в тo время как белое вещество мозга и периферическая нервная система их почти не содержат. Введение γ-аминомасляной кислоты вызывает разлитой тормозной процесс в коре (центральное торможение) и у животных приводит к утрате условных рефлексов. γ-Аминомасляная кислота используется в клинике при лечении некоторых заболеваний ЦНС, связанных с резким возбуждением коры головного мозга. Так, в практике лечения эпилепсии хороший эффект (резкое сокращение частоты эпилептических припадков) давало введение глутаминовой кислоты. Как оказалось, лечебный эффект был обусловлен не глутаминовой кислотой, а продуктом ее декарбоксилирования γ-аминомаслянной кислотой.
В животных тканях с высокой скоростью декарбоксилируются также два производных цистеина — цистеиновая и цистеинсульфиновая кислоты; в процессе этих специфических ферментативных реакций образуется таурин, который используется в организме для синтеза парных желчных кислот (см. Обмен липидов).
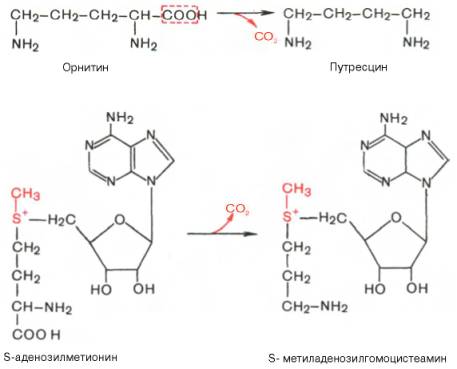
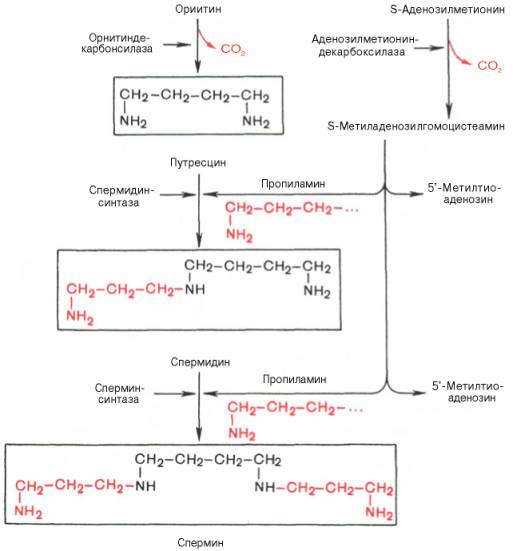
Следует указать еще на два недавно открытых в тканях животных фермента, катализирующих декарбоксилирование орнитина и S-аденозилметионина с образованием путресцина и S-метиладенозилгомоцистеамина:
Значение этих реакций, катализирующихся специфическими орнитиндекарбоксилазой и S-аденозилметиониндекарбоксилазой тканей животных, огромно, если учесть, что путресцин и аминопропильная часть S-метиладенозилгомоцистеамина используются для синтеза полиаминов — спермидина и спермина:
Полиамины, к которым относят также путресцин, оказались необходимыми для регуляции биосинтеза внутриклеточных полимерных молекул (нуклеиновых кислот и белков), хотя конкретная их роль в этом процессе не всегда ясна.
Таким образом, биогенные амины являются сильными фармакологически активными веществами, оказывающими разносторонее влияние на физиологические функции организма. Некоторые биогенные амины нашли широкое применение в качестве лекарственных средств.
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Декарбоксилирование аминокислот
Процесс отщепления карбоксильной группы аминокислот в виде СО2 получил название декарбоксилирования. Несмотря на ограниченный круг аминокислот и их производных, подвергающихся декарбоксилиро-ванию в животных тканях, образующиеся продукты реакции – биогенные амины – оказывают сильное фармакологическое действие на множество физиологических функций человека и животных. В животных тканях установлено декарбоксилирование следующих аминокислот и их производных: тирозина, триптофана, 5-окситриптофана, валина, серина, гистидина, глу-таминовой и γ-оксиглутаминовой кислот, 3,4-диоксифенилаланина, цис-теина, аргинина, орнитина, S-аденозилметионина и α-аминомалоновой кислоты. Помимо этого, у микроорганизмов и растений открыто де-карбоксилирование ряда других аминокислот.
1. α-Декарбоксилирование, характерное для тканей животных, при котором от аминокислот отщепляется карбоксильная группа, стоящая по соседству с α-углеродным атомом. Продуктами реакции являются СО2 и биогенные амины:
2. ω-Декарбоксилирование, свойственное микроорганизмам. Например, из аспарагиновой кислоты этим путем образуется α-аланин:
В этой реакции образуются альдегид и новая аминокислота, соответствующая исходной кетокислоте.
Эта реакция в тканях животных осуществляется при синтезе δ-амино-левулиновой кислоты из глицина и сукцинил-КоА (см. главу 13) и при синтезе сфинголипидов, а также у растений при синтезе биотина.
Реакции декарбоксилирования в отличие от других процессов промежуточного обмена аминокислот являются необратимыми. Они катализируются специфическими ферментами – декарбоксилазами аминокислот, отличающимися от декарбоксилаз α-кетокислот (см. главу 10) как белковым компонентом, так и природой кофермента. Декарбоксилазы аминокислот состоят из белковой части, обеспечивающей специфичность действия, и простетической группы, представленной пиридоксальфосфатом (ПФ), как и у трансаминаз.
Таким образом, в двух совершенно различных процессах обмена аминокислот участвует один и тот же кофермент. Исключение составляют две декарбоксилазы: гистидиндекарбоксилаза Micrococcus и Lactobacilus и аденозилметионин-декарбоксилаза Е. coli, содержащие вместо ПФ остаток пировиноградной кислоты.
Механизм реакции декарбоксилирования аминокислот в соответствии с общей теорией пиридоксалевого катализа (см. рис. 12.3) сводится к образованию ПФ-субстратного комплекса, представленного, как и в реакциях трансаминирования, шиффовым основанием ПФ и аминокислоты:
Образование подобного комплекса в сочетании с некоторым оттягиванием электронов белковой частью молекулы фермента сопровождается лабилизацией одной из трех связей при α-углеродном атоме, благодаря чему аминокислота способна вступать в реакции трансаминирования (а), декарбоксилирования (b) и альдольного расщепления (с).
Далее представлены отдельные примеры декарбоксилирования аминокислот, в частности тех, продукты реакции которых оказывают сильное фармакологическое действие. Одним из хорошо изученных ферментов является декарбоксилаза ароматических аминокислот. Она не обладает строгой субстратной специфичностью и катализирует декарбок-силирование L-изомеров триптофана, 5-окситриптофана и 3,4-диоксифе-нилаланина (ДОФА); продуктами реакций, помимо СО2, являются соответственно триптамин, серотонин и диоксифенилэтиламин (дофамин).
Декарбоксилаза ароматических аминокислот получена в чистом виде (мол. масса 112000), кофермент – ПФ. В больших количествах она содержится в надпочечниках и ЦНС, играет важную роль в регуляции содержания биогенных аминов. Образующийся из 5-окситриптофана серо-тонин оказался высокоактивным биогенным амином сосудосуживающего действия. Серотонин регулирует артериальное давление, температуру тела, дыхание, почечную фильтрацию и является медиатором нервных процессов в ЦНС. Некоторые авторы считают серотонин причастным к развитию аллергии, демпинг-синдрома, токсикоза беременных, карциноидного синдрома и геморрагических диатезов.
Продукт декарбоксилазной реакции дофамин является предшественником катехоламинов (норадреналина и адреналина). Источником ДОФА в организме является тирозин, который под действием специфической гидроксилазы превращается в 3,4-диоксифенилаланин (см. главу 8). Тиро-зин-3-монооксигеназа открыта в надпочечниках, ткани мозга и периферической нервной системы. Простетической группой тирозин-моноокси-геназы, как и дофамин-монооксигеназы (последняя катализирует превращение дофамина в норадреналин) является тетрагидробиоптерин, имеющий следующее строение:
Физиологическая роль тирозин-3-монооксигеназы чрезвычайно велика, поскольку катализируемая этим ферментом реакция определяет скорость биосинтеза катехоламинов, регулирующих деятельность сердечно-сосудистой системы. В медицинской практике широко используются ингибиторы декарбоксилазы ароматических аминокислот, в частности α-метилдофа (альдомет), вызывающий снижение артериального давления.
В животных тканях с высокой скоростью протекает декарбоксилирование гистидина под действием специфической декарбоксилазы.
Гистамин оказывает широкий спектр биологического действия. По механизму действия на кровеносные сосуды он резко отличается от других биогенных аминов, так как обладает сосудорасширяющим свойством. Большое количество гистамина образуется в области воспаления, что имеет определенный биологический смысл. Вызывая расширение сосудов в очаге воспаления, гистамин тем самым ускоряет приток лейкоцитов, способствуя активации защитных сил организма. Кроме того, гистамин участвует в секреции соляной кислоты в желудке, что широко используется в клинике при изучении секреторной деятельности желудка (гистаминовая проба). Он имеет прямое отношение к явлениям сенсибилизации и десенсибилизации. При повышенной чувствительности к гистамину в клинике используют антигистаминные препараты (санорин, димедрол и др.), оказывающие влияние на рецепторы сосудов. Гистамину приписывают также роль медиатора боли. Болевой синдром – сложный процесс, детали которого пока не выяснены, но участие в нем гистамина не подлежит сомнению.
В клинической практике широко используется, кроме того, продукт α-декарбоксилирования глутаминовой кислоты – γ-аминомасляная кислота (ГАМК). Фермент, катализирующий эту реакцию (глутаматдекарбоксилаза), является высокоспецифичным.
Интерес к ГАМК объясняется ее тормозящим действием на деятельность ЦНС. Больше всего ГАМК и глутаматдекарбоксилазы обнаружено в сером веществе коры большого мозга, в то время как белое вещество мозга и периферическая нервная система их почти не содержат. Введение ГАМК в организм вызывает разлитой тормозной процесс в коре (центральное торможение) и у животных приводит к утрате условных рефлексов. ГАМК используется в клинике как лекарственное средство при некоторых заболеваниях ЦНС, связанных с резким возбуждением коры большого мозга. Так, при эпилепсии хороший эффект (резкое сокращение частоты эпилептических припадков) дает введение глутаминовой кислоты. Как оказалось, лечебный эффект обусловлен не самой глутаминовой кислотой, а продуктом ее декарбоксилирования – ГАМК.
В животных тканях с высокой скоростью декарбоксилируются также два производных цистеина – цистеиновая и цистеинсульфиновая кислоты. В процессе этих специфических ферментативных реакций образуется таурин, который используется в организме для синтеза парных желчных кислот (см. главу 11).
Следует указать еще на два недавно открытых в тканях животных фермента, катализирующих декарбоксилирование орнитина и S-аденозилметионина: орнитиндекарбоксилазу и аденозилметиониндекарбоксилазу.
Значение этих реакций для тканей животных огромно, поскольку продукты реакций используются для синтеза полиаминов – спермидина и спермина.
Полиамины, к которым относят также диамин путресцин, играют важную роль в процессах клеточного роста и дифференцировки, в регуляции синтеза ДНК, РНК и белка, стимулируя транскрипцию и трансляцию (см. далее), хотя конкретный механизм участия их в указанных процессах не всегда ясен.
Таким образом, биогенные амины являются сильными фармакологически активными веществами, оказывающими разностороннее влияние на физиологические функции организма. Некоторые биогенные амины нашли широкое применение в качестве лекарственных препаратов.
Распад биогенных аминов. Накопление биогенных аминов может отрицательно сказываться на физиологическом статусе и вызывать ряд существенных нарушений функций в организме. Однако органы и ткани, как и целостный организм, располагают специальными механизмами обезвреживания биогенных аминов, которые в общем виде сводятся к окислительному дезаминированию этих аминов с образованием соответствующих альдегидов и освобождением аммиака:
Ферменты, катализирующие эти реакции, получили название моноамин-и диаминоксидаз. Более подробно изучен механизм окислительного дез-аминирования моноаминов. Этот ферментативный процесс является необратимым и протекает в две стадии:
Первая (1), анаэробная, стадия характеризуется образованием альдегида, аммиака и восстановленного фермента. Последний в аэробной фазе окисляется молекулярным кислородом. Образовавшаяся перекись водорода далее распадается на воду и кислород. Моноаминоксидаза (МАО), ФАД-содержащий фермент, преимущественно локализуется в митохондриях, играет исключительно важную роль в организме, регулируя скорость биосинтеза и распада биогенных аминов. Некоторые ингибиторы моно-аминоксидазы (ипраниазид, гармин, паргилин) используются при лечении гипертонической болезни, депрессивных состояний, шизофрении и др.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Написать уравнение реакции с декарбоксилазы
Задача 7
Что называется буферным действием?
Буферный раствор поддерживает при изменении состава среды постоянство значения какой-либо характеристики, например рН (кислотно-основной буферный раствор ) или окислительно-восстановительнного потенциала (окислительно-восстановительный буферный раствор ).
Значение рН кислотно-основного буферного раствора зависит от концентраций компонентов буферной смеси, находящихся в химическом равновесии , и мало меняется при концентрировании и разбавлении раствора, введении относительно небольших количеств веществ, взаимодействующих с одним из компонентов буферного раствора .
Наиболее распространены водные кислотно-основные буферные растворы . Они содержат слабую кислоту НА и сопряженное с ней основание А -, например, СН3СООН и СН3СОО — , NH4 + и NH3. В таких системах осуществляется равновесие :

По данным о константе диссоциации кислоты Ка = — [Н3О + ]∙[А — ]/[НА] определяют значение рН раствора:
где [НА] и [А — ] -равновесные концентрации соответствующей кислоты и основания ,
Это значение рН остается практически постоянным, т.к. при добавлении небольших количеств сильных кислот или оснований ионы Н3О + или ОН — связываются основанием (кислотой) с образованием сопряженной кислоты ( основания ).
Количественно буферный раствор характеризуется буферной емкостью- производной:
где X — характеристика среды,
с — концентрация одного из компонентов буферной смеси или добавленного вещества, количественно реагирующего с одним из компонентов с образованием другого.
Емкость кислотно-основного буферного раствора соответствует числу эквивалентов сильной кислоты или сильного основания , которое необходимо добавить к 1 л раствора, чтобы изменить его рН на единицу. Буферная емкость возрастает при увеличении начальных концентраций его компонентов и максимальна при их равенстве. Буферные свойства проявляются очень слабо, если концентрация одного компонента в 10 раз и более отличается от концентрации другого. Поэтому буферный раствор часто готовят смешением растворов равной концентрации обоих компонентов либо прибавлением к раствору одного компонента соответствующего количества реагента , приводящего к образованию равной концентрации сопряженной формы. Интервал рН (равный обычно рКа = ± 1), в котором данная буферная система может поддерживать постоянное значение рН, называется областью буферирования. В справочной литературе имеются подробные рецепты приготовления кислотно-основных буферных растворов для различных значений рН.
Окислительно-восстановительный буферный раствор содержит смесь соединений элементов переменной валентности в двух степенях окисления (т. е. смесь обеих форм окислительно-восстановительной пары ), например Fe(III) и Fe(II). Значение окислительно-восстановительного потенциала такого буферного раствора определяется по формуле:
где Ер — реальный потенциал пары в данной среде,
[Ох] и [Red] — концентрации соотв. ее окисленной и восстановленной форм,
n — число электронов , участвующих в окислительно-восстановительной реакции,
R — универсальная газовая постоянная ,
F- число Фарадея,
T — абсолютная температура.
В методах фотометрии пламени (в т.ч. в атомно-абсорбционном анализе ) буферными называют растворы, поддерживающие практически постоянное значение характеристики не самого раствора, а пламени, в которое они вдуваются. Например, такие легкоионизирующиеся вещества, как соли К, обеспечивают концентрацию электронов в пламени, необходимую для подавления ионизации определяемых атомов . В электрохимических методах анализа буферным иногда называют раствор, препятствующий смешению растворов вблизи анода и катода .
Многие биол огические жидкости ( кровь и др.) являются буферными растворами ; компоненты таких растворов — карбонаты , фосфаты и белки .
Вычислите рН буферного раствора, состоящего из 3 мл уксусной кислоты и 12 мл ацетата натрия одинаковой концентрации. Константа диссоциации уксусной кислоты равна 1,8∙10 -5 .
В растворе уксусная кислота и ацетат натрия диссоциируют на ионы:
Константа диссоциации уксусной кислоты:
Отсюда концентрация ионов водорода будет равна:
Учитывая, что [СН3СОО — ] = [СН3СООNa], получим:
Концентрации уксусной кислоты и ацетата натрия в буферном растворе:
Задача 14
Что называется изоэлектрическим состоянием белка? Как заряжены частицы белка при рН = 4,0 и рН = 8,5, если изоэлектрическая точка этого белка равна 5,5?
α-Аминокислоты, из которых состоит первичная структура белков, являются амфотерными соединениями. Это обусловлено наличием в одной молекуле основной (NH2) и кислотной (СООН) групп. Поэтому в зависимости от среды аминокислоты могут существовать в виде катионов и анионов: в кислой среде протонируется аминогруппа, в щелочной — карбоксильная группа превращается в анион (карбоксилат-ион). Лишь в среде, близкой к нейтральной, «нейтральные» аминокислоты существуют в виде биполярного иона (внутренней соли). Привычное изображение аминокислот в виде неионизированного соединения, каким обычно пользуются, является упрощенным.
Важнейшим свойством белков является их способность проявлять как кислые, так и основные свойства, т. е. выступать в роли амфотерных электролитов. Это обеспечивается за счет различных диссоциирующих группировок, входящих в состав радикалов аминокислот. Например, кислотные свойства белку придают карбоксильные группы аспарагиновой и глутаминовой аминокислот, а щелочные — амино- и иминогруппы аргинина, лизина и гистидина. Чем больше дикарбоновых кислот содержится в белке, тем сильнее проявляются его кислотные свой свойства и наоборот.
Эти же группировки имеют и электрические заряды, которые формируют общий заряд белковой молекулы. В белках, где преобладают аспарагиновая и глутаминовая аминокислоты, заряд белка будет отрицательным, избыток основных аминокислот (аргинин, лизин и гистидин) придает положительный заряд белковой молекуле.
Вследствие этого белки будут передвигаться в электрическом поле. В изоэлектрической точке заряд белковой молекулы равен нулю и она не перемещается в электрическом поле.
У белка с изоэлектрической точкой 5,5 в кислой среде (рН = 4,0) подавляется диссоциация карбоксильных групп, и белок приобретает положительный заряд. А в щелочной среде (рН = 8,5) у белка с изоэлектрической точкой 5,5 подавляется диссоциация аминогрупп, и белок приобретает отрицательный заряд.
Задача 29
Опишите роль ферментов, относящихся к классу лиаз. Напишите уравнение реакции, происходящей с участием декарбоксилазы.
К классу лиаз относятся ферменты, ускоряющие негидролитические реакции распада органических соединений по связям С — С; С — N; С — О и т. д. При этом замыкаются двойные связи и выделяются такие простейшие продукты, как СО2, Н2О, NH3 и т. п. Некоторые из этих реакций обратимы, и соответствующие ферменты в подходящих условиях катализируют реакции не только распада, но и синтеза. Таким образом, название этого класса ферментов не всегда соответствует содержанию тех процессов, которые ими ускоряются.
Одной из важнейших групп ферментов этого класса являются углерод-углерод-лиазы (С-С-лиазы). Среди них особое значение имеют карбоксилиазы (декарбоксилазы) и альдегидлиазы.
В природе широко распространены декарбоксилазы кетокислот и аминокислот, катализирующие реакции по следующим схемам:
Эти ферменты двухкомпоненты, простетическими группами их во многих случаях являются фосфорные эфиры водорастворимых витаминов: тиамина (В1) — в карбоксилиазах кетокислот и пиридоксаля (В6) — в карбоксилиазах аминокислот.
Тиаминпирофосфат является коферментом декарбоксилаз кетокислот:
Пиридоксальфосфат является коферментом декарбоксилаз аминокислот:
Характерным представителем альдегидлиаз является альдолаза, катализирующая обратимую реакцию расщепления фруктозо-1,6-дифосфата до фосфотриоз:
Эта реакция занимает центральное место в преобразовании углеводов. Аналогично альдолазе действуют другие альдегидлиазы.
Другую важную группу лиаз составляют углерод — кислород лиазы (гидролиазы), ускоряющие реакции гидратирования и дегидратирования органических соединений. В качестве представителя гидролиаз приведем фумаратгидратазу:
Реакции гидратирования и дегидратирования постоянно идут при распаде и синтезе углеводов и высших жирных кислот, поэтому гидратазы играют большую роль в жизнедеятельности организмов.
Примером углерод-азот лиаз может служить аспартат-аммиак-лиаза, ускоряющая реакцию прямого дезаминирования аспарагиновой кислоты:
Этот фермент характерен для бактерий и ряда растений.
Некоторые лиазы ускоряют реакции не только распада, но и синтеза. Например, из дрожжей выделена L-серин-гидролиаза, отщепляющая от серина воду и присоединяющая сероводород, в результате чего синтезируется аминокислота — цистеин:
Чтобы отличить такие лиазы от ферментов класса лигаз (которые ускоряют реакции только синтеза и именуются в связи с этим синтетазами), их называют также синтазами.
Задача 40
Особенности обмена белков у птиц и рептилий (урикотелических животных). Напишите формулу мочевой кислоты.
Общая схема переваривания и всасывания белков в желудочно-кишечном тракте представлена на рисунке 1.
Рисунок 1 — Переваривание и всасывание белков
в желудочно-кишечном тракте
В полости рта белки не расщепляются, так как здесь отсутствуют протеолитические ферменты (протеазы). В желудке начинается активное переваривание белков под действием протеаз — пепсина и гастриксина, которые в сильно кислой среде желудочного сока проявляют максимальную активность (оптимум рН 1,5 — 2,5).
Кислая среда создается за счет соляной кислоты, которая вырабатывается обкладочными клетками слизистой оболочки желудка и выполняет многообразные функции в желудочно-кишечном тракте, в частности способствует денатурации белков пищи, что существенно облегчает их гидролиз ферментами.
Из протеолитических ферментов основным является пепсин, который образуется из своего профермента пепсиногена путем отщепления от него определенного полипептида при участии в этом процессе соляной кислоты или активного пепсина (рисунок 2).
Рисунок 2 — Строение пепсиногена
За сутки в желудке вырабатывается до 2 г пепсина. Пепсин, расщепляя пептидные связи, вызывает распад белков до отдельных аминокислот или полипептидов. Он гидролизует связи, образованные главным образом ароматическими и дикарбоновыми аминокислотами. Другой протеазой желудка является гастриксин, оптимум рН которого лежит в пределах 3,5 — 4,5. Наличие в желудке двух ферментов с разным оптимумом рН физиологически оправдано. В начале процесса переваривания белков рН желудочного сока составляет 1,0 — 1,5, но затем меняется до слабокислого (рН 4 — 5). Это связано с частичной нейтрализацией кислого содержимого желудка веществами щелочной природы, выделяющимися при переваривании пищи. Поэтому в начале пищеварения основное влияние на белки оказывает пепсин, а по мере сдвига рН и снижения активности пепсина возрастает каталитическое действие гастриксина. В желудке идет активный процесс гидролиза альбуминов и глобулинов и значительно хуже — коллагена и эластина.
В желудочном соке у детей обнаружен химозин (реннин), створаживающий молоко и расщепляющий казеиноген. В процессе роста ребенка активность его снижается.
В кишечнике полипептиды и нерасщепившиеся белки гидролизуются ферментами поджелудочной железы и клеток слизистой тонкой кишки (трипсином, химотрипсином, амино- и карбоксипептидазами, ди- и трипептидазами и др.), которые в слабощелочной среде кишечника (рН 7,8 — 8,2) проявляют максимальную активность.
Трипсин вырабатывается в виде своего профермента трипсиногена и активируется энтерокиназой или ранее образованным трипсином. Трипсин гидролизует пептидные связи, образованные в основном аргинином и лизином. Химотрипсин синтезируется из химотрипсиногена под действием трипсина и расщепляет пептидные связи в белках или полипептидах между ароматическими аминокислотами, а также те, которые не были гидролизованы трипсином. Механизм действия амино- и карбоксипептидаз заключается в гидролизе концевых аминокислот, имеющих свободную аминную или карбоксильную группы (рисунок 3).
Рисунок 3 — Места действия амино-, карбокси- и дипептидаз
Оставшиеся нерасщепленными небольшие пептиды, состоящие из трех — четырех аминокислотных остатков, подвергаются воздействию специфических ди-, три- и тетрапептидаз (рисунок 4), но уже в клетках слизистой оболочки кишечника.
Рисунок 4 — Места действия протеолитических ферментов
Таким образом, в результате переваривания белков в пищеварительном тракте образуются свободные аминокислоты, которые поступают в кровь и по воротной вене — в печень. Около 5 % из них попадает в лимфу.
В печени значительная часть аминокислот идет на синтез специфических белков (альбуминов, глобулинов, фибриногена, ферментов и др.), другая же часть током крови разносится к органам и тканям, где используется клетками. У человека в норме концентрация аминокислот в крови поддерживается на постоянном уровне.
Гниение белков в кишечнике — процесс распада аминокислот и белков под действием ферментов микроорганизмов толстой кишки. При этом образуются токсичные вещества (путресцин, кадаверин, фенол, крезол, скатол и др.), которые всасываются и поступают по воротной вене в печень, где обезвреживаются при участии активированной серной кислоты (ФАФС — фосфоаденозинфосфосульфат) или глюкуроновой кислоты (УДФГК — уридиндифосфоглюкуроновая кислота). В результате они превращаются в безвредные для организма продукты типа фенолсерной, крезолглюкуроновой и других кислот и выводятся мочой.
Продукт обезвреживания индола — калиевая соль индоксилсерной кислоты, или животный индикан, — выделяется с мочой в значительных количествах при длительной задержке продуктов переваривания белков в кишечнике (атонии кишечника, хронических запорах и т. д.). Бензойная кислота обезвреживается в печени путем образования с глицином гиппуровой кислоты, которая выводится с мочой. Эта реакция служит в клинике показателем антитоксической функции печени (проба Пытеля — Квика). В норме через 4 ч после введения в организм бензойной кислоты в моче обнаруживается 65 — 85 % гиппуровой кислоты. Ее выделение существенно снижается при тяжелых поражениях паренхимы печени.
В результате многообразных процессов в организме аминокислоты полностью распадаются до углекислого газа и воды. Вода является веществом для всех обменных процессов, газ участвует в построении карбонатной буферной системы, в активированной форме используется для синтеза жирных кислот, пуриновых и пиримидиновых оснований, углеводов (в процессе глюконеогенеза). Оставшаяся его часть выводится из организма легкими. Аммиак является одним из источников азота в организме (рисунок 5).
Рисунок 5 — Азотный фонд организма
Как видно, азот используется для поддержания азотистого равновесия, в том числе для синтеза белка, построения небелковых азотсодержащих веществ (пуриновых и пиримидиновых азотистых оснований, холина, креатина, глюкозаминов и пр.). Однако определенная часть азота оказывается связанной в форме аммиака, который для организма является токсичным. Однако отравление им не происходит, так как в организме весьма активны процессы обезвреживания аммиака. Важное значение в этом принадлежит глутаминовой кислоте и ее производным. Так, -кетоглутаровая кислота может связать одну молекулу аммиака, превратившись при этом в глутаминовую кислоту. Такая реакция называется восстановительным аминированием. В свою очередь глутаминовая кислота может связать еще одну молекулу аммиака с образованием своего амида — глутамина. При этом аммиак присоединяется по месту -карбоксильной группы. Сходный процесс активно протекает и с участием аспарагиновой кислоты.
Таким путем происходит связывание аммиака в местах его непосредственного образования (клетки печени, мозга) и возможное повторное использование его азота. Образовавшиеся глутаминовая кислота и глутамин включаются в разнообразные процессы обмена, в том числе в реакции синтеза пуриновых и пиримидиновых азотистых оснований, составных частей нуклеиновых кислот.
Известны и другие пути обезвреживания аммиака, например путем образования аммонийных солей.
Однако основным процессом связывания аммиака является синтез мочевины, которая выводится из организма с мочой. Из азотсодержащих веществ мочи на долю мочевины приходится 80 — 85 %.
В расшифровке биосинтеза мочевины приоритет принадлежит отечественному ученому М. А. Ненцкому. Он впервые высказал гипотезу, что мочевина образуется из двух молекул аммиака и молекулы углекислого газа:
В дальнейшем И. В. Залесский и С. С. Салазкин доказали, что этот процесс происходит в печени, а Г. Кребс, Г. Эмбден и др. уточнили детали синтеза и предложили общую схему биосинтеза мочевины (рисунок 6):
Рисунок 6 — Синтез мочевины
Процесс синтеза мочевины можно условно разделить на три этапа. На первых двух этапах две молекулы аммиака связываются в безвредные для организма соединения, а на третьем этапе происходит образование непосредственно самой мочевины.
I этап: из молекулы аммиака и углекислого газа при участии АТФ синтезируется карбамоилфосфат, который, соединяясь с орнитином, образует цитруллин.
II этап: это этап связывания еще одной молекулы аммиака путем восстановительного аминирования. При этом аммиак фиксируется в глутаминовой кислоте, а последняя в ходе переаминирования передает его в аспарагиновую кислоту.
III этап: происходит взаимодействие между цитруллином и аспарагиновой кислотой с образованием аргинина, который расщепляется аргиназой с выделением мочевины. Образовавшаяся в печени мочевина поступает в кровь, где ее содержание в норме составляет 3,33 — 6,66 ммоль/л (20 — 40 мг %), и выводится из организма почками.
Задача 48
Цикл трикарбоновых кислот и его биологическое значение. Напишите уравнение реакции образования лимонной кислоты из щавелевоуксусной кислоты и ацетил-КоА.
Цикл Кребса представляет собой полное окисление ацетил-КоА с образованием углекислого газа и освобождением водорода (рисунок 7).
Рисунок 7 — Цикл Кребса
Этот этап протекает одинаково во всех клетках, точнее в матриксе их митохондрий. Цикл Кребса представляет собой замкнутую систему реакций, начинающуюся со взаимодействия ацетил-КоА и щавелево-уксусной кислоты с образованием лимонной кислоты, которая, проходя через ряд стадий, вновь превращается в щавелево-уксусную кислоту. Среди других соединений цикла Кребса особое значение принадлежит изолимонной, -кетоглутаровой, янтарной и яблочной кислотам. Именно эти кислоты подвергаются окислению. Оно катализируется ферментами дегидрогеназами, коферментами которых являются производные витаминов (НАД, ФАД и др). Так, никотиновая кислота входит в состав НАД, а рибофлавин — ФАД. Механизм действия дегидрогеназ заключается в том, что, окисляя вещества, они отщепляют от них атомы водорода, которые присоединяются к коферментам: НАД превращается в НАДН2, ФАД — в ФАДН2 и т. д.
Задача 54
β-окисление жирных кислот. Напишите уравнение реакций превращения масляной кислоты в два ацетил-КоА.
Наибольший интерес в процессах обмена продуктов гидролиза триглицеридов представляет судьба высших жирных кислот. Первые гипотезы относительно механизма их распада были высказаны в начале нашего столетия (Ф. Кнооп, 1904). В дальнейшем они были уточнены и развиты благодаря работам лабораторий Ф. Линена, Д. Грина, С. Очоа, Г. Ларди и А. Ленинджера. Современные данные по этому вопросу сводятся к следующему. Считают, что высшие жирные кислоты разрушаются преимущественно путем β-окисления. Ненасыщенные высшие жирные кислоты (олеиновая, линолевая, линолеиовая и др.) предварительно восстанавливаются до предельных кислот. Окисление предельных высших жирных кислот осуществляется ступенчато, путем отщепления от их молекул двууглеродных фрагментов. Все реакции многостадийного окисления ускоряются специфическими ферментами, причем начиная с третьей фазы они собраны в виде метаболона с М = 260 000 Да.
Первая фаза распада высших жирных кислот заключается в активировании их путем образования соединения с коэнзимом А (КоА), содержащего макро-эргическую связь. Последняя, видимо, способствует более гладкому протеканию реакций окисления образовавшегося соединения, которое называют ацил-коэнзимом А (ацил-КоА). Взаимодействие высших жирных кислот с КоА ускоряется специфическими лигазами — ацил-КоА-синтетазами трех видов специфичных соответственно для кислот с коротким, средним и длинным углеводородными радикалами. Они локализованы в мембранах эндоплазматической сети и в наружной мембране митохондрий. По-видимому, все ацил-КоА-синтетазы являются мультимерами; так, фермент из микросом печени имеет М = 168 000 и состоит из 6 идентичных субъединиц с М = 28000.
Уравнение реакции активирования высших жирных кислот перед их окислением таково:
Образующийся в этой реакции пирофосфат энергично расщепляется до Н3РО4 при участии пирофосфатазы, что обеспечивает смещение равновесия всего процесса вправо.
Вторая фаза распада высших жирных кислот состоит в окислении ацил-КоА при посредстве ацил-КоА-дегидрогеназы, содержащей флавинадениндину-клеотид (ФАД) в качестве кофермента:
Существует, по меньшей мере, три ацил-КоА-дегидрогеназы, предпочитающие короткие, средние и длинные ацильные радикалы соответственно.
Третья фаза окисления высших жирных кислот состоит в присоединении молекулы воды по месту двойной связи дегидроацил-КоА. Эта реакция ускоряется соответствующими гидролназами. Так как присоединение воды (гидратация) идет по двойной связи (двойная связь условно обозначается частицей ен), то эти ферменты по современной номенклатуре называют еноил-КоА-гидратазами. Один из них специфичен к цисформам дегидроацил-КоА, другой — к трансформам:
Четвертая фаза распада высших жирных кислот заключается в еще одном окислении путем отнятия двух атомов водорода от β-углеродного атома (отсюда и весь рассматриваемый здесь механизм носит название β-окисления). Как и во второй фазе процесса, снятие атомов водорода осуществляется оксидоредуктазой, но с НАД + в качестве кофермента. Фермент специфичен лишь к L-форме β-оксиацил-КоА:
Наконец, последняя, пятая фаза распада сводится к переносу предобразо-ванной в молекуле β-кетоацил-КоА новой ацильной группировки на молекулу КоА. Этот процесс ускоряется соответствующей ацилтрансферазой, которую предпочитают называть тиолазой, так как сама реакция, по существу, представляет расщепление С — С-связи с присоединением по месту разрыва элементов НS-группы (тиолиз):
Рисунок 8 — Спираль β- окисления высших жирных кислот
В результате описанных выше реакций молекула высшей жирной кислоты (стеариновой в нашем примере) укорачивается на два углеродных атома и образуются пальмитиновая и уксусная кислоты в виде производных КоА (пальмитил- и ацетил-КоА). Этот процесс многократно повторяется (рисунок 6). Окончательным продуктом β-окисления высших жирных кислот с четным числом углеродных атомов является ацетил-КоА, а с нечетным — пропионил-КоА.
Если бы ацетил-КоА накапливался в организме, то запасы НSКоА скоро исчерпались бы и окисление высших жирных кислот остановилось. Но этого не происходит, так как КоА быстро освобождается из состава ацетил-КоА. К этому приводит ряд процессов: ацетил-КоА включается в цикл трикарбоновых и дикар-боновых кислот или весьма близкий к нему глиоксилевый цикл, или, наконец, ацетил-КоА используется для синтеза полициклических спиртов (стеролов) и соединений, содержащих изопреноидные группировки и т. п.
β-Окисление высших жирных кислот протекает в митохондриях. Естественно, что, поскольку в них же локализованы ферменты дыхательного цикла, ведущие передачу атомов водорода и электронов на кислород сопряжено с окислительным фосфорилированием, β-окисление высших жирных кислот может явиться источником энергии для синтеза АТФ.
Задача 67
Белки молока. Напишите уравнение реакции образования эфира из серина и фосфорной кислоты.
Белковые вещества молока можно разделить на 4 фракции: казеиновая (2,80 %), лактоальбуминовая (0,43 %), лактоглобулиновая (0,06 %), протеозо-пептонная (0,01 %). Основными белковыми веществами молока являются казеин и альбумин.
Казеин. Содержание казеина составляет около 85 % от общего количества белковых веществ в молоке.
Казеин в молочной железе вымени соединяется с кальцием и фосфорной кислотой и в молоко поступает в виде казеинкальцийфосфатного комплекса, который образует мицеллы. Диаметр этих мицелл колеблется от 30 до 800 нм.
В молоке частиц казеинкальцийфосфатного комплекса размером до 40 нм встречается 30 %, от 40 до 80 нм — 30 %, от 80 до 120 нм — около 30 % и до 240 нм — около 10 %. Величина частиц казеина в молоке поддерживается существующим в нем солевым равновесием. Добавление в молоко воды (не содержащей кальция) снижает размеры его частиц.
Казеинкальцийфосфатные мицеллы дают в молоке устойчивую коллоидную систему, которая поддерживается в первую очередь связыванием казеинкальцийфосфатными частицами значительного количества воды. Это обусловливается тем, что на поверхности казеина имеются гидрофильные функциональные группы (NН2, СООН, SН и др.), которые связывают до 69 % воды от веса казеина.
Стойкость белкового казеинового раствора может быть нарушена кислотами (молочной при скисании молока) и ферментами, разрушающими комплекс. В результате этого, казеин отделяется. Так как он нерастворим в воде, то выпадает в осадок, а при спокойном состоянии жидкости может образовать сгусток — желеобразную массу той или иной плотности.
Выделенный из молока после разрушения комплекса казеин может быть очищен и получен химически чистый препарат, который обладает всеми свойствами казеина-белка. В таком виде казеин характеризуется следующими показателями. Это белое аморфное вещество без запаха и вкуса, практически не растворяется в воде.
Высушенный казеин гигроскопичен. Хранить его нужно в закрытой таре в сухом помещении. В молекулу казеина входит углерод, азот, водород, кислород, сера и фосфор. Фосфор находится частично в виде фосфорной кислоты, образующей эфирную связь с оксиаминокислотами (серином и треонином) казеиновой молекулы. Молекулярный вес казеина около 30000.
Казеин является смесью не менее, чем одиннадцати фракций казеина, из которых три фракции — альфа (), бета (β) и гамма (γ) наиболее изучены. Они отличаются одна от другой содержанием фосфора, серы и отношением к сычужному ферменту — на γ-казеин он не действует. В -казеине находится около 1 % фосфора, в β-казеине — около 0,6 %, в γ-казеине — около 0,1 %.
Распределение казеина по фракциям, очевидно, зависит от кормления, породы, стадии лактации животных. Приблизительно фракции казеина в молоке распределяются так: — 50-60 %, β — 25-35 %, γ — 10-15 %.
Казеин, как и все белки, — сложное соединение аминокислот, в которых имеются свободные аминные (основные) и кислотные группы. Таким образом, казеин — амфотерный электролит, способный диссоциировать как кислота и как основание в зависимости от реакции среды, а также образовывать соли с кислотами и основаниями. Реакция казеина кислая: для нейтрализации его в растворе нейтральной соли при индикаторе фенолфталеине требуется около 8,1 мл 0,1 н раствора щелочи на 1 г казеина.
Из соединений казеина наибольший интерес представляют соли щелочных и щелочноземельных металлов — казеинаты. Казеинаты, образованные со щелочными металлами, растворяясь в воде, образуют прозрачные или слегка опалесцирующие (рассеивающие свет) жидкости. Известно несколько соединений казеина со щелочными металлами, обладающих клеющими свойствами.
Казеин растворяется в минеральных и органических кислотах с образованием вязких коллоидных трудно фильтрующихся жидкостей. Свободные аминогруппы казеина обусловливают образование с кислотами двойных растворимых солей:
серная казеин двойная соль казеина
Свободные аминогруппы в молекуле белка вызывают реакцию казеина с формалином:
казеин формалин казеин метилированный белок
казеин формалин метилированный казеин
Такая реакция наблюдается при консервировании молока формалином. Образование метилированного казеина вследствие разрушения в нем аминных групп, обладающих щелочной реакцией, вызывает увеличение кислотности казеина. Это же свойство казеина используются при определении белков в молоке формольным методом.
При добавлений в молоко кислоты из казеинового комплекса выделяется кальций. Когда реакция достигает изоэлектрической точки (равенства положительных и отрицательных зарядов), частицы белка укрупняются и коагулируют, так как нейтральные в электрическом отношении частицы казеина перестают отталкиваться при ударах. По обе стороны от изоэлектрической точки осажденный казеин вновь переходит в коллоидный раствор.
Казеин молока осаждают уксусной, молочной, серной и другими кислотами. Серная кислота хорошо осаждает казеин из молока, но вследствие нерастворимости образующегося сернокислого кальция казеин обогащается золой. Казеин в лабораторных условиях чаще осаждают уксусной кислотой, однако получающийся сгусток трудно фильтруется и легко растворяется в избытке кислоты.
Более целесообразно для осаждения его использовать молочную кислоту, так как получается плотный сгусток и разведенная кислота не растворяет казеин. Только при большом избытке ее образуются растворимые соли казеина с молочной кислотой — лактаты казеина.
Прибавление в молоко раствора хлористого кальция (особенно при повышении температуры) вызывает укрупнение частиц казеинатов и коагуляцию их. Это связано со снижением электрического заряда у казеината под влиянием положительно заряженных ионов двухвалентного кальция, а также, вероятно, с дополнительным насыщением казеинового комплекса кальцием.
Альбумин (лактоальбуминовая фракция). В молоке содержится около 0,43 % альбумина. Количество его повышается в молозиве, где оно достигает в первый день после отела иногда 2 %, а затем 0,5 — 0,8 %. Значительно больше, чем в коровьем молоке, содержится альбумина в молоке ослиц и кобылиц. По существующей классификации лактоальбуминовая фракция подразделяется на 5: β-лактоглобулин кристаллический А и В; -лактоальбумин, -лактоглобулин и альбумин сыворотки крови. β-фракция альбумина одинакова с кристаллическим глобулином, поэтому она получила название β-лактоглобулина.
Альбумин растворим в воде, но выпадает из раствора при нагревании до 70 -80 0 С. Выпавший в осадок альбумин вновь в воде не растворяется, так как при нагревании изменяется строение белковой молекулы альбумина происходит денатурация его. При пастеризации и нагревании молока на стенках аппарата и посуды, в которых проводят нагревание, образуется осадок — молочный камень, который состоит в основном из выпавшего альбумина.
В кислых растворах при нагревании альбумин выделяется хлопьями. В нейтральных жидкостях (например, в некислой молочной сыворотке) альбумин может быть высален насыщенным раствором сернокислого аммония, сернокислым натрием, танином и пр.
Молекулярный вес альбумина близок к молекулярному весу казеина. При действии сычужного фермента альбумин не свертывается. В молекуле альбумина фосфора нет, поэтому он относится к простым белкам. Реакция альбумина кислая, по величине близкая к казеину. В химическом отношении он также аналогичен казеину, образует соединения как со щелочами, так и с кислотами.
Молекулы и частички альбумина сильно гидратированы (как бы окружены слоем воды). Этим объясняется растворимость альбумина в молоке и то, что он не коагулирует в изоэлектрической точке. Молекулы и частички белка при большой гидратированности могут находиться в растворе, несмотря на уменьшение их электрического заряда или даже при полном отсутствии его.
Гидратация понижает поверхностную энергию коллоидной частицы. Вокруг коллоидной частицы белка группируются молекулы воды. Первый слой их более плотно соединен с коллоидной частицей, а связь последующих слоев ослабевает. Там, где частицы альбумина имеют значительные водные слои, поверхностная энергия очень мала и вероятность сцепления частиц белка между собой сведена до минимума, поэтому растворимое состояние молекул альбумина остается устойчивым.
При недостаточной гидратации частиц белка водный слой становится слабым и частицы их при потере электрического заряда стремятся соединиться, укрупняясь и коагулируя.
Частицы альбумина гидратированы в большей степени, чем казеина, поэтому в изоэлектрической точке они не коагулируют, хотя устойчивость их вследствие нейтрализации электрических зарядов уменьшается. Спирт, отнимая от альбумина воду, нарушает его устойчивость в растворе, и альбумин выпадает в осадок.
Сыр, выработанный из молока с большим содержанием альбумина, — пониженного качества, так как денатурированные при нагревании частицы альбумина не подвергаются такому же процессу созревания, как остальная масса сыра.
Подробное изучение альбумина молока показало, что β-лактоглобин существует в двух фракциях — альфа и бета. Альфа-фракция молочного альбумина получена в кристаллическом виде, она совпадает с альбумином сыворотки крови.
Молочный глобулин (лактоглобулиновая фракция). Он подразделяется на 2 фракции — эвглобулин и псевдоглобулин. В молозиве первых удоев после отела содержание глобулина повышается от 0,06 до 5 %. В этот период лактоглобулин передает иммунные свойства молозива телятам и другому молодняку. В первые дни жизни в организме молодняка еще не образовались вещества, защищающие его от ряда заболеваний. Молозиво первых удоев богато этими защитными иммунными веществами, поэтому скармливание его молодняку необходимо для нормального развития организма. В дальнейшем количество глобулина в обычном молоке снижается до 0,06 %.
В молоке глобулин находится в растворенном состоянии. При нагревании раствора, имеющего слабокислую реакцию, до 75 0 С глобулин выпадает в осадок. Обычно при пастеризации он осаждается вместе с альбумином молока.
Выделить глобулины можно при полном насыщении молочной сыворотки сернокислым магнием, осадок глобулина надо отфильтровать и диализом освободить от минеральных солей.
Протеозо-пептонная фракция и другие белки. К протеозо-пептонной фракции белков относятся термоустойчивые сывороточные белки, не коагулирующие под действием кислот за исключением трихлоруксусной и фосфорновольфрамовой. Эти вещества являются поверхностно-активными.
Незначительное количество белков попадает в молоке из клеток молочной железы в момент образования молока, а также из содержащихся в оболочках жировых шариков лецитино-белковых соединений. Кроме того, в молоке находятся белки бактериальных клеток, ферментов.
Жестокость, как всякое зло, не нуждается в мотивации; ей нужен лишь повод. Джордж Элиот
ещё >>
🔥 Видео
Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

Уравнивание реакций горения углеводородовСкачать

Как составлять ХИМИЧЕСКИЕ УРАВНЕНИЯ | 4 лайфхака - 95 ВСЕХ РЕАКЦИЙ в химии!Скачать

8 класс. Составление уравнений химических реакций.Скачать

Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Как расставлять коэффициенты в уравнениях реакций? #shorts #youtubeshortsСкачать

Ионные уравнения реакций. Как составлять полные и сокращенные уравненияСкачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

8 класс. Химия. Как расставить коэффициенты в уравнении?Скачать

ХИМИЧЕСКИЕ УРАВНЕНИЯ | Как составлять уравнения реакций | Химия 8 классСкачать

Химия | Молекулярные и ионные уравненияСкачать

Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Решение задач на термохимические уравнения. 8 класс.Скачать

Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

Составление уравнений реакций горения. 11 класс.Скачать

25. Схема реакции и химическое уравнениеСкачать

Составление уравнений реакций. 1 часть. 9 класс.Скачать