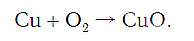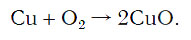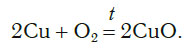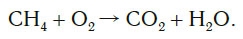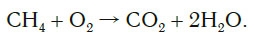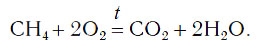В уроке 12 «Составление уравнений химических реакций» из курса «Химия для чайников» мы научимся составлять уравнения химических реакций и правильно расставлять в них коэффициенты.
Составлять химические уравнения и производить расчеты по ним нужно, опираясь на закон сохранения массы веществ при химических реакциях. Рассмотрим, как можно составить химическое уравнение, на примере реакции меди с кислородом.
Слева запишем названия исходных веществ, справа — продуктов реакции. Если веществ два и более, соединяем их знаком «+». Между левой и правой частями пока поставим стрелку:
медь + кислород → соединение меди с кислородом.
Подобное выражение называют схемой химической реакции. Запишем эту схему при помощи химических формул:
Число атомов кислорода в левой части схемы равно двум, а в правой — одному. Так как при химических реакциях атомы не исчезают, а происходит только их перегруппировка, то число атомов каждого элемента до реакции и после реакции должно быть одинаковым. Чтобы уравнять число атомов кислорода в левой и правой частях схемы, перед формулой CuO ставим коэффициент 2:
Теперь число атомов меди после реакции (в правой части схемы) равно двум, а до реакции (в левой части схемы) — только одному, поэтому перед формулой меди Cu так же поставим коэффициент 2. В результате произведенных действий число атомов каждого вида в левой и правой частях схемы одинаково, что дает нам основание заменить стрелку на знак «=» (равно). Схема превратилась в уравнение химической реакции:
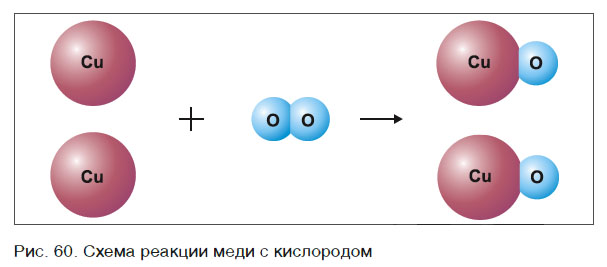
Это уравнение читается так: два купрум плюс о-два равно два купрум-о (рис. 60).
Рассмотрим еще один пример химической реакции между веществами СН4 (метан) и кислородом. Составим схему реакции, в которой слева запишем формулы метана и кислорода, а справа — формулы продуктов реакции — воды и соединения углерода с кислородом (углекислый газ):
Обратите внимание, что в левой части схемы число атомов углерода равно их числу в правой части. Поэтому уравнивать нужно числа атомов водорода и кислорода. Чтобы уравнять число атомов водорода, поставим перед формулой воды коэффициент 2:
Теперь число атомов водорода справа стало 2×2=4 и слева — также четыре. Далее посчитаем число атомов кислорода в правой части схемы: два атома кислорода в молекуле углекислого газа (1×2=2) и два атома кислорода в двух молекулах воды (2×1=2), суммарно 2+2=4. В левой части схемы кислорода только два атома в молекуле кислорода. Для того чтобы уравнять число атомов кислорода, поставим коэффициент 2 перед формулой кислорода:
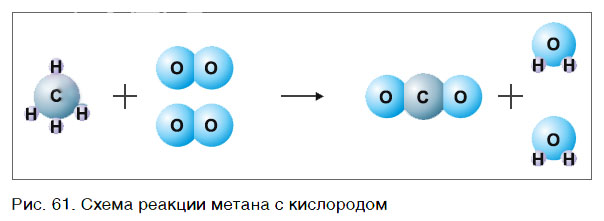
В результате проведенных действий число атомов всех химических элементов до реакции равно их числу после реакции. Уравнение составлено. Читается оно так: це-аш-четыре плюс два о-два равно це-о-два плюс два аш-два-о (рис. 61).
Данный способ расстановки коэффициентов называют методом подбора.
В химии существуют и другие методы уравнивания чисел атомов элементов в левой и правой частях уравнений реакций, с которыми мы познакомимся позднее.
Краткие выводы урока:
Для составления уравнений химических реакций необходимо соблюдать следующий порядок действий.
- Установить состав исходных веществ и продуктов реакции.
- Записать формулы исходных веществ слева, продуктов реакции — справа.
- Между левой и правой частями уравнения сначала поставить стрелку.
- Расставить коэффициенты, т. е. уравнять числа атомов каждого химического элемента до и после реакции.
- Связать левую и правую части уравнения знаком «=» (равно).
Надеюсь урок 12 «Составление уравнений химических реакций» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии. Если вопросов нет, то переходите к следующему уроку.
Видео:Химические Цепочки — Решение Цепочек Химических Превращений // Химия 8 классСкачать

Химия, Биология, подготовка к ГИА и ЕГЭ
Вопрос А12 теста ЕГЭ по химии — «Взаимосвязь неорганических веществ»
Если посмотрите это задание в вариантах ЕГЭ, то там дана схема превращений неорганических веществ и в ответах даны варианты реагентов. Как решать такие задачи?
Темы, которые нужно знать:
Видео:Химические Цепочки — Решение Цепочек Химических Превращений // Химия 8 классСкачать

Составить уравнения реакций по схеме превращений
На самом деле это не так и сложно. Для этого необходимо знать типы реакций и основные условия их протекания.
1. Химические реакции соединения
- Реакция горения — одна из самых распространенных химических реакций соединения — все вещества горят — и металлы, и неметаллы:
- Химические реакции соединения металла и неметалла — приводят к образованию солей:
(а вот этот момент надо запомнить (или выучить) — железо при взаимодействии с соляной кислотой дает хлорид железа (II), а с хлором — простым веществом — хлорид железа (III))
- Неметаллы также могут взаимодействовать между собой:
2. Составление уравнений реакций по схеме — реакции разложения
- Обычно уравнения реакций разложения солей дают соответствующие основные и кислотные оксиды:
Исключения:
- по-другому разлагаются нитраты — в зависимости от металла, входящего в состав соли. Это можно прочитать >;
- хлорид аммония — NH4Cl — разлагается до аммиака и соляной кислоты: NH4Cl = NH3 + HCl;
- не разлагаются сульфаты
- соли, образованные сильными окислителями:
- Разлагаются некоторые основания:
3. Составление уравнений реакций по схеме — п римеры реакций замещения
- реакция замещения водорода в кислотах:
когда нам дана реакция замещения металлом водорода в кислотах, нужно учитывать электрохимический ряд напряжений металлов: металлы, находящиеся в ряду ДО водорода, вытесняют его из кислот:
2Na + 2HCl = 2NaCl + H2
- реакции замещения в солях:
Ca + 2NaCl = CaCl2 +2 Na
Правило: предыдущий металл вытесняет последующий из его солей
(т.е. реакция Na + CaCl2 не будет идти)
4. Составление уравнений реакций по схеме — р еакции обмена веществ
Здесь следующие правила — обменные реакции идут в сторону образования продуктов при:
- выпадении осадка: NaCl + AgNO3 = AgCl↓ + NaNO3
- выделении газа: Na2CO3 + HCl = NaCl + CO2 + H2O ;
- образовании малодиссоциирующего вещества (H2O, NH4OH, органические кислоты и соли и т.д.): NaOH + H2SO3 = Na2SO3 + H2O
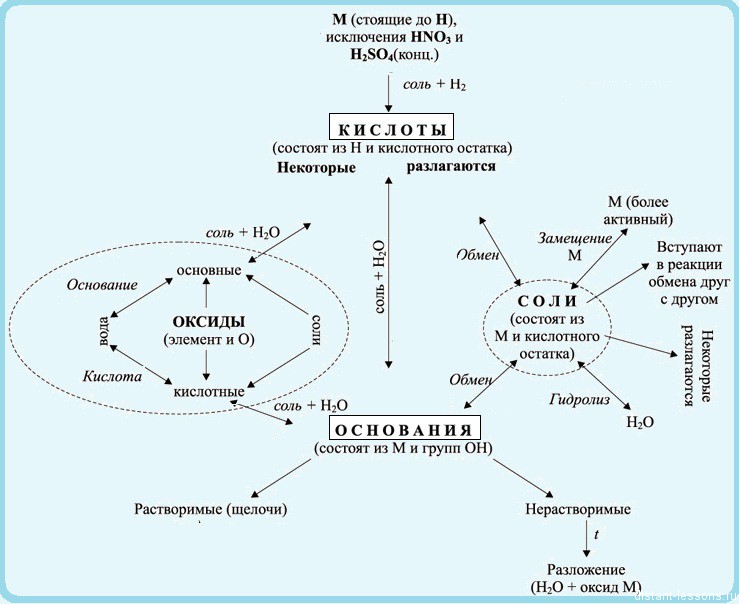
Взаимосвязь неорганических веществ можно отобразить такой таблицей:
Теория, это, конечно, хорошо, но давайте попрактикуемся — попробуем составить уравнения реакций по схемам превращений
В первой реакции к меди можно прибавить либо AgNO3, либо HNO3 — в ряду напряжений медь стоит до серебра, а азотная кислота будет давать окислительно-восстановительную реакцию.
Во второй части схемы нам подходит K2S или H2S, т.к. сульфид меди — осадок.
Ответ: 1)
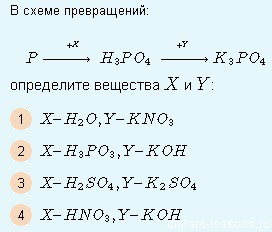
Составим уравнения реакций для данной схемы превращений:
Первая реакция — переход фосфора в фосфорную кислоту — такое под силу только мощным окислителям — либо серной, либо азотной кислоте.
Вторая реакция — обменная — K2SO4 даст растворимые продукты, а вот KOH — в самый раз! Получится вода — малодиссоциирующее вещество.
Видео:Решение цепочек превращений по химииСкачать

Написать уравнение по схеме превращений
Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
Напишем уравнения реакции, соответствующие схеме превращений:
1)
2)
3)
Составим сокращённое ионное уравнение для второго превращения:
4)
Можно ли записать реакцию в виде Сu(NO3)2=CuO+N2O5
Нет, потому что разложение нитрата меди выглядит так
Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
Напишем уравнения реакции, соответствующие схеме превращений:
1)
2)
3)
Составим сокращённое ионное уравнение для второго превращения:
4)
Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
Напишем уравнения реакции, соответствующие схеме превращений:
1)
2)
3)
Составим сокращённое ионное уравнение для третьего превращения:
4)
🎬 Видео
Как решать ОРГАНИЧЕСКИЕ ЦЕПОЧКИ? Основные типы химических реакцийСкачать

8 КЛАСС | Как решать ЦЕПОЧКИ ХИМИЧЕСКИХ РЕАКЦИЙ | Цепочки превращенийСкачать

8 класс. Цепочки превращений. Генетические ряды.Скачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

11-класс | Химия | Составление уравнений по схеме превращенийСкачать

Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

ОГЭ. Задание 21. Цепочка превращений.Скачать
Задание 21 – решаем на максимум | Химия ОГЭ 2023Скачать

Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

Как составлять ХИМИЧЕСКИЕ УРАВНЕНИЯ | 4 лайфхака - 95 ВСЕХ РЕАКЦИЙ в химии!Скачать

Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

схема превращенийСкачать

8 класс. ОВР. Окислительно-восстановительные реакции.Скачать

Химические Цепочки — ТОП 5 ошибок при решении химических цепочек // Химия 8 КлассСкачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Химия | Молекулярные и ионные уравненияСкачать