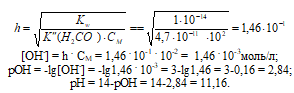BeSO4 — соль образованная слабым основанием и сильной кислотой, поэтому реакция гидролиза протекает по катиону.
- Первая стадия (ступень) гидролиза
- Вторая стадия (ступень) гидролиза
- Среда и pH раствора сульфата бериллия
- Напишите в молекулярной и ионной формах уравнения реакций совместного гидролиза предложенных солей. BeSO4 + K2S
- Как правильно написать в молекулярной и в ионно-молекулярной форме уравнения гидролиза солей
- 💡 Видео
Видео:Гидролиз солей. Классификация солей. Решение примеров.Скачать

Первая стадия (ступень) гидролиза
Полное ионное уравнение
2Be 2+ + 2SO4 2- + 2HOH ⇄ 2BeOH + + SO4 2- + 2H + + SO4 2-
Сокращенное (краткое) ионное уравнение
Be 2+ + HOH ⇄ BeOH + + H +
Видео:ГИДРОЛИЗ СОЛЕЙ | 9 класс | Кратко и понятноСкачать

Вторая стадия (ступень) гидролиза
Полное ионное уравнение
2BeOH + + SO4 2- + 2HOH ⇄ 2Be(OH)2 + 2H + + SO4 2-
Сокращенное (краткое) ионное уравнение
BeOH + + HOH ⇄ Be(OH)2 + H +
Видео:Гидролиз солей. 9 класс.Скачать

Среда и pH раствора сульфата бериллия
В результате гидролиза образовались ионы водорода (H + ), поэтому раствор имеет кислую среду (pH
Видео:Гидролиз солей. 1 часть. 11 класс.Скачать

Напишите в молекулярной и ионной формах уравнения реакций совместного гидролиза предложенных солей. BeSO4 + K2S
| 🎓 Заказ №: 22220 |
| ⟾ Тип работы: Задача |
| 📕 Предмет: Химия |
| ✅ Статус: Выполнен (Проверен преподавателем) |
| 🔥 Цена: 153 руб. |
👉 Как получить работу? Ответ: Напишите мне в whatsapp и я вышлю вам форму оплаты, после оплаты вышлю решение.
➕ Как снизить цену? Ответ: Соберите как можно больше задач, чем больше тем дешевле, например от 10 задач цена снижается до 50 руб.
➕ Вы можете помочь с разными работами? Ответ: Да! Если вы не нашли готовую работу, я смогу вам помочь в срок 1-3 дня, присылайте работы в whatsapp и я их изучу и помогу вам.
⚡ Условие + 37% решения:
Напишите в молекулярной и ионной формах уравнения реакций совместного гидролиза предложенных солей. BeSO4 + K2S
Решение: Соль сульфат бериллия BeSO4 образована слабым основанием и сильной кислотой. Протекает гидролиз по катиону. Соль сульфид калия K2S образована сильным основанием и слабой кислотой. Протекает гидролиз по аниону. В обычных условиях гидролиз каждой из этих солей ограничивается первой ступенью. При смешении растворов этих солей ионы H + и OH взаимодействуют между собой, образуя молекулы слабого электролита H2O , который уходит из сферы реакции. Это приводит к тому, что гидролиз каждой из солей проходит до конца. Уравнение реакции совместного гидролиза в молекулярной форме BeSO4 K2 S 2H2O K2 SO4 Be(OH) 2 H2 S
Научись сам решать задачи изучив химию на этой странице:
|
Услуги:
|
Готовые задачи по химии которые сегодня купили:




















































Образовательный сайт для студентов и школьников
Копирование материалов сайта возможно только с указанием активной ссылки «www.lfirmal.com» в качестве источника.
© Фирмаль Людмила Анатольевна — официальный сайт преподавателя математического факультета Дальневосточного государственного физико-технического института
Видео:Гидролиз солей.ПримерыСкачать

Как правильно написать в молекулярной и в ионно-молекулярной форме уравнения гидролиза солей
Задача 949.
Написать в молекулярной и в ионно-молекулярной форме уравнения гидролиза Na2СО3, КНСО3, (NH4)2СO3. Указать реакцию среды.
Решение:
а) Na2CO3 – соль сильного основания и слабой кислоты, гидролизуется по аниону:
При гидролизе соли образуется избыток ионов ОН – , которые придают раствору щелочную среду, рН > 7.
б) КНСО3 – кислая соль сильного основания и слабой кислотой гидролизуется по аниону:
При гидролизе соли образуется избыток ионов OH – , которые придают раствору щелочную среду, рН > 7.
в) (NH4)2СO3 – соль слабого основания и слабой кислоты, гидролизуется как по катиону, так и по аниону:
Гидролиз по аниону в основном протекает по 1-ой ступени. При гидролизе соли образуется дополнительное количество ионов Н + и ОН-, которые связываясь образуют молекулы Н2О ↔ Н + + ОН – ↔ Н2О. Раствор приобретает нейтральную среду, рН = 7. Но так как КDII(H2CO3) 4,7 . 10 -11 1.8 . 10 -5 , то преимущественно будет протекать гидролиз соли по аниону и в растворе будет наблюдаться некоторый избыток ионов ОН-, что придаёт ему слабощелочную среду, рН > 7.
Задача 950.
Вычислить рН 0,01 М раствора карбоната калия.
Решение:
К2СО3 – соль сильного основания и слабой кислоты гидролизуется по аниону:
Ответ: рН = 11,16.
Задача 951.
Для получения соды раствор NаОН разделили на две равные порции, одну из них насытили СО2, после чего смешали с другой порцией. Какое вещество образовалось после насыщения первой порции? Какая реакция произошла при смешении первой порции со второй? Написать уравнения реакций.
Решение:
При насыщении раствора едкого натра углекислым газом образуется гидрокарбонат натрия:
При смешивании растворов NaOH и NaHCO3 произойдёт реакция в результате которой образуется Na2CO3:
💡 Видео
Ступенчатый гидролиз солей по аниону. Решаем примеры.Скачать

Химия 9 класс (Урок№8 - Гидролиз солей.)Скачать

Гидролиз солей. Теория для задания 23 ЕГЭ по химии.Скачать

11 класс. Гидролиз солей.Скачать

Константа гидролиза и pH водного раствора солиСкачать

Гидролиз солейСкачать

Гидролиз солей. 2 часть. 11 класс.Скачать

Химия 8 класс: Гидролиз солейСкачать

Электролитическая диссоциация кислот, оснований и солей. 9 класс.Скачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Гидролиз бинарных соединений. 11 класс.Скачать
Гидролиз солей. 10 класс.Скачать

Гидролиз солей. Практическая часть. 10 класс.Скачать

Степень гидролиза и как её рассчитатьСкачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать