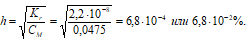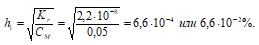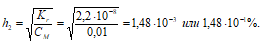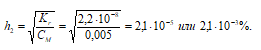Na2CO3 — соль образованная сильным основанием и слабой кислотой, поэтому реакция гидролиза протекает по аниону.
- Первая стадия (ступень) гидролиза
- Вторая стадия (ступень) гидролиза
- Среда и pH раствора карбоната натрия
- Карбонат натрия и его гидролиз
- Общие характеристики соды
- Физические и химические свойства карбоната натрия
- Расчет константы гидролиза, степени гидролиза и рН растворов карбоната натрия
- 1. Определение молярности раствора соли Nа2СО3
- 2. Расчет константы гидролиза соли
- 3. Определение степени гидролиза соли
- 4. Расчет рН раствора соли образованной сильным основанием и слабой кислотой
- а) Вычисление рН и степени гидролиза соли Nа2СО3 до разбавления ее водой
- 1. Расчет константы гидролиза соли
- 2. Определение степени гидролиза соли до разбавления ее водой
- 3. Расчет рН1 раствора соли Nа2СО3 до разбавления
- б) Вычисление рН и степени гидролиза соли Nа2СО3 после разбавления ее водой
- 1. Определение степени гидролиза соли после разбавления ее водой
- 2. Расчет рН2 раствора соли Nа2СО3 после разбавления ее водой
- а) Вычисление рН и степени гидролиза соли Nа2СО3 до разбавления ее водой
- 1. Расчет константы гидролиза соли
- 2. Определение степени гидролиза соли до разбавления ее водой
- 3. Расчет рН1 раствора соли Nа2СО3 до разбавления
- б) Вычисление рН и степени гидролиза соли Nа2СО3 после разбавления ее водой
- 1. Определение степени гидролиза соли после разбавления ее водой
- Please wait.
- We are checking your browser. gomolog.ru
- Why do I have to complete a CAPTCHA?
- What can I do to prevent this in the future?
- 🎬 Видео
Видео:Химия | Молекулярные и ионные уравненияСкачать

Первая стадия (ступень) гидролиза
Молекулярное уравнение
Na2CO3 + HOH ⇄ NaHCO3 + NaOH
Полное ионное уравнение
2Na + + CO3 2- + HOH ⇄ Na + + HCO3 — + Na + + OH —
Сокращенное (краткое) ионное уравнение
CO3 2- + HOH ⇄ HCO3 — + OH —
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Вторая стадия (ступень) гидролиза
Молекулярное уравнение
NaHCO3 + HOH ⇄ H2CO3 + NaOH
Полное ионное уравнение
Na + + HCO3 — + HOH ⇄ H2CO3 + Na + + OH —
Сокращенное (краткое) ионное уравнение
HCO3 — + HOH ⇄ H2CO3 + OH —
Видео:Гидролиз карбоната натрия | ЕГЭ по химииСкачать

Среда и pH раствора карбоната натрия
В результате гидролиза образовались гидроксид-ионы (OH — ), поэтому раствор имеет щелочную среду (pH > 7).
Видео:Ионные уравнения реакций. Как составлять полные и сокращенные уравненияСкачать

Карбонат натрия и его гидролиз
Характеристики вещества и уравнение реакции его гидролиза
Карбонат натрия (Na₂CO₃) — это всем известная кальцинированная сода. Название «сода» произошло от растения Salsola Soda, из золы которого ее добывали. Кальцинированной соду назвали, так как для получения вещества приходилось кальцинировать кристаллогидрат (нагревать до высокой температуры).
Видео:как составить к сокращенному ионному уравнению молекулярноеСкачать

Общие характеристики соды
По своей природе сода — это соль угольной кислоты. При гидролизе соединения, образованного слабой кислотой и сильной щелочью, будет щелочная реакция среды.
Внешне сода — это мелкодисперсный порошок белого цвета с высокой растворимостью в воде и очень слабой — в органических растворителях (например, в спирте).
Видео:Гидролиз карбоната натрияСкачать

Физические и химические свойства карбоната натрия
Карбонат натрия в безводном состоянии — это бесцветный кристаллический порошок. Если опустить карбонат натрия в сильную кислоту, получившаяся в ходе реакции угольная кислота будет крайне нестойкой и распадется на воду и газообразный оксид четырехвалентного углерода. Второй продукт реакции — натриевая соль соответствующей кислоты (например, при бросании кристаллов карбоната натрия в серную кислоту образуются углекислый газ, вода и сульфат натрия).
Здесь вы узнаете о свойствах натрия и его соединений
В воде карбонат натрия будет гидролизоваться, из-за чего нейтральная среда станет щелочной.
Уравнение гидролиза (в ионной форме):
CO₃²⁻ + H₂O ↔ HCO₃⁻ + OH− гидролиз карбоната натрия Na₂CO₃
Уравнение гидролиза карбоната натрия в две ступени:
Na₂CO₃ + HOH ↔ NaOH + NaHCO₃
2Na⁺ + CO₃²⁻ + HOH ↔ Na⁺ + OH⁻ + Na⁺ + HCO₃⁻
CO₃²⁻ + HOH ↔ OH⁻ + HCO₃⁻
Na⁺HCO₃⁻ + HOH ↔ NaOH + H₂CO₃
Na⁺ + HCO₃⁻ + HOH ↔ Na⁺ + OH⁻ + H₂CO₃
Сокращается натрий и остается:
HCO₃⁻ + HOH ↔ OH⁻ + H₂CO₃, в свою очередь H₂CO₃ разлагается на СО₂ и Н₂О
Степень гидролиза зависит от природы соли, ее концентрации и температуры. Согласно закону действующих масс, степень гидролиза возрастает с разбавлением раствора. Если кислота и основание, образующие соль — слабые электролиты, которые при этом малорастворимы или неустойчивы и разлагаются с образованием летучих продуктов, то гидролиз соли часто протекает необратимо, то есть сопровождается полным разложением соли.
Видео:Гидролиз солей. 9 класс.Скачать

Расчет константы гидролиза, степени гидролиза и рН растворов карбоната натрия
Задача 98.
В 500 см 3 раствора содержится Nа2СО3 массой 2,52 г. Определить рН и степень гидролиза соли.
Решение:
V(Nа2СО3) = 500 см 3 ;
m(Nа2СО3) = 2,52 г;
KD1(Н2СО3) = 4,50 · 10 –7 ;
М(Nа2СО3) = 106,00 г/моль;
pH = ?
h = ?
1. Определение молярности раствора соли Nа2СО3
2. Расчет константы гидролиза соли
Nа2СО3 — соль сильного основания и слабой двухосновной кислоты, поэтому гидролиз, в основном, проходит в одну ступень (1-я ступень) по аниону:
Константа гидролиза карбоната натрия определяется константой диссоциации по первой ступени образовавшейся кислоты Н2СО3 и определяется по формуле:
3. Определение степени гидролиза соли
Степень гидролиза определяется по формуле:
4. Расчет рН раствора соли образованной сильным основанием и слабой кислотой
Так как гидролиз соли Nа2СО3 протекает с выделением ОН- — ионов, то рассчитаем [OH-]:
[OH¯] = h · CM = (6,8 · 10 –4 )·(0,0475) = 3,2 · 10 –5 моль/дм 3 ;
рОН = -lg[OH – ] = -lg3,2 · 10 –5 = 5 — 0,50 = 4,50;
pH = 14 — pOH = 14 — 4,50 = 9,50.
Ответ: рН = 9,50; h = 6,8 · 10 –2 %.
Задача 99.
Вычислите рН и степень гидролиза соли в 0,05 М растворе Nа2СО3. Чему будет равен рН, если раствор разбавить водой в 5 раз?
Решение:
KD(Н2О) = 1,00 · 10 –14
KD1(Н2СО3) = 4,50 · 10 –7 ;
СМ1(Nа2СО3) = 0,05 М;
pH1 = ?
h1 = ?
pH2 = ?
h2 = ?
Видео:Опыты по химии. Гидролиз гидрокарбоната натрия, карбоната натрия и силиката натрияСкачать

а) Вычисление рН и степени гидролиза соли Nа2СО3 до разбавления ее водой
1. Расчет константы гидролиза соли
Nа2СО3 — соль сильного основания и слабой двухосновной кислоты, поэтому гидролиз, в основном, проходит в одну ступень (1-я ступень) по аниону:
СО32– + H2O = НСО3– + OH–
Константа гидролиза определяется константой диссоциации по первой ступени образовавшейся кислоты Н2СО3 и определяется по формуле:
2. Определение степени гидролиза соли до разбавления ее водой
Степень гидролиза определяется по формуле:
3. Расчет рН1 раствора соли Nа2СО3 до разбавления
Так как гидролиз соли Nа2СО3 протекает с выделением ОН – — ионов, то рассчитаем [OH – ]:
[OH – ]1 = h · CM = (6,6 · 10 –4 )·(0,05) = 3,32 · 10 –5 моль/дм 3 ;
рОН1 = -lg[OH – ]1 = -lg3,32 · 10 –5 = 5 — 0,52 = 4,48;
pH1 = 14 — pOH = 14 — 4,50 = 9,50.
Видео:Определение карбонат- и гидрокарбонат-ионов. Видео 2.Скачать

б) Вычисление рН и степени гидролиза соли Nа2СО3 после разбавления ее водой
Так как раствор соли разбавили водой в 5 раз, то и молярность раствора уменьшилась тоже в 5 раз
1. Определение степени гидролиза соли после разбавления ее водой
2. Расчет рН2 раствора соли Nа2СО3 после разбавления ее водой
Так как гидролиз соли Nа2СО3 протекает с выделением ОН – — ионов, то рассчитаем [OH – ]:
[OH – ]2 = h · CM = (1,48 · 10 –3 )·(0,01) = 1,48 · 10 –5 моль/дм 3 ;
рОН2 = -lg[OH – ]2 = -lg1,48 · 10 –5 = 5 — 0,17 = 4,83;
pH2 = 14 — pOH = 14 — 4,83 = 9,17.
Задача 100.
Вычислите рН и степень гидролиза соли в 0,05 М растворе Nа2СО3. Чему будет равен рН, если раствор разбавить водой в 10 раз?
Решение:
KD(Н2О) = 1,00 · 10 –14 ;
KD1(Н2СО3) = 4,50 · 10 –7 ;
СМ1(Nа2СО3) = 0,05 М;
pH1 = ?
h1 = ?
pH2 = ?
h2 = ?
Видео:Гидролиз солей. 1 часть. 11 класс.Скачать

а) Вычисление рН и степени гидролиза соли Nа2СО3 до разбавления ее водой
1. Расчет константы гидролиза соли
Nа2СО3 — соль сильного основания и слабой двухосновной кислоты, поэтому гидролиз, в основном, проходит в одну ступень (1-я ступень) по аниону:
Константа гидролиза определяется константой диссоциации по первой ступени образовавшейся кислоты Н2СО3 и определяется по формуле:
2. Определение степени гидролиза соли до разбавления ее водой
Степень гидролиза определяется по формуле:
3. Расчет рН1 раствора соли Nа2СО3 до разбавления
Так как гидролиз соли Nа2СО3 протекает с выделением ОН – — ионов, то рассчитаем [OH – ]:
[OH – ]1 = h · CM = (6,6 · 10 –4 )·(0,05) = 3,3 · 10 –5 моль/дм 3 ;
рОН1 = -lg[OH – ]1 = -lg3,3 · 10 –5 = 5 — 0,52 = 4,48;
pH1 = 14 — pOH = 14 — 4,48 = 9,52.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

б) Вычисление рН и степени гидролиза соли Nа2СО3 после разбавления ее водой
Так как раствор соли разбавили водой в 10 раз, то и молярность раствора уменьшилась тоже в 10 раз
1. Определение степени гидролиза соли после разбавления ее водой
2. Расчет рН2 раствора соли Nа2СО3 после разбавления ее водой
Так как гидролиз соли Nа2СО3 протекает с выделением ОН – — ионов, то рассчитаем [OH – ]:
[OH – ]2 = h · CM = (2,1 · 10 –5 )·(0,005) = 1,05 · 10 –7 моль/дм 3 ;
рОН2 = -lg[OH – ]2 = -lg1,05 · 10 –7 = 7 — 0,02 = 6,98;
pH2 = 14 — pOH = 14 — 6,98 = 7,02.
Видео:Гидролиз солей. Классификация солей. Решение примеров.Скачать

Please wait.
Видео:Взаимодействие растворов хлорида алюминия и карбоната натрия (совместный гидролиз)Скачать

We are checking your browser. gomolog.ru
Видео:Химия 11 класс (Урок№7 - Гидролиз органических и неорганических соединений.)Скачать

Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
Видео:Реакции ионного обмена. 9 класс.Скачать

What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 7076413e3f8c9702 • Your IP : 85.95.179.80 • Performance & security by Cloudflare
🎬 Видео
ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Химия 9 класс (Урок№8 - Гидролиз солей.)Скачать

Лабораторная работа №3 Гидролиз. Кислотно-основные взаимодействия в растворахСкачать

Опыт: совместный гидролиз солейСкачать

Гидролиз водных растворов сульфата алюминия и карбоната натрияСкачать