8.2 ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ
Причиной электрохимической коррозии * является возникновение на поверхности металла короткозамкнутых гальванических элементов *.
В тонком слое влаги, обычно покрывающем металл, растворяются кислород, углекислый, сернистый и другие газы, присутствующие в атмосферном воздухе. Это создает условия соприкосновения металла с электролитом *. Различные участки поверхности любого металла обладают разными потенциалами. Причинами этого могут быть наличие примесей в металле, различная обработка отдельных его участков, неодинаковые условия (окружающая среда), в которых находятся различные участки поверхности металла. При этом участки поверхности металла с более электроотрицательным потенциалом становятся анодами и растворяются.
Электрохимическая коррозия может развиваться в результате контакта различных металлов. В этом случае будет возникать не микр о- , а макрогальванопара , и коррозия называется контактной (см. детальную классификацию видов коррозии). Сочетания металлов, сильно отличающихся значениями электродных потенциалов *, в технике недопустимы (например, алюминий – медь). В случае коррозии, возникающей при контакте какого-либо металла со сплавом, последний имеет потенциал, соответствующий наиболее активному металлу, входящему в состав сплава. Например, при контакте латуни (сплав цинка и меди) с железом корродировать будет латунь за счет наличия в ней цинка.
Представим схематично работу короткозамкнутого гальванического элемента, возникающего на поверхности металла, подверженного коррозии в электролите * (рисунок 8.1). Анодный участок имеет более электроотрицательный потенциал, поэтому на нем идет процесс окисления металла. Образовавшиеся в процессе окислен ия ио ны переходят в электролит, а часть освободившихся при этом электронов может перемещаться к катодному участку (на рисунке 8.1 показано стрелками). Процесс коррозии будет продолжаться в том случае, если электроны, перешедшие на катодный участок, будут с него удаляться. Иначе произойдет поляризация электродов *, и работа коррозионного гальванического элемента прекратится.
Рисунок 8.1 – Схема электрохимической коррозии. Д – деполяризатор
Процесс отвода электронов с катодных участков называется деполяризацией. Вещества, при участии которых осуществляется деполяризация, называются деполяризаторами. На практике чаще всего приходится встречаться с двумя типами деполяризации: водородной и кислородной. Тип деполяризации (катодный процесс) зависит от реакции среды раствора электролита.
В кислой среде электрохимическая коррозия протекает с водородной деполяризацией. Рассмотрим коррозию железной пластинки с примесями меди во влажной хлористоводородной атмосфере Имеется в виду атмосфера с примесью газообразного HCl. . В этом случае железо будет анодом ( E ° = –0,44В), а медь – катодом ( E ° =+0,34В). На анодном участке будет происходить процесс окисления железа, а на катодном – процесс деполяризац ии ио нами водорода, которые присутствуют в электролите:
А: Fe – 2e → Fe 2+ – окисление
К: 2 H + + 2e → H2 ↑ – восстановление
Схема возникающего короткозамкнутого гальванического элемента выглядит следующим образом:
A (–) Fe | HCl | Cu (+) К
В нейтральной среде коррозия протекает с кислородной деполяризацией, т.е. роль деполяризатора выполняет кислород, растворенный в воде. Этот вид коррозии наиболее широко распространен в природе: он наблюдается при коррозии металлов в воде, почве и в незагрязненной промышленными газами атмосфере. Если коррозии во влажном воздухе подвергается железо с примесями меди, то электродные процессы можно записать в виде:
(А) Fe – 2e → Fe 2+ – окисление
(К) 2 H2O + O2 + 4e → 4 OH – – восстановление
У поверхности металла в электролите протекают следующие реакции:
Fe 2+ + 2 OH – → Fe( OH)2
Основная масса черных металлов разрушается вследствие процесса ржавления, в основе которого лежат вышеуказанные реакции.
Коррозия металла в результате неравномерного доступа кислорода . Случаи электрохимической коррозии, возникающей вследствие неравномерной аэрации кислородом различных участков металла, очень часто встречаются в промышленности и в подземных сооружениях. Примером может служить коррозия стальной сваи, закопанной в речное дно (рис 8.2).
Рисунок 8.2 – Коррозия в результате неравномерного доступа кислорода. Б – техническое сооружение; А – анодный участок; К – катодный участок.
Часть конструкции, находящаяся в воде, омывается растворенным в ней кислородом и, в случае возникновения условий для электрохимической коррозии, будет выполнять роль катода. Другая же часть конструкции, находящаяся в почве, будет анодом и подвергнется разрушению.
Видео:Электрохимическая коррозия (алюминий — медь)Скачать

Электрохимическая коррозия металлов
Задача 2.5: В производственной конструкции имеются детали из разных металлов (см. табл. 6). В контакте с какими металлами основной металл конструкции корродирует интенсивнее? Составьте уравнения электродных процессов, протекающих при работе коррозионных микрогальванических пар, и суммарные уравнения коррозионных процессов с учетом характера среды.
Таблица 6 – Варианты заданий
| Основной металл конструкции | Металлы, контактирующие с основным | Среда | |
| a | Железо | Zn или Cu | Раствор HCl |
| b | Цинк | Al или Sn | Раствор NaCl |
| c | Медь | Mg или Cr | Раствор H2SO4 |
| d | Железо | Cu или Ag | Морская вода |
| e | Олово | Pb или Mn | Раствор CH3COOH |
| f | Цинк | Al или Cu | Воздушная (O2 + 2H2O) |
| g | Железо | Mg или Ni | Морская вода |
| h | Никель | Cu или Zn | Раствор H2SO4 |
| i | Свинец | Ag или Cu | Раствор CH3COOH |
| j | Железо | Cr или Zn | Воздушная (O2 + 2H2O) |
| k | Медь | Fe или Ni | Раствор HCl |
| l | Железо | Mg или Pb | Раствор NaCl |
| m | Алюминий | Zn или Fe | Воздушная (O2 + 2H2O) |
| n | Железо | Al или Pb | Водная |
| o | Железо | Zn или Cu | Раствор NaOH |
Для решения данной задачи воспользуйтесь рядом СЭП.
Пример решения задачи:
В конструкции из железа имеются медные детали. Какие коррозионные процессы протекают в атмосферных условиях (О2, Н2О) и в водной среде (кислой, нейтральной)?
При контакте разных металлов Fe/Cu возникает разность электродных потенциалов; в присутствии окислителя и электролита начинается процесс электрохимической коррозии.
В коррозионной гальванической паре железо (φ 0 = -0.44 В) является анодом, оно окисляется, а медь (φ 0 = +0.34 В) является катодом; на меди происходит восстановление окислителя, содержащегося в окружающей среде. Окислитель при этом часто называют деполяризатором. Записываем схемы коррозионных гальванических элементов и электродные процессы.
1) В атмосферных условиях (рН ³ 7):
A (-): Fe/ O2, H2O /Cu :(+) K
Анод: Fe – 2e = Fe 2+ (окисление)
Катод: O2 + 2H2O + 4e = 4OH — (восстановление)
Окислению всегда подвергается более активный металл. На поверхности меди – менее активного металла происходит кислородная деполяризация, т.е. восстановление кислорода в присутствии воды с образованием ОН — -групп.
Молекулярное уравнение коррозии:
В местах контакта железных и медных деталей образуется Fe(OH)2, последний окисляется кислородом воздуха до Fe(OH)3.
На воздухе Fe(OH)3 может частично или полностью дегидратироваться с образованием FeOOH и затем Fe2O3.
2) В водном растворе кислоты (рН 2+ (окисление)
Катод: 2H + + 2e = H2 (восстановление)
На поверхности меди (катоде) происходит восстановление ионов водорода, то есть водородная деполяризация.
Молекулярное уравнение коррозии
Продуктом коррозии является растворимая соль FeSO4.
3) В водном нейтральном растворе (рН = 7), не содержащем растворенного кислорода, на катоде (меди) восстанавливаются молекулы воды
Видео:Электрохимическая коррозия в кислой средеСкачать

Электрохимическая коррозия металлов
Коррозией металлов называют самопроизвольное разрушение металлов под действием различных окислителей из окружающей среды.
В реальных условиях коррозии обычно подвергаются технические металлы, содержащие примеси других металлов и неметаллических веществ.
Механизм электрохимической коррозии в таких металлах аналогичен механизму процессов, протекающих в короткозамкнутых гальванических элементах, в которых на участках с более отрицательным потенциалом идет процесс окисления (разрушение металлов), а на участках с более положительным потенциалом процесс восстановления окислителя (коррозионной среды).
Наиболее часто встречаются окислители (деполяризаторы):
· ионы водорода (коррозия с водородной деполяризацией)
2Н + + 2 ē = Н 2 (в кислой среде),
2Н2О + 2 ē = Н2 + 2ОН — (в нейтральной и щелочной средах);
O2 + 4 ē + 4Н + = 2Н2О (в кислой среде);
О2 +4 ē + 2Н2О = 4ОН — (в щелочной и нейтральной средах).
Методика рассмотрения работы гальванопары при электрохимической коррозии.
· Составляют схему гальванопары:
· Выписывают стандартные потенциалы металлов и окислителей коррозионной среды (табл.П.7), определяют восстановитель (меньший потенциал), окислитель (больший потенциал).
· Записывают уравнения процессов окисления и восстановления и суммарное уравнение окислительно-восстановительной реакции, протекающей при гальванокоррозии.
· Указывают направление движения электронов.
Пример 1.Гальванопара алюминий —железо в воде (среда нейтральная). В воде растворен кислород.
· Схема гальванопары Al / H2O, O2 / Fe
· Потенциалы 


Восстановитель – Al, окислитель — О2.


· Направление движения электронов от участка с меньшим потенциалом к участку с большим потенциалом:


Пример 2. Определить процессы, протекающие при коррозии луженого железа (среда – влажный воздух, содержащий кислород, пары воды и ионы Н + ), если нарушена сплошность покрытия.
· Потенциалы: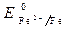


Восстановитель – железо, окислитель – кислород.


2Fe + О2 + 4Н + = 2Fe 2+ + 2Н2О
При нарушении целостности покрытия будет разрушаться Fe.
· Электроны движутся от участка с меньшим потенциалом к участку с большим потенциалом:


Пример 3. Рассмотреть коррозию детали из железа и алюминия в щелочной среде (КОН), если растворенный кислород отсутствует.
· Схема гальванопары: Al / КОН/ Fe
· Потенциалы: 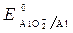


· 
Fe(+): 3 2 H2O + 2 ē = 2 OH — + H2 – процесс восстановления
2 Al + 2 OH — + 2H2O = 2 AlO2 — + 3 H2
· Направление перемещения электронов в системе:


Задание к подразделу 4.4
Рассмотрите коррозию гальванопары, используя потенциалы (табл. П.7), укажите анод и катод соответствующей гальванопары в различной коррозионной среде, рассчитайте ЭДС, напишите уравнения анодного и катодного процессов, молекулярное уравнение реакции коррозии, укажите направление перемещения электронов в системе.
| Номер задания | Коррозионная среда | ||
| а) H2O + O2 | б) NaOH + H2O | в) H2O + Н + | |
| 321. | Fe / Zn | Zn / Al | Pb / Zn |
| 322. | Fe / Ni | Fe / Zn | Al / Cu |
| 323. | Pb / Fe | Cd / Cr | Al / Ni |
| 324. | Cu / Zn | Al / Cu | Sn / Cu |
| 325. | Zn / Fe | Fe / Cr | Co / Al |
| 326. | Zn / Al | Pb / Zn | Cr / Ni |
| 327. | Cr / Cu | Pb / Cr | Bi / Ni |
| 328. | Cu / Al | Cr / Zn | Fe / Mg |
| 329. | Zn / Sn | Mg / Cd | Cr / Bi |
| 330. | Co / Mg | Zn / Fe | Pb / Al |
| 331. | Pb / Zn | Bi / Ni | Cd / Al |
| 332. | Bi / Ni | Cu / Zn | Fe / Ni |
| 333. | Fe / Mg | Fe / Cu | Co / Cd |
| 334. | Sn / Fe | Pb / Zn | Cr / Fe |
| 335. | Cr / Fe | Fe / Mg | Co / Cu |
| 336. | Fe / Cr | Cr / Cu | Cr / Cu |
| 337. | Fe / Cu | Cd/ Zn | Cd/ Zn |
| 338. | Zn / Cu | Cr / Ni | Cr / Cd |
| 339. | Mg / Cu | Cr / Cd | Zn / Al |
| 340. | Sn / Cu | Bi / Ni | Bi / Ni |
Электролиз растворов
Электролиз – это совокупность окислительно-восстановительных процессов, происходящих при прохождении электрического тока через электрохимическую систему, состоящую из двух электродов и электролита.
Электрод, на котором происходит восстановление, называется катодом, он заряжен отрицательно. Электрод, на котором происходит окисление, называется анодом, он заряжен положительно.
При электролизе водных растворов могут протекать процессы, связанные с электролизом воды, т.е. растворителя.
Катодные процессы
На катоде возможно восстановление:
· катионов металла Ме n+ + nē = Me;
· катиона водорода (свободного или в составе молекул воды):
2H + + 2ē = H 2 ( в кислой среде) ;
2H2O + 2 ē =H 2+ 2 OH — ( в нейтральной и щелочной средах).
Для выбора приоритетного процесса следует сравнить стандартные электродные потенциалы металла и водорода (табл. П.6, П.7). Потенциал восстановления катионов водорода необходимо использовать с учетом перенапряжения, 
1. Активные металлы (Li — Al) из-за низкой окислительной способности их ионов на катоде не осаждаются, вместо них идет восстановление ионов водорода.
2. Металлы средней активности (Mn, Zn, Fe, Sn) могут осаждаться на катоде с одновременным выделением водорода.
3. Малоактивные металлы (стоящие в ряду напряжений после водорода) из-за высокой окислительной способности их ионов осаждаются на катоде без выделения водорода.
Анодные процессы
На аноде возможны процессы окисления:
· материала анода Ме — nē = Me n +
Анионы кислородосодержащих кислот, имеющие в своем составе атом
элемента в высшей степени окисления (SO4 2 — , NO3 — и др.), при электролизе водных растворов на аноде не разряжаются.
С учетом перенапряжения величину потенциала выделения кислорода нужно считать равной 1,8 В.
Пример 1. Электролиз водного раствора сульфата калия с инертными электродами:


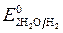
Так как


происходит восстановление воды: 2H2O — 4ē = O2 + 4 H +
среда щелочная среда кислая
Пример 2. Электролиз водного раствора хлорида олова с инертными электродами:
SnCl 2 = Sn 2+ + 2Cl —





Так как


ионов олова: Sn 2+ + 2 ē = S n 2Cl — — 2 ē = Cl 2
Пример 3. Электролиз сульфата меди с медным анодом:

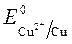



Так как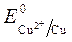

происходит восстановление Так как 
ионов меди:Cu 2+ +2ē = Cu анод растворяется: Cu — 2ē = Cu 2+
Количественные соотношения при электролизе определяют в соответствии с законами, открытыми М. Фарадеем (1834).
Обобщенный закон Фарадея связывает количество вещества, образовавшегося при электролизе, со временем электролиза и силой тока:

где m — масса образовавшегося вещества , г;
М — молярная масса вещества, г/ моль;
n — количество электронов, участвующих в электродном процессе;
t — время электролиза, с;
F — константа Фарадея (96500 Кл/моль).
Для газообразных веществ, выделяющихся при электролизе, формулу использют в виде 
где V— объем газа, выделяющегося на электроде; V 0 — объем 1 моль газообразного вещества при нормальных условиях (22,4 л/моль).
Пример 4. Рассчитать массу олова и объем хлора при нормальных условиях, выделившихся при электролизе раствора хлорида олова с инертными электродами в течение 1 часа при силе тока 4А.
Решение.


Задание к подразделу 4.5
Рассмотрите катодные и анодные процессы при электролизе водных растворов веществ. Процессы на электродах обоснуйте значениями потенциалов (табл. П.6,7,8). Составьте схемы электролиза с инертными электродами водных растворов предложенных соединений (отдельно два раствора) с инертными электродами либо растворимым анодом. Рассчитайте массу или объем (при нормальных условиях для газов) продуктов, выделяющихся на электродах при пропускании через раствор в течение 1 часа тока силой 1 А.
Что делать, если нет взаимности? А теперь спустимся с небес на землю. Приземлились? Продолжаем разговор.
Система охраняемых территорий в США Изучение особо охраняемых природных территорий(ООПТ) США представляет особый интерес по многим причинам.
Что делает отдел по эксплуатации и сопровождению ИС? Отвечает за сохранность данных (расписания копирования, копирование и пр.).
Не нашли то, что искали? Воспользуйтесь поиском гугл на сайте:
🔍 Видео
Электрохимическая коррозияСкачать

Коррозия металловСкачать

Гальванические элементы. 1 часть. 10 класс.Скачать

ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Опыт 1. Электрохимическая коррозия в кислой средеСкачать

Коррозия металла. Химия – ПростоСкачать

Коррозия металлов и меры по ее предупреждению. 8 класс.Скачать

Лекция 08 :: Электрохимические системы. Электролиз. Коррозия.Скачать

Электролиз. 10 класс.Скачать

Опыт: электрохимическая коррозияСкачать

Основы электрохимииСкачать

Как писать уравнения электролиза? | Химия ЕГЭ 2022 | УмскулСкачать

Опыты по химии. Электрохимическая коррозия на примере меди и железаСкачать

Лабораторная работа «Металлы. Коррозия металлов»Скачать

8. Коррозия металловСкачать

Коррозия металлов и способы защиты от нееСкачать

§13, 9 кл. Коррозия металловСкачать

Коррозия металла (часть 2). Химия – ПростоСкачать