CuSO4 — соль образованная слабым основанием и сильной кислотой, поэтому реакция гидролиза протекает по катиону.
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Первая стадия (ступень) гидролиза
Полное ионное уравнение
2Cu 2+ + 2SO4 2- + 2HOH ⇄ 2CuOH + + SO4 2- + 2H + + SO4 2-
Сокращенное (краткое) ионное уравнение
Cu 2+ + HOH ⇄ CuOH + + H +
Видео:Ионные уравнения реакций. Как составлять полные и сокращенные уравненияСкачать

Вторая стадия (ступень) гидролиза
Полное ионное уравнение
2CuOH + + SO4 2- + 2HOH ⇄ 2Cu(OH)2 + 2H + + SO4 2-
Сокращенное (краткое) ионное уравнение
CuOH + + HOH ⇄ Cu(OH)2 + H +
Видео:Гидролиз солей. 1 часть. 11 класс.Скачать

Среда и pH раствора сульфата меди (II)
В результате гидролиза образовались ионы водорода (H + ), поэтому раствор имеет кислую среду (pH
Видео:Электролитическая диссоциация кислот, оснований и солей. 9 класс.Скачать

Написать полные и сокращенные ионные уравнения гидролиза cuso4
Алгоритм написания уравнений гидролиза
Гидролиз по катиону
1. Определяем тип гидролиза. Необходимо написать уравнение диссоциации соли.
Гидролиз сульфата меди(II): CuSO4 = Cu 2+ + SO4 2–
Соль образована катионом слабого основания и анионом сильной кислоты. Гидролиз по катиону.
2. Записываем ионное уравнение гидролиза, определяем среду:
Cu 2+ + HOH CuOH + + H + ;
образуется катион гидроксомеди(II) и ион водорода, среда кислая
3. Составляем молекулярное уравнение. Из положительных и отрицательных частиц находящихся в растворе, записываются нейтральные частицы, существующие только на бумаге. В данном случае из CuOH + SO4 2– составляем (CuOH)2SO4. Для уравнивания числа ионов меди необходимо перед сульфатом меди поставить коэффициент два. Получаем:
Продукт реакции относится к группе основных солей: сульфат гидроксомеди(II).
Видео:Гидролиз солей. Классификация солей. Решение примеров.Скачать

Гидролиз
Гидролиз (греч. hydor — вода и lysis — разрушение) — процесс расщепления молекул сложных химических веществ за счет реакции с молекулами воды.
В химии, как и в жизни, разрушается чаще всего нестойкое и слабое (стойкое и сильное выдерживает удар). Запомните, что гидролиз (вода) разрушает «слабое» — это правило вам очень пригодится.
Любая соль состоит из остатка основания и кислоты. Абсолютно любая:
- NaCl — производное основания NaOH и кислоты HCl
- KNO3 — производное основания KOH и кислоты HNO3
- CuSO4 — производное основания Cu(OH)2 и кислоты H2SO4
- Al3PO4 — производное основания Al(OH)3 и кислоты H3PO4
- Ca(NO2)2 — производное основания Ca(OH)2 и кислоты HNO2
Чтобы успешно решать задания по теме гидролиза и писать реакции, вам следует запомнить, какие основания и кислоты являются слабыми, а какие — сильными.
При изучении гидролиза я рекомендую ученикам сохранить на гаджет схему, которую вы видите ниже. Для того, чтобы приобрести нужный опыт — она незаменима. Пользуйтесь ей как можно чаще, подглядывайте в нее и она незаметно окажется в вашем интеллектуальном составляющем 😉
По катиону, по аниону или нет гидролиза?
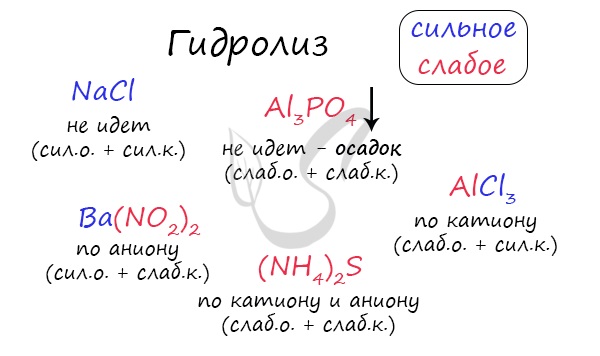
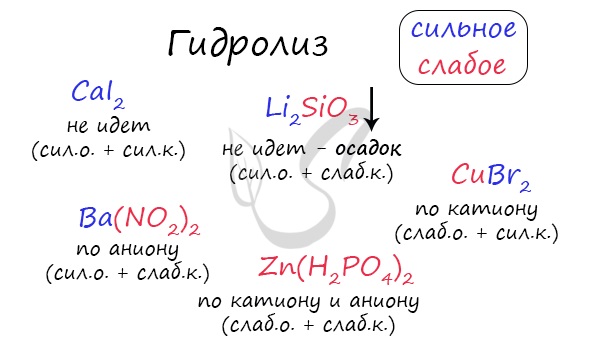
Итак, если в состав соли входит остаток сильного основания и остаток сильной кислоты — гидролиза не происходит. Примеры: NaCl, KBr, CaSO4. Также гидролиза не происходит, если соль нерастворима (вне зависимости от того, чем она образована): AlPO4, FeSO3, CaSO3.
Если в состав соли входит остаток слабого основания и остаток сильной кислоты, то гидролиз идет по катиону. Помните, что гидролиз разрушает слабое, в данном случае — катион. Примеры: AlCl3, MgBr2, Cr2SO4, NH4NO3.
Катион NH4 + и его основание NH4OH , несмотря на растворимость, является слабым, поэтому гидролиз будет идти по катиону в соли NH4Cl. Замечу также, что Ca(OH)2 считается растворимым основанием, поэтому гидролиза соли CaCl2 не происходит.
Если в состав соли входит остаток сильного основания и остаток слабой кислоты, то гидролиз идет по аниону. Примеры: K3PO4, NaNO2, Ca(OCl)2, Ba(CH3COO)2, Li2SiO3.
Если соль образована остатком слабого основания и слабой кислоты, то гидролиз идет и по катиону, и по аниону. Примеры: Mg(NO2)2, Al2S3, Cr2(SO3)3, CH3COONH4.
Среда раствора
Среда раствора может быть нейтральной, кислой или щелочной. Определяется типом гидролиза. Некоторые задания могут быть построены так, что, увидев соль, вы должны будете определить ее тип раствора.
Обрадую вас: если вы усвоили тему гидролиза, сделать это проще простого. В случае, когда гидролиз не идет или идет и по катиону, и по аниону среда раствора — нейтральная.
Если гидролиз идет по катиону (разрушается остаток основания) среда — кислая, если гидролиз идет по аниону (разрушается остаток кислоты), то среда раствора будет щелочная. Изучите примеры.
Однако замечу, что в дигидрофосфатах, гидросульфитах и гидросульфатах среда всегда кислая из-за особенностей диссоциации. Примеры: NH4H2PO4, LiHSO4. В гидрофосфатах среда щелочная из-за того, что константа диссоциации по третьей ступени меньше, чем константа гидролиза. Примеры: K2HPO4, Na2HPO4.
Попробуйте определить среду раствора для соединений из самостоятельного задания, которое вы только что решили. Ниже будет располагаться решение.
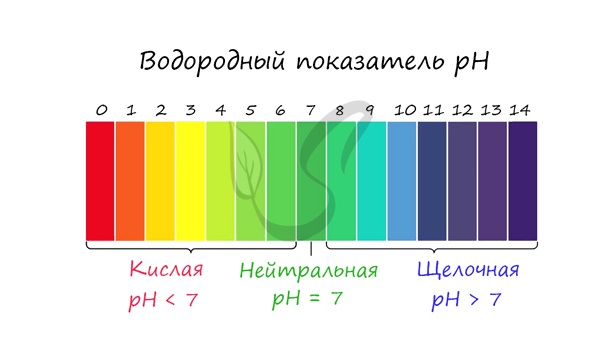
С целью запутать в заданиях часто бывают даны синонимы. Так «среду раствора» могут заменить водородным показателем pH.
Запомните, что кислая среда характеризуется pH 7.
Например, в соли CaCl2 среда раствора будет нейтральной (pH=7), а в растворе AlCl3 — кислой (pH
📸 Видео
Гидролиз солей. 9 класс.Скачать

Гидролиз солей. Теория для задания 23 ЕГЭ по химии.Скачать

ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

ГИДРОЛИЗ СОЛЕЙ | 9 класс | Кратко и понятноСкачать

Ионные уравнения реакций. Составляем полные и сокращенные ионные уравнения. Часть 1.Скачать

Реакции ионного обменаСкачать

Ионные уравнения реакций. По сокращенному ионному уравнению составляем полное ионное и молекулярное.Скачать

Реакции ионного обмена. 9 класс.Скачать

CuSO4 + NaOH Взаимодействие сульфата меди (II) с гидроксидом натрия в водном раствореСкачать

Гидролиз солей.ПримерыСкачать

Совместный гидролиз | Химия ЕГЭ – Екатерина СтрогановаСкачать

ЕГЭ ХИМИЯ 2015 Задание 21 РЕАКЦИИ ИОННОГО ОБМЕНА СОКРАЩЕННАЯ ФОРМА Демо Вариант Видео урок УфаХимикСкачать

Гидролиз солей. 2 часть. 11 класс.Скачать

Все реакции гидролиза в ЕГЭ за 2 часа | Химия ЕГЭ 2022 | УмскулСкачать

ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать