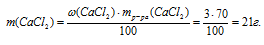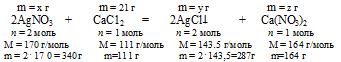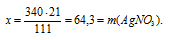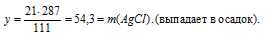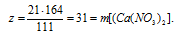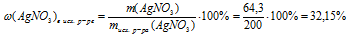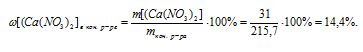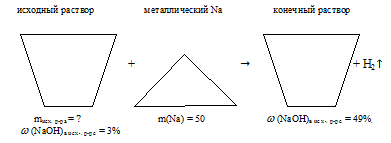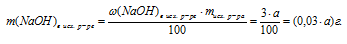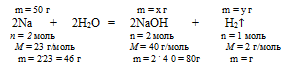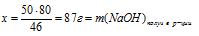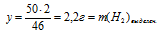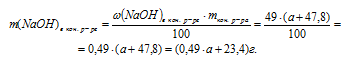данная разработка включает варианты расчетных задач , встречающихся во второй части ЕГЭ по химии, рассматривает типы задач в заданиях 33
- Просмотр содержимого документа «Подготовка к ЕГЭ по химии, расчетные задачи»
- Методическая разработка «Творческий подход в решении заданий №39 (С4) КИМ ЕГЭ по химии» методическая разработка по химии (11 класс) на тему
- Скачать:
- Предварительный просмотр:
- По теме: методические разработки, презентации и конспекты
- Выполнение заданий высокого уровня сложности
- Решения задач, объединяющих в себе растворы и химические реакции
- Определение массовой доли растворенного вешества
- Определение массы растворенного вешества
- 📹 Видео
Просмотр содержимого документа
«Подготовка к ЕГЭ по химии, расчетные задачи»
РЕШЕНИЕ ЗАДАЧ ВЫСОКОГО УРОВНЯ СЛОЖНОСТИ 33 ЗАДАНИЕ ЕГЭ ХИМИЯ
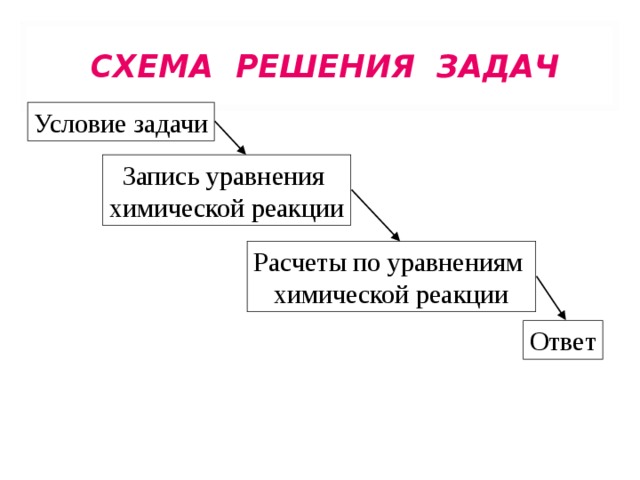
ПОРЯДОК РЕШЕНИЯ ЗАДАЧ
1. Краткая запись условия задачи
2. Запись уравнения химической реакции
3. Запись известных и неизвестных величин над формулами веществ
4. Запись под формулами веществ :
- Молярной массы Объема Количества веществ
- Молярной массы
- Объема
- Количества веществ
5. Решение задачи
(2 части : I) химическая и II) математическая )
ХИМИЧЕСКАЯ ЧАСТЬ ЗАДАЧИ:
1. Чтение текста
2. Запись условия задачи
3. Определение типа задачи
4. Анализ задачи – составление плана решения
1. Выбор способа решения
3. Запись ответа
4. Анализ решения
СХЕМА РЕШЕНИЯ ЗАДАЧ
Расчеты по уравнениям
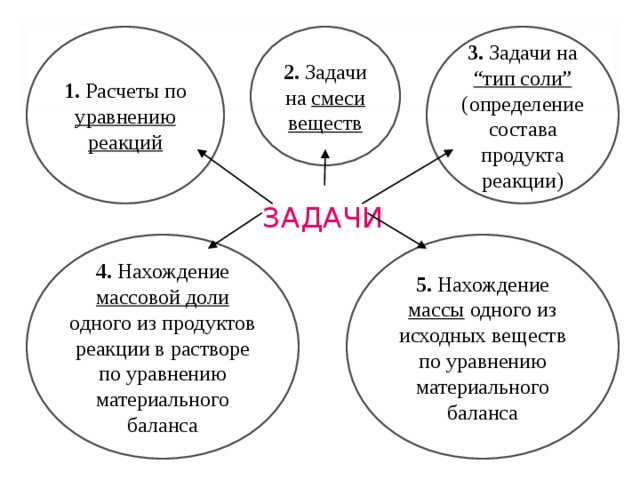
1. Расчеты по уравнению реакций
2. Задачи на смеси веществ
3. Задачи на “ тип соли ” ( определение состава продукта реакции )
5. Нахождение массы одного из исходных веществ по уравнению материального баланса
4. Нахождение массовой доли одного из продуктов реакции в растворе по уравнению материального баланса
Сероводород объемом 5,6л (н.у.) прореагировал без остатка с 59,02мл раствора гидроксида калия с массовой долей 20% ( ρ =1,186г/мл). Определите массу соли, полученной в результате этой химической реакции.
1. Тип 3 «Тип соли».
2. Избыток и недостаток.
3. Определение состава соли.
4. Определение массы продуктов реакции – соли.
Магний массой 4,8г растворили в 200мл 12%-ного раствора серной кислоты ( ρ =1,5г/мл). Вычислите массовую долю сульфата магния в конечном растворе.
1. Тип 4 «Нахождение массовой доли одного из продуктов реакции в растворе по уравнению материального баланса».
2. Избыток и недостаток.
3. Вычисление массовой доли вещества в растворе.
4. Определение массы растворенного вещества.
Карбид алюминия растворили в 380г раствора хлороводородной кислоты с массовой долей 15%. Выделившийся при этом газ занял объем 6.72л (н.у.). Рассчитайте массовую долю хлороводорода в полученном растворе.
1. Тип 5 «Нахождение массы и массовой доли одного из исходных веществ по уравнению материального баланса».
2. Составление уравнений реакций.
3. Составление уравнения для расчета массовой доли исходного вещества
Нитрит калия массой 8,5г внесли при нагревании в 270 г раствора бромида аммония с массовой долей 12%. Какой объем (н.у.) азота выделится при этом и какова массовая доля бромида аммония в получившемся растворе?
1. Тип 5 «Нахождение массы и массовой доли одного из исходных веществ по уравнению материального баланса».
2. Составление уравнения реакции.
3. Нахождение количества вещества, их массы, объема.
4. Составление уравнения для расчета массовой доли исходного вещества.
К раствору гидроксида натрия массой 1200 г прибавили 490г 40%-ного раствора серной кислоты. Для нейтрализации получившегося раствора потребовалось 143г кристаллической соды Na 2 CO 3 *10H 2 O. Рассчитайте массу и массовую долю гидроксида натрия в исходном растворе.
1. Тип 5 «Нахождение массы и массовой доли одного из исходных веществ по уравнению материального баланса».
2. Составление уравнений реакций.
3. Составление уравнения для расчета массовой доли исходного вещества.
Определите массовые доли (в %) сульфата железа и сульфида алюминия в смеси, если при обработке 25г этой смеси водой выделился газ, который полностью прореагировал с 960г 5%-ного раствора сульфата меди.
1. Тип 5 «Нахождение массы и массовой доли одного из исходных веществ по уравнению материального баланса».
2. Составление уравнений реакций.
3. Нахождение количества вещества, их массы.
4. Определение массовой доли исходных веществ смеси.
1. Объясните, почему при нитровании толуола происходит замещение атомов водорода только у 2-го, 4-го и 6-го атомов углерода, но никогда не замещаются атомы водорода у 3-го и 5-го атомов углерода.
2. Составьте схема получения бензола из целлюлозы. Запишите уравнения реакций с указанием условий их протекания.
3. Какое из оснований сильнее – аммиак или диметиламин? Объясните почему. Приведите уравнения реакций, подтверждающих их основные свойства.
Несомненно большую помощь Вам окажут книги:
- Доронькин, В.Н. Химия. 9 класс. Тематические тесты по подготовке к ГИА-9 / В.Н. Доронькин, А.Г. Бережная, Т.В. Сажнева, В.А. Февралева. — Ростов на/Д.: Легион, 2011. — 368 с.
- Корощенко, А.С. ГИА. Химия. Типовые тестовые задания / А.С. Корощенко, Ю.Н. Медведев — М.: Экзамен, 2014. — 96 с.
- Медведев, Ю.Н. ЕГЭ. Химия. Практикум / Ю.Н. Медведев. – М.: Экзамен, 2010. — 125 с.
- Медведев, Ю.Н. ЕГЭ. Типовые тестовые задания / Ю.Н. Медведев. — М.: Экзамен, 2011. — 160 с.
- Задания ГИА-9 (книга)
- Медведев, Ю.Н. Типовые тестовые задания / Ю.Н. Медведев. — М.: Экзамен, 2013. — 112 с.
- Доронькин, В.Н. Химия. Тематические тесты для подготовки к ЕГЭ. Задания высокого уровня сложности (С1 — С5) / В.Н. Доронькин, А.Г. Бережная, Т.В. Сажнева, В.А. Февралёва — Ростов на/Д.: Легион, 2012. — 242 с.
- Доронькина, В.Н. Химия. Тематические тесты. Новые задания ЕГЭ. Химический эксперимент (С2) / В. Н. Доронькина, А.Г. Бережная, Т.В. Сажнева, В.А. Февралёва. — Ростов н/Д.: Легион, 2012. — 92 с.
- Кузьменко Н.Е. Начала химии. Современный курс для поступающих в вузы: Учебное пособие для вузов / Н.Е. Кузьменко, В.В. Еремин, В.А. Попков — М.: Экзамен, 2005 — 832 с.
Видео:8 класс. Массовая доля растворенного вещества. Решение задач.Скачать

Методическая разработка «Творческий подход в решении заданий №39 (С4) КИМ ЕГЭ по химии»
методическая разработка по химии (11 класс) на тему
Данная разработка поможет учителю в работе по подготовке учащихся к решению заданий С4(№39) ЕГЭ по химии.
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Скачать:
| Вложение | Размер |
|---|---|
| metodicheskaya_razrabotka_tvorcheskiy_podhod_v_reshenii_zadaniy_s4no39.docx | 52.45 КБ |
Видео:ХИМИЯ С НУЛЯ — Как решать задачи по Химии на Массовую ДолюСкачать

Предварительный просмотр:
Показатель «Собственные методические разработки»
Муниципальное бюджетное образовательное учреждение
«Средняя общеобразовательная школа № 35»
«Творческий подход в решении заданий С4(№39) КИМ ЕГЭ по химии»
Учитель химии: Жданова Н.В.
Среди большого объёма предлагаемой литературы для подготовки к ЕГЭ, а именно: решение задач повышенного уровня сложности я остановила свой выбор на одной из книг авторского коллектива В.Н. Доронькин, А.Г.Бережная, Т.В. Сажнева, В.А. Февралёва Химия. Тематические тесты для подготовки к ЕГЭ. Задания высокого уровня сложности (С1-С5): учебно-методическое пособие /Под ред. В.Н.Доронькина.-Изд. Ростов н/Д- Легион,2012г.
В данном пособии задачи, включаемые в задание С4(№39) тестов ЕГЭ, условно разделяют на пять групп:
1)Расчёты по уравнениям реакций
2)Задачи на смеси веществ
3)Определение состава продукта реакции (задачи на тип «Соли»)
4)Нахождение массовой доли одного из продуктов реакции в растворе по уравнению материального баланса
5)Нахождение массы одного из исходных веществ по уравнению материального баланса
Для каждой группы приводятся примеры решения задач.
Я хотела бы остановиться на 4 и 5 типах т.к. в них, если быть внимательным, для удобства можно выделить подтипы.
Итак 4 тип «Нахождение массовой доли одного из продуктов реакции в растворе по уравнению материального баланса».
Я предлагаю изменить название 4 типа « Нахождение массовой доли одного из продуктов реакции (исходных веществ) в растворе по уравнению материального баланса», т.к. задачи сходны в решении. А в данном пособии задачи на нахождение массовой доли одного из исходных веществ представлены в пятом типе, что вызывает некоторую путаницу .
В четвёртом типе я выделила два подтипа:
- подтип А « Нахождение массовой доли соли»
- подтип Б «Нахождение массовой доли кислоты» .
Причём в подтипе Б рассматривается два варианта задач (нахождение массовой доли кислоты как исходного вещества и как продукта реакции).
В моей разработке для каждого подтипа представлены:
1)Формула, по которой проводится расчёт.
2)Пример решения задачи.
3)Задачи для отработки.
Подтип А «Нахождение массовой доли соли»
К 169,5 мл 36,5% раствора соляной кислоты ( добавили 12г карбида алюминия. Определите массовую долю соли в образовавшемся растворе.
Vр-ра(HCL)=169,5мл AL 4 C 3 +12HCL 4 ALCL 3 +3CH 4
W(HCL)=36,5% =0,365 mр-ра= mв-ва(Аl 4 C 3 )+ mр-ля(HCL)- m(С H 4 )
m(Аl 4 C 3 )=12г n (HCL)= ; M (HCL)= 36,5г/моль ,
__________________________ mв-ва (HCL)= mр-ра *W, mр-ра(HCL)= V *p =
W(ALCL 3 )-? =169,5мл*1,18г/мл= 200г, mв-ва (HCL)=
n (HCL)=73г: 36,5г/моль=2 моль – в избытке;
n (Аl 4 C 3 )=12г: 144г/моль=0,08 моль- в
Расчёт ведём по недостатку: n (ALCL 3 ): n (Аl 4 C 3 )=4:1 (по
ур. реакц)., n (ALCL 3 )=0,08 *4=0,32моль,
m(ALCL 3 )= 0,32моль*133,5г/моль=42,72г,
n (CH 4 ): n (Аl 4 C 3 )=3:1 (по ур. реакц)., n (CH 4 )=0,08 *3=0,24моль
m (CH 4 )= 0,24моль*16г/моль=3,84г
mр-ра= mв-ва(Аl 4 C 3 )+ mр-ля(HCL)- m(С H 4 ) =12г+ 200г-3,84г=208,16г
Задачи для отработки
- Сероводород объемом 560 мл (н. у.) пропустили через 80 г раствора бромида меди(II) с массовой долей последнего 10%. Рассчитайте массовую долю бромида меди(II) в полученном растворе (3,14%).
- В 1 л воды последовательно растворили сначала 2,24 л аммиака (н.у.), затем 4,48 л хлороводорода. Определите массовую долю хлорида аммония в полученном растворе (0,53%).
- Карбонат магния массой 8,4,г растворили в 250 мл раствора серной кислоты (р = 1,08 г/мл) с массовой долей 15%. Вычислите массовую долю сульфата магния в конечном растворе(4,4%).
- Карбид алюминия растворили в150 г 12%-ного раствора хлороводородной кислоты в результате выделилось 2,24л (н.у.) метана. Рассчитайте массовую долю соли в полученном растворе (11,6%).
- Карбид кальция массой 12,8 г растворили в 174 мл 20%-ной бромоводородной кислоты (р = 1,12 г/мл). Рассчитайте массовую долю соли в образовавшемся растворе (19,8%).
- Магний массой 19,2 г растворили в 800 мл 12%-ного раствора серной кислоты (р == 1,05 г/мл). Рассчитайте массовую долю сульфата магния в конечном растворе (11,2%).
- Газ, выделившейся при обжиге пирита массой 4,8г, пропустили через 8%-ый раствор гидроксида натрия массой 40г. Рассчитайте массовую долю соли в образовавшемся растворе (18,4%).
- Соляную кислоту объемом 150 мл (W (НС1) = 16%, р= 1,08 г/мл) нейтрализовали твердым оксидом кальция. Определите массовую долю хлорида кальция в образовавшемся растворе (21,7%).
- Смешали 200 г 10%-нрго раствора хлорида меди(П) и 200 г 5%-ного раствора сульфида калия. Определите массовую долю хлорида калия в растворе (3,5%).
Подтип Б «Нахождение массовой доли кислоты»
( как исходного вещества)
При обработке карбида алюминия раствором соляной кислоты массой 320 г и массовой долей НС1 22% выделилось 6,72 л (н.у.) метана. Рассчитайте массовую долю соляной кислоты в полученном
растворе.
mр-ра(HCL)=320 г AL 4 C 3 +12HCL 4 ALCL 3 +3CH 4
W(HCL)=22% =0,22 mр-ра= mв-ва(Аl 4 C 3 )+ mр-ля(HCL)- m(С H 4 )
V(CH 4 )=6,72л n (HCL) исх.= ; M (HCL)= 36,5г/моль ,
__________________________ mв-ва исх. (HCL) = mр-ра *W = 320г*0,22=70,4г.
W(НCL)-? n(HCL)исх.=70,4г: 36,5г/моль=1,93 моль ;
n (CH 4 )= V/V m =6,72л: 22,4л/моль=0,3 моль,
m (CH 4 ) = 0,3моль*16г/моль=4,8г
n (CH 4 ): n (HCL)=3:12=1:4
(по ур. реакц)., n (HCL )прореаг.=0,3 *4=1,2моль,
m( HCL )прореаг = 1,2моль*36,5г/моль=43,8г,
n (CH 4 ): n (Аl 4 C 3 )=3:1 (по ур. реакц)., n (Аl 4 C 3 )=0,3 :3=0,1моль
m (Аl 4 C 3 )= 0,1моль*144г/моль=14,4г
mр-ра= mв-ва(Аl 4 C 3 )+ mр-ля(HCL)- m(С H 4 ) =14,4г+ 320г-
Задачи для отработки
- Карбид алюминия массой 2,88 г растворили в 120 г 21%-ного раствора азотной кислоты. Рассчитайте массовую долю кислоты в получившемся растворе (8,27%).
- Карбид алюминия обработан 450 г 10%-ного раствора серной кислоты. Выделившийся при этом газ занял объем 4,48 л (н. у.). Рассчитайте массовую долю серной кислоты в полученном растворе(1,27%).
- Карбид алюминия растворили в 380 г раствора соляной кислоты с концентрацией 15%. Выделившийся газ занял объем 6,72 л (н.у). Рассчитайте массовую долю кислоты в полученном растворе (3,4%).
- Карбонат бария массой 7,88 г растворили в 150 мл 20%-ной хлороводородной кислоты (р = 1,163 г/мл). Какова массовая доля хлороводорода в образовавшемся растворе?(17,79%)
- Карбонат кальция массой 15 г растворили при нагревании в200мл 15%-ной хлороводородной кислоты (р= 1,075 г/мл). Какова массовая доля хлороводорода в образовавшемся растворе;?(9,5%)
- Карбонат кальция массой 10 г растворили при нагревании в 150 мл хлороводородной кислоты (р = 1,04 г/мл) с массовой долей 9%. Какова массовая доля хлороводорода в образовавшемся растворе?(4,2%)
- Карбид кальция массой 6,4 г- растворили в 87 мл бромоводородной кислоты (р = 1,12 г/мл) с массовой долей 20%. Какова массовая доля бромоводорода в образовавшемся растворе?(3,2%)
- В 15%-ном растворе серной кислоты массой 300 г растворили карбид алюминия.
Выделившийся при этом метан занял объём 2,24л (н.у). Рассчитайте массовую долю
серной кислоты в полученном растворе (8,4%).
- Рассчитайте массовую долю серной кислоты в растворе, полученном смешением 200 мл 15%-ного раствора серной кислоты плотностью 1,2 г/мл и 150 мл 10%-кого раствора нитрата бария плотностью 1,04 г/мл (7,9%).
Подтип Б «Нахождение массовой доли кислоты»
( как продукта реакции)
Через 50 г 15%-ного раствора нитрата свинца пропустили 448 мл (н.у) сероводорода. Рассчитайте массовую долю азотной кислоты в полученном растворе.
V(H 2 S)=448мл=0,448л Pb(NO 3 ) 2 +H 2 S PbS+ 2HNO 3
mр-ра(Pb(NO 3 ) 2 )=50г
W(Pb(NO 3 ) 2 )=15%=0,15
mр-ра= mв-ва(H 2 S)+ mр-ля(Pb(NO 3 ) 2 )- m(PbS)
n (H 2 S)= , n=0,448л/22,4 л/моль=0,02моль,
__________________________ m(H 2 S) = n *М= 0,02 моль*34г/моль=0,68г.
W(HNO 3 )-? mв-ва (Pb(NO 3 ) 2 )= W*mр-ра=0,15*50=7,5г,
n (Pb(NO 3 ) 2 )=7,5г: 331г/моль=0,02 моль ,
Расчёт ведём либо по кол-ву в-ва H 2 S, либо по кол-ву в-ва
Pb(NO 3 ) 2 ,т.к. они равны ; (H 2 S ): n (PbS)=1:1 (по
ур. реакц)., n (PbS )=0,02моль,
n (H 2 S ): n (HNO 3 )=1:2 (по ур. реакц).,
n (HNO 3 )=0,02*2=0,04моль
m (HNO 3 )= 0,04моль*63г/моль=2,52г
m р-ра= mв-ва(H 2 S)+ mр-ля(Pb(NO 3 ) 2 )- m(PbS)= 0,68г+ 50г-4,78г=
Задачи для отработки
- Рассчитайте массовую долю серной кислоты в растворе, полученном при пропускании 3,36 л (н.у.) сероводорода через 250 г 10%-ного раствора сульфата меди (6,11%).
- Через 100 мл раствора с массовой долей сульфата меди (II) 1,48% (плотность раствора 1,08,г/мл) пропущено 320 мл (н.у.) сероводорода. Рассчитайте массу полученного осадка и массовую долю серной кислоты в полученном растворе (0,96г,0,91%).
- Через 500 г 10% раствора сульфата меди (II) 1,48% пропустили 4,48л (н.у.) сероводорода. Рассчитайте массовую долю серной кислоты в полученном растворе (4%).
Пятый тип я назвала «Нахождение массы вещества, которую необходимо добавить, чтобы массовая доля кислоты уменьшилась(увеличилась) до определённого процента».
Для удобства в пятом типе предлагаю выделить два подтипа:
- подтип А « Нахождение массы вещества, которую необходимо добавить, чтобы массовая доля кислоты уменьшилась(увеличилась) до определённого процента»,
- подтип Б «Кислота образуется из соответствующего оксида»
Подтип А « Нахождение массы вещества, которую необходимо добавить, чтобы массовая доля кислоты уменьшилась(увеличилась) до определённого процента»
Сколько грамм карбида кальция надо добавить к 300г р-ра 60%-ой азотной кислоты, чтобы массовая доля кислоты уменьшилась до 20%?
mр-ра(HNO 3 )=300г CaC 2 +2 +C 2 Н 2
W(HNO 3 )=60% =0,6 1.
W(HNO 3 )=20% =0,2 mр-ра= mв-ва(CaC 2 )+ mр-ля(HNO 3 )- m(C 2 Н 2 )
2. Пусть n (CaC 2 ) — х моль,
тогда m(CaC 2 ) =n*M= х моль*64г/моль=64хг __________________________ n (CaC 2 ): n (C 2 Н 2 )=1:1 по ур. реакции, n (C 2 Н 2 )= х моль,
m(CaC 2 )-? m (C 2 Н 2 )= х моль*26г/моль=26х
mв-ва исх. (HNO 3 ) = mр-ра *W = 300г*0,6=180г.
n (CaC 2 ): n (HNO 3 )=1:2
(по ур. реакц)., n (HNO 3 )прореаг.=2х моль,
m(HNO 3 )прореаг = 2х моль*63г/моль=126х г,
mр-ра= mв-ва(CaC 2 )+ mр-ля(HNO 3 )- m(C 2 Н 2 ) =64хг+ 300г-
m(CaC 2 )=n*M= х моль*64г/моль=0,9 моль * 64г/моль=5,76г
Задачи для отработки
- Рассчитайте, сколько граммов карбоната кальция следует добавить к 250 г 10%-ного раствора азотной кислоты, чтобы массовая доля азотной кислоты уменьшилась вдвое (9,7г).
- Рассчитайте, сколько граммов карбида алюминия следует добавить к 150 г 21%-ного раствора азотной кислоты, чтобы массовая доля кислоты уменьшилась в 3 раза (4г).
- Рассчитайте, сколько граммов карбида алюминия следует добавить к 550 г 10%-ного раствора хлороводородной кислоты, чтобы массовая доля кислоты уменьшилась вдвое (8,94г).
- Какой объем 20%-ного раствора аммиака (р = 0,926 г/мл) необходимо добавить к 200 мл 40%-ного раствора азотной кислоты (р =1,383 г/мл), чтобы массовая доля кислоты уменьшилась вчетверо?(106,6мл)
- Сколько граммов гидроксида натрия нужно добавить к 285мл 40%-ного раствора серной кислоты (р =1,4 г/мл), чтобы массовая доля кислоты уменьшилась в 2 раза?(56г)
- Какую массу цинка необходимо растворить в 200 мл 14%-ного раствора соляной кислоты (р =1,07 г/мл), чтобы массовая доля кислоты уменьшилась в семь раз?(22,5г)
- Какой объем 30%-ного раствора аммиака (р = 0,892 г/мл) необходимо добавить к 200 мл 40%-ного раствора соляной кислоты (р =1,198 г/мл), чтобы массовая доля кислоты уменьшилась в 4 раза?(108,3мл)
Подтип Б «Кислота образуется из соответствующего оксида»
Сколько грамм серного ангидрида следует растворить в 8,45г 6%-го раствора серной кислоты для получения 38%-ного раствора кислота?
mр-ра 1 (H 2 SO 4 )=8,45г SO 3 +
W 1 (H 2 SO 4 )=6% =0,06 1.
W 2 (H 2 SO 4 )=38% =0,38 mр-ра= mв-ва(SO 3 )+ mр-ра(H 2 SO 4 )
2. Пусть n (SO 3 ) — х моль,
тогда m(SO 3 ) =n*M= х моль*80г/моль=80хг __________________________
m(SO 3 )-? mв-ва исх. (H 2 SO 4 ) = mр-ра *W = 8,45г*0,06=0,507г.
n (SO 3 ): n (H 2 SO 4 )=1:1
(по ур. реакц), n (H 2 SO 4 )прореаг.=х моль,
m(H 2 SO 4 )прореаг = х моль*98г/моль=98х г,
mр-ра= mв-ва(SO 3 )+ mр-ра(H 2 SO 4 )= 80хг+8,45г
m(SO 3 )=n*M= х моль*80г/моль= 0,04моль* 80г/моль=3,2г
Задачи для отработки
- Рассчитайте, сколько граммов фосфора необходимо сжечь в кислороде, чтобы, растворив полученный оксид в 450 г 25%-ного раствора ортофосфорной кислоты, получить 50%-ный раствор этой кислоты (55,8г).
- Рассчитайте, какую массу серы необходимо сжечь в кислороде, чтобы, растворив полученный оксид в 1,5л воды (р = 1 г/мл)., получить раствор сернистой кислоты с массовой долей 0,01(5,9г).
- Рассчитайте, какую массу оксида серы (VI) следует добавить к 250 г 15%-ного раствора серной кислоты, чтобы увеличить ее массовую долю до 30 %.(40,8г)
- Рассчитайте, какую массу оксида серы (VI) добавили в 2000 мл 8%-ного раствора серной кислоты (р = 1,06 г/мл), если массовая доля кислоты стала равной 20%(248,2г).
- Рассчитайте, какую массу оксида серы (VI) добавили в 120 мл раствора серной кислоты (р = 1,025 г/мл) с массовой долей 4%, если массовая доля кислоты-стала равной 20% (19,2г).
- Рассчитайте, какую массу фосфора необходимо сжечь в кислороде, чтобы, растворив полученный оксид в 1000 г раствора ортофосфорной кислоты с массовой долей 50%, получить раствор этой кислоты с массовой долей 75% (173,29г).
- Какой объём оксида серы (VI) следует растворить в 107,6 мл 20%-ного раствора серной кислоты (р = 1,139 г/мл), для получения 50% — го раствора серной кислоты(14,2л).
- Какую массу оксида хрома (VI) следует добавить в 275 г 10%-ного раствора хромовой кислоты (H 2 CrO 4 ), чтобы увеличить её массовую долю в 1,5 раза (13,3г).
- Рассчитайте, какую массу оксида серы (VI) добавили в 500г 20%-ного раствора серной кислоты , чтобы увеличить её массовую долю до 40%( 121г).
- Рассчитайте, какую массу оксида селена (VI) добавили в 100г 15%-ного раствора селеновой кислоты, чтобы увеличить её массовую долю вдвое( 17,8г).
Включение задач в учебный процесс позволяет реализовать следующие дидактические принципы обучения:
1) обеспечение самостоятельности и активности учащихся;
2) достижение прочности знаний и умений;
3) осуществление связи обучения с жизнью; 4) реализация предпрофильного и профильного обучения.
Данная разработка включена в программу элективных курсов для 11 классов. Надеюсь, что предоставленный материал поможет в работе по подготовке учащихся к решению заданий С4(№39) ЕГЭ по химии.
Видео:Как ЛЕГКО понять Химию с нуля — Массовая доля вещества // ХимияСкачать

По теме: методические разработки, презентации и конспекты
Методическая разработка урока элективного курса «Подготовка к ГИА по химии», по теме «Решение заданий формата С3»
Задания с развернутым ответом наиболее сложные в экзаменационной работе. Эти задания проверяют усвоение следующих элементов содержания: способы получения и химические свойства различных классов неорга.
Методические подходы к решению заданий части С2 ЕГЭ по информатике.
В статье предлагаются методические подходы при подготовке учащихся к решению заданий части С2 ЕГЭ по информатике, использование которых поможет сделать выбор учащемуся решиться выполнять задание С2 и .
Методическая разработка по теме: «Решение заданий ЕГЭ с кратким ответом»
Данный материал предназначен для подготовки к ЕГЭ.
проектная работа «Разработка методических рекомендаций обучения учащихся решению заданий ЕГЭ с кратким ответом
Данная работа поможет учителям готовить учащихся к сдаче ЕГЭ. В данном проекте даны методические рекомендации по по обучению учащихся решению заданий с кратким ответом.
Презентация «Разработка методических рекомендаций обучения учащихся решению заданий с кратким ответом по теме «Степень и её свойства» при подготовке к ОГЭ»
Данная разработка в помощь учителям математики при подготовке учащихся к ОГЭ по теме «Степень и ее свойства». А так же для выступлений на школьных методических объединениях.
Методические подходы решения заданий на генетическую связь неорганических соединений
Презентация содержит анализ основных ошибок учащихся в задании 32 ЕГЭ и примеры заданий для отработки умений выполнять задания на генетическую связь неорганических соединений.
Учебно-методический материал по теме: «Решение заданий по теме «Арифметический квадратный корень»
В учебно-методическом материале представлено 10 тестов по теме «Арифметический квадратный кореньо для учащихся 8 класса.
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Химия ПростоСкачать

Выполнение заданий высокого уровня сложности
При обучении школьников способам решения задач очень большое значение придаю применению алгоритмов. Я считаю, что вначале нужно уверенно овладеть небольшим числом стандартных приемов, получить представление о возможных типах задач. Это позволит ученику выйти на творческий уровень в своем дальнейшем химическом образовании и самообразовании.
Одно из заданий высокого уровня сложности (оно входит в третью часть экзаменационной работы – задание С4) проверяет умение производить расчеты по уравнениям реакций, происходящих в растворах.
В учебной литературе недостаточно подробно объясняются особенности решения таких задач. Поэтому мы с учениками вначале разбираем все моменты, на которые нужно обратить внимание, записываем алгоритмы в общем виде, рассматриваем решение задач каждого типа, затем отрабатываем умения на самостоятельном решении целого ряда подобных задач.
Прежде всего ученик должен усвоить понятие о массовой доле растворенного вещества, или, иначе, процентной концентрации раствора. Эта величина показывает отношение массы растворенного вещества к массе раствора:

mр.в-во = mр-р•
mр-р = mр.в-во / 
Если в условии задачи указан объем раствора с определенной плотностью, то прежде всего находят массу раствора:
mр-р = Vр-р•
затем – массу растворенного вещества:
mр.в-во = mр-р•
Количество вещества находят по массе растворенного вещества:

Рассмотрим некоторые типы задач с расчетами по уравнениям реакций, происходящих в растворах.
• Нахождение массовых долей веществ в растворе после реакции.
При решении таких задач прежде всего нужно найти количества вещества реагентов. Если задача на избыток и недостаток, то количества вещества продуктов реакции находят по веществу, которое дано в недостатке.
Один из важных моментов – это нахождение массы раствора после реакции (массы полученного раствора, mр-р получ). Если какое-либо вещество взаимодействует с веществом, находящимся в растворе, то складывают массу вещества и массу раствора; в случае, когда оба реагирующих вещества даны в виде растворов, складывают массы двух растворов. Если в результате реакции образуется осадок или газ, то из полученной суммы вычитают массу вещества, ушедшего из раствора в виде осадка или газа:
При решении задач на избыток и недостаток нужно помнить о том, что в растворе после реакции будет находиться в растворенном виде не только продукт реакции, но и вещество, которое было дано в избытке.
Чтобы найти количество вещества, которое не прореагировало – избытка, нужно от исходного количества вещества отнять количество прореагировавшего вещества:



Затем найти его массу и массовую долю в растворе, полученном после реакции.
Задача 1. 4,8 г магния растворили в 200 мл 12%-го раствора серной кислоты (


 р.в-во(MgSO4 ).
р.в-во(MgSO4 ).
mр-р(H2SO4) = Vр-р• 
mр.в-во(H2SO4) = mр-р•

В недостатке – Mg. Следовательно:


mр.в-во(MgSO4) = M• 
m(H2) = M• 

О т в е т. 
Задача 2. Смешали 250 г раствора сульфата железа(III) с концентрацией 8 % и 50 г раствора гидроксида натрия с концентрацией 30 %. Найти концентрацию веществ в получившемся растворе.


 р.в-во получ.
р.в-во получ.mр.в-во(Fe2(SO4)3) = mр-р•

mр.в-во(NaOH) = mр-р•







m(NaOH) = M• 
m(Na2SO4) = M• 
m(Fe(OH)3) = M• 


О т в е т. 

Задача 3. Карбонат кальция массой 10 г растворили при нагревании в 150 мл хлороводородной кислоты (
О т в е т. 
Задача 4. 5,6 г железа растворили в 100 мл 10%-го раствора соляной кислоты (
О т в е т. 
Задача 5. 5,6 г железа растворили в 200 мл раствора соляной кислоты (
О т в е т. 
Задача 6. Смешали 110,4 г раствора карбоната калия с концентрацией 25 % и 111 г раствора хлорида кальция с концентрацией 20 %. Найти концентрацию вещества в полученном растворе.
О т в е т. 
Задача 7. Смешали 320 г раствора сульфата меди(II) с концентрацией 5 % и 120 г раствора гидроксида натрия с концентрацией 10 %. Найти концентрации веществ в полученном растворе.
О т в е т. 

• Более сложными являются задачи на нахождение массы (или объема) вещества, которое нужно добавить к раствору другого вещества для того, чтобы его концентрация изменилась в результате произошедшей реакции.
В этом случае алгоритм решения следующий:
1) нужно обозначить за x количество добавленного вещества – реагента;
2) выразить через х количества прореагировавшего с реагентом вещества и полученного в результате реакции газа или осадка;
3) найти количество растворенного вещества в исходном растворе и его количество, оставшееся после реакции (


4) выразить через х массу оставшегося в растворе вещества;
5) найти массу раствора, полученного после реакции:
6) все данные подставить в формулу:

7) найти количество вещества реагента, его массу или объем.
Задача 8. Найти массу карбоната кальция, которую следует добавить к 600 г раствора азотной кислоты с массовой долей 31,5 %, чтобы массовая доля кислоты уменьшилась до 10,5 %.





m(CaCO3) = M• 
mр.в-во1(HNO3) = mр-р1•




mоставш(HNO3) = М• 

0,105 = (189 – 126х) / (600 + 56х),
х = 0,955 моль, 
m(CaCO3) = M• 
О т в е т. m(CaCO3) = 95,5 г.
Задача 9. Найти массу кристаллогидрата CaCl2•6H2O, которую необходимо добавить к 47 мл 25%-го раствора карбоната натрия (



Найти: m(CaCl2•6H2O).




m(CaCl2•6H2O) = M• 
m(CaCO3) = M• 
mр-р1(Na2CO3) = Vр-р1•
mр.в-во1(Na2CO3) = mр-р1•




mоставш(Na2CO3) = M• 
219x + 50,76 – 100x = 50,76 + 119x,

0,1 = 12,69 – 106х / 50,76 + 119х,
m(CaCl2•6H2O) = М• 
Задача 10. Какой объем 30%-го раствора аммиака (

Задача 11. Какой объем углекислого газа нужно добавить к 100 мл 20%-го раствора гидроксида натрия (
Задача 12. Найти объем раствора соляной кислоты (
О т в е т. Vр-р(HCl) = 135,6 мл.
• Внимание: растворенное вещество – реагент!
При решении задач на растворы нужно помнить о том, что при обычных условиях с водой реагируют следующие вещества:
1) щелочные и щелочно-земельные металлы, например:
2Na + 2H2O = 2NaOH + H2
2) оксиды щелочных и щелочно-земельных металлов, например:
3) оксиды неметаллов, например:
4) многие бинарные соединения – гидриды, карбиды, нитриды и другие, например:
KН + Н2О = KОН + Н2
Растворение вещества-реагента в воде.
Растворенным веществом в данном случае будет продукт взаимодействия вещества-реагента с водой. Масса раствора будет складываться из массы реагента и массы воды:
Если в результате реакции выделился газ, то
Задача 13. В каком объеме воды нужно растворить 11,2 л оксида серы(IV), чтобы получить раствор сернистой кислоты с массовой долей 1 %?



mр.в-во(H2SO3) = M• 
mр-р(H2SO3) = mр.в-во(H2SO3) / 
m(SO2) = M• 
m(H2O) = 4100 (г) – 32 (г) = 4068 г,
V(H2O) = m/ 
О т в е т. V(H2O) = 4068 мл.
Задачи, в которых неизвестна масса вещества-реагента, необходимого для образования раствора с определенной концентрацией.
Алгоритм решения следующий:
1) принять количество растворенного реагента за х моль;
2) согласно уравнению реакции выразить через х количества продуктов реакции;
3) найти через х массы реагента и продуктов реакции;
4) найти массу раствора;
5) подставить все данные в формулу для расчета массовой доли вещества в растворе:

Задача 14. Найти массу гидрида лития, которую нужно растворить в 100 мл воды, чтобы получить раствор с массовой долей гидроксида лития 5 %.

Пусть 
тогда 

m(LiH) = M• 
m(LiOH) = M• 
m(H2) = M• 
m(H2O) = V• 

х = 0,21, 
m(LiH) = M• 
О т в е т. m(LiH) = 1,7 г.
Растворение вещества-реагента в растворе.
В этом случае растворяемое вещество реагирует с водой, которая присутствует в растворе. Масса растворенного вещества во втором растворе складывается из массы вещества в первом растворе и массы вещества – продукта реакции:
mр.в-во1 = mр-р1•

Задача 15. К 200 г 10%-го раствора ортофосфорной кислоты добавили 28,4 г фосфорного ангидрида. Найти массовую долю кислоты в получившемся растворе.

m(P2O5) = 28,4 г.
 р.в-во2(Н3РО4).
р.в-во2(Н3РО4).

mпрод(Н3РО4) = М• 
mр.в-во1(Н3РО4) = mр-р1•

О т в е т: 
Задача 16. Найти массу фосфорного ангидрида, которую необходимо добавить к 70 г 10%-го раствора ортофосфорной кислоты, чтобы получить 40%-й раствор.


Пусть 
тогда 
mпрод(Н3РО4) = М• 
mреаг(Р2О5) = М• 
mр.в-во1(Н3РО4) = mр-р1•

х = 0,15, 
m(P2O5) = M• 
Задача 17. В 240 мл воды опустили 69 г натрия. Найти массовую долю продукта в растворе.
О т в е т. 
Задача 18. Найти массовую долю кислоты в растворе, полученном при растворении 33,6 л сернистого газа в 320 г 5%-го раствора сернистой кислоты.
О т в е т. 
Задача 19. Какую массу оксида серы(VI) нужно растворить в 150 мл воды, чтобы получить 60%-й раствор серной кислоты?
Задача 20. Найти массу оксида серы(VI), которую необходимо растворить в 99 г 40%-й серной кислоты, чтобы получить 80%-й раствор.
Задача 21. Какую массу оксида фосфора(V) нужно растворить в 120 г воды, чтобы получить 40%-й раствор ортофосфорной кислоты?
Задача 22. К 180 г 50%-го раствора ортофосфорной кислоты добавили 42,6 г оксида фосфора(V). Найти массовую долю кислоты в полученном растворе.
О т в е т. 
Задача 23. В 20 г воды растворили 3,5 г оксида натрия. Вычислите массовую долю растворенного вещества.
О т в е т. 
Задача 24. К 120 г 8%-го раствора гидроксида натрия добавили 18,6 г оксида натрия. Вычислите массовую долю гидроксида натрия в образовавшемся растворе.
О т в е т. 
Задача 25. Найти массу оксида серы(VI), которую нужно добавить к 2 л 8%-го раствора серной кислоты (
Задача 26. Какую массу фосфора необходимо сжечь в кислороде, чтобы, растворив полученный оксид в 1000 г раствора ортофосфорной кислоты с массовой долей 50 %, получить раствор этой кислоты с массовой долей 75 %?
О т в е т. m(P) = 173,2 г.
Задача 27. Какую массу натрия необходимо растворить в 120 мл воды для получения раствора щелочи с массовой долей 18 %?
Видео:Расчет выхода продукта от теоретически возможного. 10 класс.Скачать

Решения задач, объединяющих в себе растворы и химические реакции
Видео:Задачи на ВЫХОД ПРОДУКТА химической реакции | Расчет выхода продукта от теоретически возможногоСкачать

Определение массовой доли растворенного вешества
Приведены алгоритмы решения задач, которые объединяют в себе растворы и химические реакции. При их решении следует сначала записать все уравнения химических реакций, а затем составлять алгоритм. В таких задачах необходимо учитывать возможность образования осадка, выделения газа, участия воды в химических реакциях.
Задача 3.
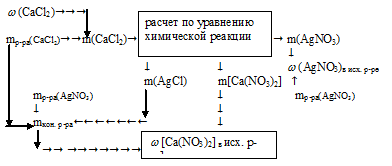
Для реакции с 200 г водного раствора нитрата серебра потребовалось 70 г 3%-ного раствора СаС12 в воде. Определите массовую долю АgNО3 в исходном растворе и массовую долю соли в полученном растворе.
Дано:
масса раствора нитрата серебра: mр-ра(АgNО3) = 200 г;
масса раствора хлорида кальция: mр-ра(СаС12) = 70 г;
массовая доля хлорида кальция в исходном р-ре: 
Найти:
массовую долю АgNО3в исходном р-ре: 
массовую долю соли в полученном растворе: (соли)в кон. р-ре = ?
Решение:
В реакцию вступает нитрат серебра и хлорид кальция. Вода, образующая растворы этих веществ, во взаимодействии не участвует. Записываем уравнение реакции:
В результате реакции одна из получающихся солей нерастворима и выпадает в осадок, следовательно, во втором вопросе задачи требуется определить массовую долю нитрата кальция в конечном растворе:
(СаNО3)2)в кон. p-ре = ?
Возможно несколько алгоритмов решения данной задачи, например:
1. Определяем массу СаС12 в 70 г 3% -ного раствора.
2. По уравнению реакции определяем массы AgNO3; AgCl и Ca(NO3)2:
х г АgNО3 взаимодействует с 21 г СаС12 (по данным условия)
340 г АgNО3 взаимодействует со 111 г СаС12 (по уравнению)
21 г СаС12 дает у г AgCl (по данным условия)
1 1 1 г СаС12 дают 287 г AgCl (по уравнению)
21 г СаС12 дает г г Са(NО3)2 (по данным условия)
111 г СаС12 дают 164 г Са(NО3)2 (по уравнению)
3. Определяем массовую г АgNО3 в исходном растворе.
4. Определяем массу конечного раствора после реакции. Так как хлорид серебра в результате реакции выпадает в осадок, можно записать:
5. Определяем массовую долю Са(NО3)2 в конечном растворе.
Ответ: 

Видео:Расчеты по уравнениям химических реакций. 1 часть. 8 класс.Скачать

Определение массы растворенного вешества
Задача 4.
Определите массу 3%-ного водного раствора NаОН, который необходимо добавить к 50,0 г Ка для получения 49% — ного раствора NаОН в воде.
Дано:
массовая доля NаОН в исходном р-ре: 
масса натрия: m(Nа) = 50 г;
массовая доля NаОНв конечном р-ре:
Найти:
массу исходного раствора: mисх.р-ра = ?
Решение:
Когда мы раствор NаОН в воде добавляем к металлическому .натрию, происходит реакция Nа с водой из исходного раствора. NаОН, который исходно находился в растворе, участия в реакции не принимает. Из конечного раствора выделяется газообразный водород.
Отобразим условие задачи в виде рисунка:
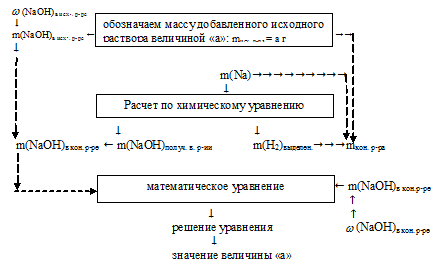
Решение данной задачи возможно лишь по встречному алгоритму.
1. Искомой величиной является масса 3%-ного раствора NаОН. Обозначим ее значением «а». Используя mисх. р-ра = а, как известную величину, составляем встречный алгоритм.
2. Используя значение массы исходного раствора как известную величину, находим массу NаОН в исходном растворе:
3. Используя указанную в условии массу натрия, по уравнению реакции находим массы NаОН и Н2, полученные в результате взаимодействия:
50 г Nа дают х г NаОН (по данным условия)
46 г Nа дают 80 г NаОН (по уравнению реакции)
50 г Nа дают y г H2 (по данным условия)
46 г Nа дают 2 г H2 (по уравнению реакции)
3. По полученным данным находим массу NаОН в конечном растворе.
m(NаОН)в кон. р-ре = m(NаОН)в исх. р-ре + m(NаОН)кон. в реакции = (0,03 . a + 87) г.
4. Находим массу конечного раствора.
5. Определяем массу NаОН в конечном растворе:
6. В предыдущих действиях мы определили массу NаОН в конечном растворе двумя разными путями. Но так как конечный раствор NаОН один и тот же, то и содержание NаОН в нем одно и тоже. Это позволяет нам приравнять два полученных выражения и получить одно математическое уравнение с одним неизвестным:
0,03 . а + 87 = 0,49 . а + 23,4
Решая его, получаем: а = 138 г.
Величиной «а» мы обозначали массу исходного 3%-ного раствора NОН.
Ответ: необходимо 138 г исходного 3% -ного раствора NаОН.
📹 Видео
Задачи на примеси. 1 часть. 9 класс.Скачать

Решение задач по уравнениям реакций, если одно из реагирующих веществ взято в избытке. 1 ч. 9 класс.Скачать

Определение массовых долей элементов в соединениях. 8 класс.Скачать

Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать

Задачи на выход продукта химической реакции. Подробный разбор.Скачать

Расчет массовой доли вещества в растворе по уравнению химической реакцииСкачать

Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Химия. 9 класс. Расчет массовой доли выхода продукта по сравнению с теоретически возможным выходомСкачать

Как решать задачи с МАССОВОЙ ДОЛЕЙ | Массовая доля растворенного веществаСкачать

ОГЭ. Задание 22. Решение задач. Часть 1. Растворы и осадки.Скачать

Задачи на массовую долю | Химия ЕГЭ для 10 класса | УмскулСкачать