При нагревании образца гидрокарбоната натрия часть вещества разложилась. При этом выделилось 4,48 л газа и образовалось 63,2 г твёрдого безводного остатка. К полученному остатку добавили минимальный объём 20%-ного раствора соляной кислоты, необходимый для полного выделения углекислого газа. Определите массовую долю хлорида натрия в конечном растворе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления.
При разложении гидрокарбоната натрия образовалась средняя соль – карбонат натрия и выделился углекислый газ:
Поскольку в растворе не осталось карбонат-анионов, следовательно, реакция карбоната и гидрокарбоната натрия с соляной кислотой прошла полностью:
Вычислим количество углекислого газа, выделившегося при прокаливании гидрокарбоната: следовательно, образовалось 0,2 моль карбоната натрия и прореагировало 0,4 моль гидрокарбоната натрия. Вычислим массы образовавшегося карбоната натрия и оставшегося после реакции разложения гидрокарбоната натрия:
Вычислим количество вещества соляной кислоты, взаимодействующей с солями.
Поскольку то
и
Масса исходного раствора соляной кислоты равна:
Образующийся в результате реакции гидрокарбоната и карбоната натрия с соляной кислотой углекислый газ выделяется из раствора, вычислим его массу:
Вычислим количество и массу хлорида натрия в образовавшемся растворе:
Вычислим массу образовавшегося раствора и массовую долю хлорида натрия в нем:
- Гидрокарбонат натрия
- Содержание
- Химические свойства
- Реакция с кислотами
- Термическое разложение
- Получение
- Применение
- В химической промышленности
- В кулинарии
- В медицине
- Противопоказания к применению в медицинских целях
- Пожаротушение
- В быту
- В транспорте
- Производство
- Хранение
- Безопасность
- 25. Напишите уравнение реакции термического разложения гидрокарбоната натрия, основываясь на сокращенном ионном уравнении, приведенном в тексте параграфа.
- 25. Напишите уравнение реакции термического разложения гидрокарбоната натрия, основываясь на сокращенном ионном уравнении, приведенном в тексте параграфа.
- 🔥 Видео
Видео:Опыты по химии. Разложение гидрокарбоната натрия при нагреванииСкачать

Гидрокарбонат натрия
| Гидрокарбонат натрия | |
|---|---|
 | |
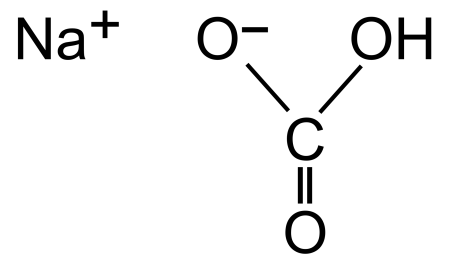 | |
| Систематическое наименование | гидрокарбонат натрия |
| Традиционные названия | пищевая (питьевая) сода, сода двууглекислая, двууглекислый натрий, бикарбонат натрия, кислый углекислый натрий |
| Хим. формула | CHNaO₃ |
| Рац. формула | NaHCO3 |
| Состояние | твёрдое |
| Молярная масса | 84,0066 г/моль |
| Плотность | 2,159 г/см³ |
| Т. разл. | 60—200 °C |
| Растворимость в воде | 9,59 г/100 мл |
| ГОСТ | ГОСТ 2156-76 ГОСТ 4201-79 ГОСТ 32802-2014 |
| Рег. номер CAS | 144-55-8 |
| PubChem | 516892 |
| Рег. номер EINECS | 205-633-8 |
| SMILES | |
| Рег. номер EC | 205-633-8 |
| Кодекс Алиментариус | E500(ii) |
| RTECS | VZ0950000 |
| ChEBI | 32139 |
| ChemSpider | 8609 |
| ЛД50 | 4220 мг/кг |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Гидрокарбонат натрия (лат. Natrii hydrocarbonas ), другие названия: бикарбонат натрия, чайная сада, питьевая или пищевая сода, двууглекислый натрий — неорганическое соединение, натриевая кислая соль угольной кислоты с химической формулой NaHCO3.
В обычном виде — мелкокристаллический порошок белого цвета.
Используется в промышленности, пищевой промышленности, в кулинарии, в медицине как нейтрализатор химических ожогов кожи и слизистых оболочек концентрированными кислотами и для снижения кислотности желудочного сока. Также применяется в буферных растворах.
Видео:Карбонат натрия из пищевой содыСкачать

Содержание
- 1 Химические свойства
- 1.1 Реакция с кислотами
- 2 Термическое разложение
- 3 Получение
- 4 Применение
- 4.1 В химической промышленности
- 4.2 В кулинарии
- 4.3 В медицине
- 4.3.1 Противопоказания к применению в медицинских целях
- 4.4 Пожаротушение
- 4.5 В быту
- 4.6 В транспорте
- 5 Производство
- 6 Хранение
- 7 Безопасность
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Химические свойства
Гидрокарбонат натрия — кислая натриевая соль угольной кислоты. Проявляет все свойства соли сильного основания и слабой кислоты. В водных растворах имеет слабощелочную реакцию. В широком диапазоне концентраций в водном растворе pH раствора изменяется незначительно, на этом основано применение раствора вещества в качестве буферного раствора.
Реакция с кислотами
Гидрокарбонат натрия реагирует с кислотами с образованием соответствующей кислоте соли, например, хлорида натрия, сульфата натрия и угольной кислоты, которая в процессе реакции распадается на углекислый газ и воду, при этом углекислый газ выделяется из раствора в виде пузырьков:
В быту обычно применяется реакция «гашения соды» уксусной кислотой, с образованием ацетата натрия или гашение лимонной кислотой с образование цитрата натрия, реакция с уксусной кислотой:
Видео:Опыты по химии. Превращение гидрокарбоната кальция в карбонат кипячениемСкачать

Термическое разложение
При температуре выше 60 °C гидрокарбонат натрия начинает распадаться на карбонат натрия, углекислый газ и воду (процесс разложения наиболее эффективен при 200 °C, при более высоких температурах карбонат натрия начинает распадаться на оксид натрия и углекислый газ):
При этом процессе выделения воды в виде водяного пара и углекислого газa масса исходного продукта уменьшается примерно на 37 %.
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Получение
В промышленности гидрокарбонат натрия получают аммиачно-хлоридным способом. В концентрированный раствор хлорида натрия, насыщенный аммиаком, под давлением пропускают углекислый газ. В процессе синтеза происходят две реакции:
В холодной воде гидрокарбонат натрия мало растворим, и его отделяют от охлаждённого раствора фильтрованием, а из полученного после фильтрования раствора хлорида аммония снова получают аммиак, возвращаемый в производство вновь:
Видео:Реакция гидрокарбоната натрия(пищевой соды) с соляной кислотой | NaHCO3 + HCl → NaCl + CO2 + H2OСкачать

Применение
Двууглекислый натрий (бикарбонат) применяется в химической, пищевой, лёгкой, медицинской, фармацевтической промышленности, цветной металлургии, в быту. Зарегистрирован в качестве пищевой добавки E500 (ii), входит в состав пищевой добавки E500.
В химической промышленности
Применяется для производства красителей, пенопластов и других органических продуктов, фторорганических соединений, продуктов бытовой химии, наполнителей в огнетушителях, Реагент для отделения диоксида углерода, сероводорода из газовых смесей, например, отходящих газов топливосжигающих установок. В этом процессе углекислый газ поглощается раствором гидрокарбоната натрия при повышенном давлении и пониженной температуре, далее поглощённый углекислый газ выделяется из раствора при подогреве и снижении давления;
В лёгкой промышленности — в производстве резины для подошв обуви и в производстве искусственных кож, кожевенном производстве при дублении и нейтрализации кожи после кислого дубления, текстильной промышленности при отделке шёлковых и хлопчатобумажных тканей;
В пищевой промышленности — в хлебопечении, производстве кондитерских изделий, приготовлении газированных напитков.
В кулинарии
Основное применение пищевой соды в пищевой промышленности и в быту — кулинария, где применяется, преимущественно, в качестве основного или дополнительного разрыхлителя в составе кислого и пресного теста. При добавлении питьевой соды в кислое тесто происходит реакция с молочной кислотой, продуцированной при заквашивании дрожжевыми микроорганизмами, при этой реакции выделяется углекислый газ, вспучивающий тесто.
При добавлении в пресное тесто углекислый газ выделяется при выпечке из-за термического разложения.
При применении соды в чистом виде важно соблюсти правильную дозировку, так как она оставляет в продукте карбонат натрия, дающий определённый привкус. Порядок замешивания для теста: соду — в муку, кислые компоненты (уксус, кефир и пр.) — в жидкость.
В медицине
Традиционно раствор питьевой соды используется для дезинфекции зубов и дёсен при зубных болях и полости рта и горла, при сильном кашле, ангине, фарингите, а также как общепринятое средство от изжоги и болей в желудке.
Применяется при заболеваниях, сопровождающиеся выраженным ацидозом (при диабете, инфекциях и др), для борьбы с ацидозом при хирургических вмешательствах (назначается 3-5 г. внутрь).
Применяется в качестве антиаритмического средства.
Как антацидное средство (как и все другие щелочи) применяется при язвенной болезни желудка, и двенадцатиперстной кишки, при повышенной кислотности желудочного сока.
Имеются так же данные о применении препарата (в виде капельных и внутривенных вливаний) при гипертонической болезни, симптоматической почечной гипертонии, и хронической почечной недостаточности. Эффект связан с увеличением выделения ионов натрия и хлора и возрастанием осмотического диуреза.
В виде свечей применяется против укачивания при морской и воздушной болезнях
Применяется в качестве отхаркивающего средства, т.к. повышая щелочные резервы крови, сдвигает в щелочную сторону реакцию бронхиальной слизи, делая мокроту менее вязкой.
При ринитах, конъюнктивитах, стоматитах, ларингитах и т.п. применяют для полосканий, промываний, ингаляций 0,5 — 2% р-ры гидрокарбоната натрия.
Применяется внутривенно с целью быстрого устранения метаболического ацидоза во время реанимационных мероприятий, заболеваниях почек.
Нужно иметь ввиду, что в результате применения может возникнуть т.н. кислотный рикошет (при реакции содой с соляной кислотой происходит выделение CO2, который оказывает раздражающее действие на стенку желудка, усиливая выделение гастрина).
В альтернативной медицине питьевая сода иногда заявляется как «лекарство» от рака, однако, никакой экспериментально подтверждённой эффективности применения такого «лечения» не существует.
Противопоказания к применению в медицинских целях
Индивидуальная гиперчувствительность; состояния, сопровождающиеся развитием алкалоза; гипокальциемия, при приеме внутрь усиливает алкалоз и повышает риск развития тетанических судорог, гипохлоремия — снижение концентрации в крови ионов Cl — , в том числе вызванная рвотой, или снижением всасывания в желудочно-кишечном тракте, может привести к тяжёлому алкалозу.
Является источником натрия, тем самым увеличивая объём циркулирующей крови, усугубляя отёки и повышая артериальное давление. Применение при сниженной скорости клубочковой фильтрации может привести к метаболическому алкалозу.
Пожаротушение
Гидрокарбонат натрия вместе с карбонатом аммония используется в качестве наполнителя в огнетушителях с сухим наполнением и в стационарных системах сухого пожаротушения. Это применение обусловлено тем, что от воздействия высокой температуры в очаге горения вещество выделяет углекислый газ, атмосфера которого затрудняет доступ кислорода воздуха в очаг горения.
В быту
Применяется как безопасное для здоровья средство для чистки поверхностей столовой и кухонной посуды, поверхностей кухонных столов, иных поверхностей, соприкасающихся с пищей, путем протирки их с помощью влажной тряпки с сухим порошком питьевой соды.
В транспорте
Применяется для нейтрализации следов электролита — серной кислоты на поверхности пластмассовых корпусов свинцовых аккумуляторов насыщенным водным раствором питьевой соды.
Видео:Реакция большого количества натрия с водой.Скачать

Производство
В Российской Федерации двууглекислый натрий выпускается в соответствии с требованиями и техническими условиями, выпускается на предприятиях АО «Башкирская содовая компания» в г. Стерлитамак, Республика Башкортостан, а также на Крымском содовом заводе в г. Красноперекопск, Крымский полуостров.
Видео:Химический видео Опыт Сода+ Уксус. Уравнение реакций. Простой опыт по ХИМИИ.Скачать

Хранение
Гидрокарбонат натрия хранят в закрытых упаковках, в сухом месте вдали от источников огня. Гарантийный срок хранения натрия двууглекислого — 12 месяцев со дня изготовления. Срок годности не ограничен.
Видео:Химия 9 класс (Урок№19 - Угольная кислота.)Скачать

Безопасность
Вещество нетоксично, пожаро- и взрывобезопасно.
Имеет солоноватый, мыльный вкус. При попадании пыли вещества на слизистые оболочки глаз и носа вызывает лёгкое раздражение. При частой работе в атмосфере, загрязнённой пылью двууглекислого натрия, может возникнуть раздражение верхних дыхательных путей. Предельно допустимая концентрация пыли бикарбоната натрия в воздухе производственных помещений 5 мг/м 3 .
- ГОСТ 2156-76. Натрий двууглекислый. Технические условия (с Изменениями № 1, 2, 3, 4).
- ГОСТ 32802-2014. Добавки пищевые. Натрия карбонаты E500. Общие технические условия.
Видео:Лабораторная работа №3 Гидролиз. Кислотно-основные взаимодействия в растворахСкачать

25. Напишите уравнение реакции термического разложения гидрокарбоната натрия, основываясь на сокращенном ионном уравнении, приведенном в тексте параграфа.
Видео:Опыты по химии. Гидролиз гидрокарбоната натрия, карбоната натрия и силиката натрияСкачать

25. Напишите уравнение реакции термического разложения гидрокарбоната натрия, основываясь на сокращенном ионном уравнении, приведенном в тексте параграфа.
задача №25
к главе «Глава 19. Химия элементов-неметаллов. §19.10 Углерод и его соединения».
Выделите её мышкой и нажмите CTRL + ENTER
Большое спасибо всем, кто помогает делать сайт лучше! =)
Нажмите на значок глаза возле рекламного блока, и блоки станут менее заметны. Работает до перезагрузки страницы.
🔥 Видео
Как ЛЕГКО понять Химию с нуля — Массовая доля вещества // ХимияСкачать

Гидрокарбонат натрия и лакмусСкачать

Разложение гидрокарбоната натрияСкачать

🔥 Получил МЕТАЛЛ из СОДЫ. Старинный способ ДОБЫЧИ НАТРИЯ.Скачать

СОДА ВЫЗЫВАЕТ РАК! Безумные мифы о приеме соды 😱Скачать

Гидрокарбонат натрия (питьевая сода)Скачать

Как правильно лечиться и принимать пищевую соду.Скачать

Разбор всех типов 29-30 заданий из сборника Добротина 2023 | Екатерина СтрогановаСкачать

Натрия гидрокарбонат при сердечно-легочной и церебральной реанимацииСкачать




