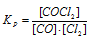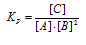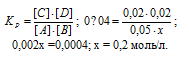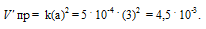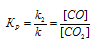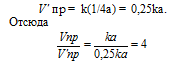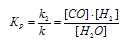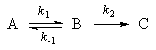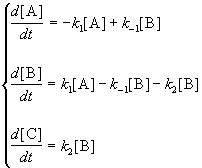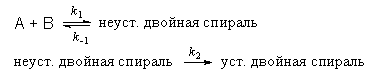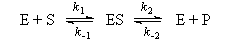- Константа равновесия химической реакции
- Скорость реакции
- Равновесие гомогенной системы
- Химическая кинетика и равновесие (стр. 4 )
- Решение
- Задача 11. Смешали по три моля веществ А, В, С. После установления равновесия А + В = 2С в системе обнаружили 5 моль вещества С. Рассчитайте константу равновесия. Определите равновесный состав смеси (в мольных %), полученной смешением веществ А, В, С в мольном соотношении 3:2:1 при той же температуре.
- Решение
- Первый случай:
- Начальная скорость гомогенной химической реакции c2cl4 cl2 c2cl6 описывается уравнением
- 🎥 Видео
Видео:Скорость химической реакции. Гомо- и гетерогенные реакции. Механизм реакции.Скачать

Константа равновесия химической реакции
Задание 128.
В гомогенной системе СО + Сl2 ↔ СОСl2 равновесные концентрации реагирующих веществ (моль/л): [СО] = 0,2; [Сl2] = 0,3; [СОСl2] = 1,2. Вычислите константу равновесия системы и исходные концентрации Сl2 и СО. Ответ:
К р = 20; [С12]исх = 1,5 молы/л; [СO]исх = 1.4 молы/л.
Решение:
Уравнение реакции имеет вид:
Выражение константы равновесия данной реакции имеет вид:
Подставляя в него данные задачи, получим:
Кр = 1,2/(0,2 . 0,3) = 20.
Для нахождения исходных концентраций веществ СО и Cl2 учтём, что, согласно уравнению реакции, из 1 моль Со и 1 моль Cl2 образуется 1 моль COCl2. Поскольку по условию задачи в каждом литре системы образовалось 1,2 моль COCl2, то при этом было израсходовано 1,2 моль СО и 1,2 моль Cl2. Таким образом, искомые исходные концентрации равны:
Ответ: К = 20; [С12]исх = 1,5 молы/л; [СO]исх = 1.4 молы/л.
Задание 129.
В гомогенной системе А + 2В = С равновесные концентрации реагирующих газов (молы/л): [А] = 0,06; [В] = 0,12; [С] = = 0,216. Вычислите константу равновесия системы и исходные концентрации веществ А и В. Ответ: К = 250; [А] = 0,276 моль/л; [В] = 0,552 моль/л.
Решение:
Уравнение реакции имеет вид:
Выражение константы равновесия данной реакции имеет вид:
Подставляя в него данные задачи, получим:
Кр = 0,216/[0,06 . (0,12)2] = 250.
Для нахождения исходных концентраций веществ А и В учтём, что, согласно уравнению реакции, из 1 моль А и 2 моль В образуется 1 моль C. Поскольку по условию задачи в каждом литре системы образовалось 0,216 моль C, то при этом было израсходовано 0,216 моль А и 0,432 моль В.
Таким образом, искомые исходные концентрации равны:
[А]исх = 0,06 + 0,216 = 0,276 молы/л;
[В]исх = 0,12 + 0,432 = 0,552 молы/л.
Ответ: Кр = 250; [А] = 0,276 моль/л; [В] = 0,552 моль/л.
Задание 130.
В гомогенной газовой системе А + В С ↔ С + D равновесие установилось при концентрациях (моль/л): [В] = 0,05 и [С] 0,02. Константа равновесия системы равна 0,04. Вычислите исходные концентрации веществ А и В. Ответ: [А] = 0,22 моль/л; [В] = =0,07 молы/л.
Решение:
Уравнение реакции имеет вид:
Обозначим исходную концентрацию вещества А через х. По уравнению реакции в результате взаимодействия веществ А и В образуются одинаковые количества вещества С и D, т. е. равновесные концентрации продуктов будут равны: [С] = [D] = 0,02 моль/л. Подставляем равновесные концентрации веществ в выражение константы равновесия:
Поскольку по условию задачи в каждом литре системы образовалось 0,02 моль веществ C и D, то при этом было израсходовано 0,02 моль А и 0,02 моль В. Таким образом, искомые исходные концентрации равны:
[А]исх = 0,2 + 0,02 = 0,22 молы/л;
[В]исх = 0,05 + 0,02 = 0,07 молы/л.
Ответ: [А] = 0,22 моль/л; [В] = =0,07 молы/л.
Видео:Химическая кинетика. Скорость химической реакции | ХимияСкачать

Скорость реакции
Задание 131.
Константа скорости реакции разложения N2O, протекающей по уравнению 2N 2 O = 2N 2 + О 2, равна 5 . 10 -4 . Начальная концентрация N2О равна 6,0 моль/л. Вычислите начальную скорость реакции и её скорость, когда разложится 50% N2O. Ответ: 1,8 . 10-2; 4,5 . 10 -3 .
Решение:
Уравнение реакции имеет вид:
Обозначим начальную концентрацию исходного вещества: [N2O] = a. Согласно закону действующих масс, скорость прямой реакции до изменения концентрации N2O равна:
Vпр = ka2 = 5 . 10 -4 . (6) 2 = 1,8 . 10 -2 .
После разложения 50% N2O, концентрация его будет равна 3 моль/л (50 . 6/100 = 3). При новой концентрации N2O скорость прямой реакции ( пр) равна:
Ответ: 1,8 . 10 -2 ; 4,5 . 10 -3 .
Задание 132.
Напишите выражение для константы равновесия гетерогенной системы
СО2 + С ↔ 2СО. Как изменится скорость прямой реакции образования СО, если концентрацию СО2 уменьшить в четыре раза? Как следует изменить давление, чтобы повысить выход СО?
Решение:
Уравнение реакции имеет вид:
При равновесии скорости прямой и обратной реакции равны, а отношение констант этих скоростей постоянно и называется константой равновесия системы:
При гетерогенной реакции учитываются только концентрации газообразных веществ. Обозначим концентрацию исходного вещества: [CO2] = a. Согласно закону действующих масс, скорость прямой реакции до изменения концентрации равна: Vпр = ka. После уменьшения концентрации СО2 в 4 раза её значение можно записать так: [CO2] = 1/4a. При новой концентрации СО2 скорость прямой реакции пр будет равна:
Следовательно, при уменьшении концентрации СО2 в 4 раза скорость прямой реакции уменьшится в 4 раза.Так как в данной системе происходит увеличение объёма (из 1 моль газообразного исходного вещества образуется
2 моль газообразного продукта реакции), то для смещения равновесия в данной системе в сторону прямой реакции – образовании СО надо уменьшить давление в системе.
Задание 133.
Напишите выражение для константы равновесия гетерогенной системы
С + Н2О (г) ↔ СО + Н2. Как следует изменить концентрацию и давление, чтобы сместить равновесие в сторону обратной реакции — образования водяных паров?
Решение:
Уравнение реакции имеет вид:
При равновесии скорости прямой и обратной реакции равны, а отношение констант этих скоростей постоянно и называется константой равновесия данной системы. В выражении для гетерогенной системы концентрации твёрдых веществ не указываются. Выражение константы равновесия для данной реакции:
а) Смещение равновесия в сторону образования водяных паров можно достигнуть увеличением концентрации СО или Н2, так и уменьшением концентрации паров воды, так как, согласно принципу Ле Шателье, равновесие в системе сместится в сторону той реакции, которая ослабляет это воздействие.
б) Так как в данной системе из углерода и водяных паров образуются углекислый газ и водород, т. е. в данной системе увеличивается объём (из 1 моль газа образуется 2 моль газов), то для смещения равновесия в сторону образования паров воды надо увеличить давление.
Видео:Скорость химических реакций. 9 класс.Скачать

Равновесие гомогенной системы
Задание 134.
Равновесие гомогенной системы
4НСI (г) + О 2 ↔ 2Н2О (г) + 2Сl2 (г)
установилось при следующих концентрациях реагирующих веществ (молы/л): [Н2O]P = 0,14; [С12]P = 0,14; [НС1]P = 0,20; [O2]р = О,32. Вычислите исходные концентрации хлороводорода и кислорода. Ответ: [НС1]исх = 0,48 моль/л; [О2]исх = 0,39 моль/л.
Решение:
Уравнение реакции имеет вид:
Для нахождения исходных концентраций хлороводорода и кислорода учтём, что согласно уравнению реакции из 4 моль HCl 1 моль О2 образуется 2 моль Н2О и 2 моль Cl2. Поскольку по условию задачи в каждом литре системы образовалось 0,14 моль Н2О и 0,14 моль Cl2, то при этом было израсходовано 0,14 . 4/2 = 0,28 моль HCl и ,
14 . 1/2 = 0,07 моль Cl2. Таким образом, искомые концентрации HCl и Cl2 равны:
Ответ: [НС1]исх = 0,48 моль/л; [О2]исх = 0,39 моль/л.
Видео:Решение задач по теме Скорость химической реакцииСкачать

Химическая кинетика и равновесие (стр. 4 )
 | Из за большого объема этот материал размещен на нескольких страницах: 1 2 3 4 5 |
Ответ: скорость реакции увеличится в 16 раз.
Задача 2 . Во сколько раз изменится скорость прямой и обратной реакции в системе: 2SO2(г) + O2(г) ↔2SO3(г), если объем газовой смеси уменьшить в три раза? В какую сторону сместится равновесие системы?
Обозначим концентрации реагирующих веществ: [SO2] = а, [O2] = b, [SO3] = c. Согласно закону действия масс, скорости и прямой и обратной реакций до изменения объема
υпр = k·а2·b ; υобр = k1·с2
После уменьшения объема гомогенной системы в три раза концентрация каждого из реагирующих веществ увеличится в три раза: [SO2] = 3a, [O2] = 3b, [SO3] = 3c. При новых концентрациях скорости υ’ прямой и обратной реакций: υ’пр = k·(3a)2·(3b) = 27·k·a2·b; υ’обр= k1·(3с)2 = 9·k1·с2. Отсюда
Следовательно, скорость прямой реакции увеличилась в 27 раз, а обратной – только в девять раз. Равновесие системы сместилось в сторону образования SO3.
Задача 3. В реакции С(т)+2 H 2 (г) ↔ CH 4 (г) концентрацию водорода уменьшили в 3 раза. Как изменится скорость реакции?
Согласно закону действующих масс, начальная скорость реакции равна υн= k ∙ [ H 2 ]2. После уменьшения концентрации водорода в 3 раза скорость станет равна υк= k ∙ (1/3)2[ H 2 ]2 =1/9 k [ H 2 ]2. После изменения концентрации водорода скорость изменится следующим образом: υк/υн=1/9 k [ H 2 ]2/ k [ H 2 ]2=1/9.
Ответ: скорость реакции уменьшится в 9 раз.
Задача 4 . Во сколько раз возрастет скорость реакции при повышении температуры с 10 до 30 oС (γ = 3)?
При увеличении температуры с 10 до 30 oС скорость реакции в соответствии с правилом Вант-Гоффа возрастает:
υ 2 /υ1=γ( t 2- t 1)/10 , где t 2 =30 o C , t 1 =10 o C , а υ2 и υ1 – скорости реакции при данных температурах. Получаем υ 2 / υ 1 =3(30–10)/10=32=9, т. е. скорость реакции увеличится в 9 раз.
Задача 5 . Вычислите, во сколько раз увеличится скорость реакции, протекающей в газовой фазе, при повышении температуры от 30 до 70 0С, если температурный коэффициент реакции равен 2.
Зависимость скорости химической реакции от температуры определяется эмпирическим правилом Вант-Гоффа по формуле:

Следовательно, скорость реакции при температуре 70 0С больше скорости реакции при температуре 30 0С в 16 раз.
Задача 6 . Равновесие реакции 2 H 2 (г)+ O 2 (г) ↔ 2 H 2 O (г) ; ∆ H
1) при уменьшении давления; 2) при увеличении давления?
Все вещества в системе – газы. В соответствии с принципом Ле Шателье , повышение давления приводит к смещению равновесия в сторону реакции, приводящей к меньшему количеству молей газов, т. е. в сторону образования Н2О. Следовательно, повышение давления в системе смещает равновесие реакции вправо.
Ответ: при увеличении давления.
Задача 7. В какую сторону сместится равновесие реакции 2 SO 2 (г)+ O 2 (г)↔ 2 SO 3 (г); ∆ H
Поскольку ∆ H экзотермической . Обратная реакция будет эндотермической . Повышение температуры всегда благоприятствует протеканию реакции с поглощением теплоты, т. е. равновесие сместится в сторону исходных веществ.
Задача 8. Определите константу равновесия реакции NOCl 2 (г)+ NO (г) ↔ 2NOCl(г), если при некоторой температуре равновесные концентрации веществ составляют [NOCl2]=0,05; [NO]=0,55; [NOCl]=0,08 моль/л.
Константа равновесия обратимой химической реакции равна отношению произведения равновесных концентраций продуктов к произведению равновесных концентраций исходных веществ. Значение каждой из концентраций должно быть возведено в степень, равную стехиометрическому коэффициенту перед соответствующим веществом в уравнении реакции. Поэтому

Задача 9 . Эндотермическая реакция разложения пентахлорида фосфора протекает по уравнению:
РСl5(г) ↔ РСl3(г)+Сl2(г); ∆Н = + 92,59 кДж.
Как надо изменить: а) температуру; б) давление; в) концентрацию, чтобы сместить равновесие в сторону прямой реакции – разложения РСl5?
Смещением, или сдвигом химического равновесия, называют изменение равновесных концентраций реагирующих веществ в результате изменения одного из условий реакции. Направление, в котором сместилось равновесие, определяется по принципу Ле Шателье: а) так как реакция разложения PCl5 эндотермическая (∆Н > 0), то для смещения равновесия в сторону прямой реакции нужно повысить температуру; б) так как в данной системе разложение PCl5 ведет к увеличению объема газообразных веществ (из одной молекулы газа образуются две газообразные молекулы), то для смещения равновесия в сторону прямой реакции надо уменьшить давление; в) смещение равновесия в указанном направлении можно достигнуть как увеличением концентрации PCl5, так и уменьшением концентрации PCl3 или Cl2.
Задача 10. Один моль аммиака поместили в сосуд объемом 20 л и нагрели до 600 0C. Давление в сосуде оказалось равным 435 кПа. Рассчитайте степень разложения аммиака.
Видео:Как выучить Химию с нуля за 10 минут? Принцип Ле-ШательеСкачать

Решение
Количество (моль) газов после реакции:
PV/RT = 435∙20/(8,31∙873) = 1,20 моль
Если разложилось х моль аммиака, то схема разложения:
Осталось NH3 (1-х); получилось N2 (х/2) + H2 (3х/2)
Из уравнения: 1,20 моль = (1-x) + x/2 + 3x/2 = 1+x
получим x = 0,2 моль.
Ответ: Степень разложения аммиака 20 %.
Видео:Скорость химических реакций. Гомогенные и гетерогенные реакции. Химия 8 классСкачать

Задача 11. Смешали по три моля веществ А, В, С. После установления равновесия А + В = 2С в системе обнаружили 5 моль вещества С. Рассчитайте константу равновесия. Определите равновесный состав смеси (в мольных %), полученной смешением веществ А, В, С в мольном соотношении 3:2:1 при той же температуре.
Видео:Влияние концентрации на скорость химических реакций. 10 класс.Скачать

Решение
Видео:Скорость химической реакцииСкачать

Первый случай:
Соотношение количества веществ (моль) соответствует соотношению их коэффициентов в уравнении. Если С стало на 2 моль больше (5 из 3), то количество А и В уменьшились на 1 моль каждое. В результате при установлении равновесия стало 5 моль С, по 2 моль А и В.
К = [С] 2 / ([А][В]) = 25/2∙2 = 6,25
Мольное соотношение то же, примем за х число молей прореагировавших А и В (они одинаковы):
Ответ: Мольные доли веществ в равновесной смеси:
(А) = (3-1,115)/6 = 0,314 ;
(В) = (2-1,115)/6 = 0,148 ;
Задача 12. Константа равновесия реакции N2 + 3H2 ↔ 2NH3 равна 0,1 (при 400 o С). Равновесные концентрации [Н2] = 0,2 моль/л и [NН3] = 0,08 моль/л. Вычислить начальную и равновесную концентрации азота.
Записываем выражение для константы равновесия К:
K = ([ NH 3 ]2/ ([ N 2 ]∙[ H 2 ]3)
Подставляем в выражение для К данные задачи:
0,1 = (0,082/ ([ N 2 ]∙0,23)
Отсюда рассчитываем равновесную концентрацию
Далее находим начальную концентрацию азота, учитывая, что из одного моль азота согласно уравнению реакции образуется 2 моль аммиака, т. е. для получения 0,08 моль аммиака требуется 0,04 моль азота. Таким образом, начальная концентрация азота
[ N 2 ] = 8 + 0,04 =8,04 моль/л.
Ответ: Равновесная концентрация азота 8 моль/л, начальная – 8,04 моль/л.
Задача 13. Некоторая реакция при 0 o С протекает практически до конца за 4,5 часа ( ∼ 16384 с = 214 с). При какой температуре реакция пройдет практически до конца в 1 с (температурный коэффициент скорости равен 2).
Подставляем данные задачи в формулу (1.5):

находим t2/10 = 14. Отсюда: t2 = 140 o С.
Ответ: t2 = 140 o С.
Задача 14 . Во сколько раз увеличится скорость реакции, протекающей при 300 К, если энергию активации уменьшить на 7 кДж/моль.
Воспользуемся уравнением (1.6). Запишем его для двух скоростей реакций при двух разных энергиях активации, отличающихся на 7 кДж, и поделим одно на другое:
Ответ: В 16,6 раза.
Задача 15. При 37 o С реакция заканчивается за 150 с, а при 47 o C – за 75 с. Вычислить энергию активации.
Найдем энергию активации по формуле (1.7).

Ответ: 57,1 кДж / моль.
5 ЗАДАЧИ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ
1. Окисление серы и ее диоксида протекает по уравнениям:
б) 2SO2(г) + О2 = 2SO3(г).
Как изменятся скорости этих реакций, если объемы каждой из систем уменьшить в четыре раза?
2. Напишите выражение для константы равновесия гомогенной системы: N2+3H2↔2NH3. Как изменится скорость прямой реакции – образования аммиака, если увеличить концентрацию водорода в три раза?
3. Реакция идет по уравнению N2 + O2 = 2NO. Концентрации исходных веществ до начала реакции были: 

Ответ: [N2] = 0,0465 моль/л; [O2]= 0,0075 моль/л.
4. Реакция идет по уравнению N2+3H2=2NH3. Концентрации участвующих в ней веществ были: 


Ответ: [NH3] = 0,70 моль/л; [H2] = 0,60 моль/л.
5. Реакция идет по уравнению H2 + I2 = 2HI. Константа скорости этой реакции при некоторой температуре равна 0,16. Исходные концентрации реагирующих веществ: 

Ответ: 3,2 · 10-4; 1,92 · 10-4.
6. Вычислите, во сколько раз уменьшится скорость реакции, протекающей в газовой фазе, если понизить температуру от 120 до 80 оС. Температурный коэффициент скорости реакции 3.
7. Как изменится скорость реакции, протекающей в газовой фазе, при повышении температуры на 60 оС, если температурный коэффициент скорости данной реакции 2?
8. Во сколько раз изменится скорость реакции, протекающей в газовой фазе, при понижении температуры на 300 o С, если температурный коэффициент скорости данной реакции 2?
9. В гомогенной системе СО + Cl2 ↔ COCl2 равновесные концентрации реагирующих веществ: [CO] = 0,2 моль/л; [Cl2] = 0,3 моль/л; [COCl2] = 1,2 моль/л. Вычислите константу равновесия системы и исходные концентрации хлора и СО.
Ответ: К = 20; 

10. В гомогенной системе А + 2В С равновесные концентрации реагирующих газов: [A] = 0,06 моль/л; [B] = 0,12 моль/л; [C] = 0,216 моль/л. Вычислите константу равновесия системы и исходные концентрации веществ А и В.
Ответ: К = 250; 

11. В гомогенной газовой системе А + B↔C + D равновесие установилось при концентрациях: [B] = 0,05 моль/л и [C] = 0,02 моль/л. Константа равновесия системы равна 0,04. Вычислите исходные концентрации веществ А и В.
Ответ: 

12. Константа скорости реакции разложения N2O, протекающей по уравнению 2N2O = 2N2 + O2, равна 5 · 10-4. Начальная концентрация N2O = 6,0 моль/л. Вычислите начальную скорость реакции и ее скорость, когда разложится 50% N2O.
Ответ: 1,8 ·10-2; 4,5 · 10-3.
13. Напишите выражение для константы равновесия гетерогенной системы СО2 + С ↔ 2СО. Как изменится скорость прямой реакции – образования СО, если концентрацию СО2 уменьшить в четыре раза? Как следует изменить давление, чтобы повысить выход СО?
14. Напишите выражение для константы равновесия гетерогенной системы С + Н2О(г) ↔ СО + Н2. Как следует изменить концентрацию и давление, чтобы сместить равновесие в сторону обратной реакции – образования водяных паров?
15. Равновесие гомогенной системы: 4НСl(г) + О2 ↔ 2Н2О(г) + 2Cl2(г) установилось при следующих концентрациях реагирующих веществ: [H2O] = 0,14 моль/л; [Cl2] = 0,14 моль/л; [HCl] = 0,20 моль/л; [O2] = 0,32 моль/л. Вычислите исходные концентрации хлороводорода и кислорода.
Ответ: [HCl]исх = 0,48 моль/л; [O2]исх = 0,39 моль/л.
16. Вычислите константу равновесия для гомогенной системы: CO(г) + H2O(г) ↔ CO2(г)+H2(г), если равновесные концентрации реагирующих веществ: [CO] = 0,004 моль/л; [H2O] = 0,064 моль/л; [CO2] = =0,016 моль/л; [H2] = 0,016 моль/л. Чему равны исходные концентрации воды и СО? Ответ: К = 1; = 0,08 моль/л; =0,02 моль/л.
17. Константа равновесия гомогенной системы СО(г) + Н2О(г) ↔ СО2 + Н2(г) при некоторой температуре равна 1. Вычислите равновесные концентрации всех реагирующих веществ, если исходные концентрации: С CO = 0,10 моль/л; 
Ответ: [CO2] = [H2] = 0,08 моль/л; [CO] = 0,02 моль/л.; [H2O] = =0,32 моль/л.
18. Константа равновесия гомогенной системы N2 + 3H2↔2NH3 при некоторой температуре равна 1. Равновесные концентрации водорода и аммиака соответственно равны 0,2 и 0,08 моль/л. Вычислите равновесную и исходную концентрацию азота.
Ответ: [N2] = 8 моль/л; 
19. При некоторой температуре равновесие гомогенной системы: 2NO + O2 ↔ 2NO2 установилось при следующих концентрациях реагирующих веществ: [NO] = 0,2 моль/л; [O2] = 0,1 моль/л; [NO2] = 0,1 моль/л. Вычислите константу равновесия и исходную концентрацию NO и О2.
Ответ: К = 2,5; 

20. Почему при изменении давления смещается равновесие системы: N2 + 3H2 ↔ 2NH3 и не смещается равновесие системы N2 + O2 ↔2NO? Ответ мотивируйте на основании расчета скорости прямой и обратной реакции в этих системах до, и после изменения давления. Напишите выражения для констант равновесия каждой из данных систем.
21. Исходные концентрации в гомогенной системе:
2NO + Cl2 ↔ 2NOCl составляют соответственно 0,5 и 0,2 моль/л. Вычислите константу равновесия, если к моменту наступления равновесия прореагировало 20 % NO.
22. Во сколько раз изменится скорость реакции 2А + В↔А2В, если концентрацию вещества А увеличить в 2 раза, а концентрацию вещества В уменьшить в два раза?
Ответ: возрастает в 2 раза.
23. Через некоторое время после начала реакции 3A + B↔2C + D концентрации веществ составляли: [А] = 0,03 моль/л; [В] = 0,01 моль/л; [С] = 0,008 моль/л. Каковы исходные концентрации веществ А и В?
Ответ: СА = 0,042 моль/л; СВ = 0,014 моль/л.
24. В системе СО + Cl2↔СОCl2 концентрацию СО увеличили от 0,03 до 0,12 моль/л, а концентрацию хлора – от 0,02 до 0,06 моль/л. Во сколько раз возросла скорость прямой реакции?
25. Как изменится скорость реакции 2NO(г) + О2(г) ↔2NO2(г), если:
а) увеличить давление в системе в 3 раза;
б) уменьшить объём системы в 3 раза;
в) повысить концентрацию NO в 3 раза?
Ответ мотивируйте на основании расчета скорости прямой реакции до и после изменения условий.
26. Чему равен температурный коэффициент скорости реакции, если при увеличении температуры на 30 градусов скорость реакции возрастает в 15,6 раза?
27. Температурный коэффициент скорости некоторой реакции равен 2,3. Во сколько раз увеличится скорость этой реакции, если повысить температуру на 25 градусов?
28. Равновесие в системе Н2(г) + I2(г) ↔ 2 НI(г) установилось при следующих концентрациях: [H2] = 0,025 моль/л; [I2] = 0,005 моль/л; [HI] = 0,09 моль/л. Определить исходные концентрации йода и водорода.
Ответ: 

Видео:Скорость реакции. Химия – ПростоСкачать

Начальная скорость гомогенной химической реакции c2cl4 cl2 c2cl6 описывается уравнением
Для большинства сложных реакций, включающих несколько элементарных стадий, кинетические уравнения обычно настолько сложны, что их можно точно решить только численным интегрированием. В то же время, разные константы скорости, входящие в эти уравнения, отличаются друг от друга во много раз, что позволяет при решении кинетических уравнений использовать приближенные методы.
Мы рассмотрим два основных метода — метод квазистационарных (иногда просто — стационарных) концентраций и квазиравновесное приближение — на примере кинетической схемы:
1. Приближение квазистационарных концентраций применяют в том случае, когда в ходе реакции образуются неустойчивые промежуточные вещества. Если скорость распада этих веществ намного превышает скорость их образования, то концентрация веществ в любой момент времени мала. Раз мала концентрация, то мала и скорость ее изменения, которую приближенно принимают равной 0. Условие квазистационарности позволяет выражать концентрацию промежуточных веществ через концентрации исходных веществ и тем самым упрощать кинетические уравнения.
Для приведенной выше схемы система кинетических уравнений имеет вид:
Если k2 >> k1, то B — неустойчивое промежуточное вещество, концентрацию которого можно считать квазистационарной:
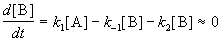
откуда 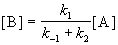
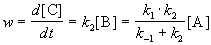
Таким образом, мы выразили скорость реакции через концентрацию исходного вещества, установили порядок реакции (первый) и выразили эффективную константу скорости через константы скорости отдельных элементарных реакций.
Приближение квазистационарных концентраций обычно применяется к реакциям с участием свободных радикалов, которые представляют собой реакционноспособные неустойчивые частицы.
2. Квазиравновесное приближение применяют в том случае, когда одна из реакций — обратимая, причем равновесие быстро устанавливается и медленно разрушается. Для приведенной выше схемы это означает, что k2 . + H . + M (k1)
H . + п-H2 
H . + H . + M 
Используя метод стационарных концентраций, получите выражение для скорости конверсии пара-водорода.
Решение. Из второго уравнения следует, что скорость образования орто-водорода равна:
Для того, чтобы решить задачу, надо исключить из этого выражения концентрацию неустойчивого вещества — атомов водорода. Это можно сделать, приняв, что она не изменяется со временем:
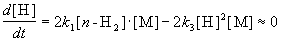
откуда 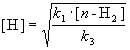
При оценке скорости изменения концентрации [H] мы учли, что в первой и третьей реакциях образуются и расходуются по два атома H, а во второй реакции число атомов H не изменяется. Подставляя концентрацию [H] в выражение для скорости реакции, получаем окончательный результат:
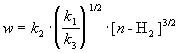
Из этого результата мы видим, как в сложной реакции может получиться дробный порядок.
Пример 6-2. Механизм ренатурации ДНК из двух ветвей спирали имеет вид:
Предполагая, что первая стадия — быстрая, а вторая — медленная, выведите уравнение для скорости образования устойчивой двойной спирали и выразите общую константу скорости реакции через константы скорости элементарных стадий.
Решение. Условия задачи позволяют применить квазиравновесное приближение. Концентрация неустойчивой двойной спирали в этом приближении равна:
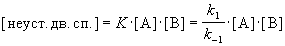
Скорость реакции определяется скоростью второй стадии:
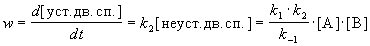
Образование устойчивой двойной спирали ДНК — реакция второго порядка с эффективной константой скорости k = k1 . k2 / k-1.
6-1. Механизм некоторой ферментативной реакции имеет вид:
Используя метод квазистационарных концентраций для комплекса фермента с субстратом, выразите скорость образования продукта через текущие концентрации фермента, субстрата и продукта.(ответ)
6-2. Для реакции NO2Cl 
NO2Cl 
NO2Cl + Cl . 
Используя метод квазистационарных концентраций, выведите уравнение для скорости разложения NO2Cl.(ответ)
6-3. Для реакции синтеза иодоводорода из простых веществ H2 + I2 
I2 
2I . 
2I . + H2 
Используя квазиравновесное приближение, выведите уравнение для скорости образования HI и покажите, что данная реакция имеет второй порядок.(ответ)
6-4. В одной из теорий мономолекулярных реакций предложен следующий механизм активации молекул (схема Линдемана):
активация: A + A 
дезактивация: A + A* 
распад: A* 
Используя метод квазистационарных концентраций, выведите уравнение для скорости мономолекулярной реакции и определите порядок реакции при больших и малых концентрациях [A].(ответ)
6-5. Для тримолекулярной реакции 2NO + O2 
2NO 
(NO)2 + O2 
Определите порядок суммарной реакции, предполагая, что первая стадия — быстрая, а вторая — медленная.(ответ)
6-6. Конденсация ацетона (CH3)2CO в водном растворе катализируется основаниями, которые обратимо реагируют с ним с образованием карбаниона C3H5O — . Карбанион реагирует с молекулой ацетона и дает продукт реакции. Упрощенный механизм выглядит так:
AH + B 
A — + BH + 
A — + AH 
Используя метод стационарных концентраций, найдите концентрацию карбаниона и выведите уравнение для скорости образования продукта.(ответ)
6-7. Составьте кинетические уравнения для следующего механизма газофазной реакции:
A 

Определите скорость образования продукта в приближении квазистационарных концентраций. Покажите, что при высоких давлениях реакция может протекать по первому порядку, а при низких давлениях — по второму порядку.(ответ)
6-8. Химическая реакция N2O 
N2O + M 
N2O* 
N2O* + M 
N2O + O . 
Считая концентрации N2O* и O . стационарными, найдите выражение для скорости распада N2O.(ответ)
6-9. Составьте кинетическое уравнение для скорости разложения оксида азота (V) по суммарному уравнению 2N2O5(г) 
N2O5 
NO2 + NO3 
NO2 + NO3 
NO + N2O5 
6-10. Составьте кинетическое уравнение для скорости разложения оксида азота (V) по суммарному уравнению 2N2O5(г) 
N2O5 
NO2 + NO3 
NO2 + NO3 
NO + NO3 
Указание. Интермедиаты — NO и NO3.(ответ)
6-11. Дана схема цепной реакции:
AH 
A . 
AH + B . 
A . + B . 
Назовите стадии зарождения, развития и обрыва цепи. Используя метод квазистационарных концентраций, покажите, что образование продукта P описывается кинетическим уравнением первого порядка.(ответ)
6-12. Дана кинетическая схема:
CH4 + M 
CH3 . + CH4 
H . + CH4 
H . + CH3 . + M 
(M — инертная молекула). Используя метод квазистационарных концентраций, выразите скорость образования этана через концентрацию метана.(ответ)
6-13. Реакция разложения бромметана 2CH3Br 
CH3Br 
CH3 . + CH3Br 
Br . + CH3Br 
2CH3 . 
Используя метод стационарных концентраций, найдите выражение для скорости образования этана.(ответ)
6-14. Термическое разложение углеводорода R2 протекает по следующему механизму:
R2 
R . + R2 
R’ . 
2R . 
где R2, PA, PB — устойчивые углеводороды, R . и R’ . — радикалы. Найдите зависимость скорости разложения R2 от концентрации R2.(ответ)
6-15. Дана кинетическая схема разложения ацетальдегида:
CH3CHO 
CH3 . + CH3CHO 
CH2CHO . 
CH3 . + CH3 . 
Используя приближение стационарных концентраций, получите выражение для скорости образования метана и скорости расходования ацетальдегида.(ответ)
6-16. Реакцию радикального дегидрирования этана можно описать с помощью механизма Райса-Герцфельда, который включает следующие стадии:
инициирование: CH3CH3 
развитие цепи: CH3 . + CH3CH3 
CH3CH2 . 
H . + CH3CH3 
обрыв цепи: H . + CH3CH2 . 
Найдите уравнение для скорости образования этилена, если константа k1 мала. Как можно изменить условия, чтобы изменился порядок?(ответ)
6-17. Дана кинетическая схема дегидрирования этана:
C2H6 
CH3 . + C2H6 
C2H5 . 
H . + C2H5 . 
Используя приближение стационарных концентраций, получите выражение для скорости образования этилена.(ответ)
6-18. Химическая реакция 2C2H6 
C2H6 
H . + C2H6 
C2H5 . + C2H6 
2C2H5 . 
Используя метод стационарных концентраций, получите выражение для скорости образования бутана.(ответ)
6-19. Дана кинетическая схема радикального хлорирования тетрахлорэтилена в растворе CCl4:
Cl2 
Cl . + C2Cl4 
C2Cl5 . + Cl2 
2C2Cl5 . 
Используя приближение стационарных концентраций, получите выражение для скорости образования гексахлорэтана.(ответ)
6-20. Реакция образования фосгена CO + Cl2 
Cl2 
2Cl . 
CO + Cl . 
COCl . 
COCl . + Cl2 
Используя метод стационарных концентраций, найдите выражение для скорости образования фосгена.(ответ)


Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору
🎥 Видео
Скорость химической реакции. Практическая часть. 10 класс.Скачать

Урок № 2. Скорость химических реакций. Химическое равновесиеСкачать

Скорость химической реакции. 10 класс.Скачать

Все о скорости химической реакции | Химия ЕГЭ 10 класс | УмскулСкачать

Все типы задания 18. Скорость реакции | Химия ЕГЭ 2023 | УмскулСкачать

Химическая кинетика. Формальная кинетика простых гомогенных реакций в закрытых системахСкачать

Химия 9 класс (Урок№3 - Скорость химических реакций. Первоначальные представления о катализе.)Скачать

80. Скорость химической реакции (часть 1)Скачать

Химия | Cкорость химической реакцииСкачать

Влияние концентрации реагирующих веществ на скорость химической реакции. Опыт 1Скачать

влияние концентрации реагирующих веществ на скорость химической реакцииСкачать