2 NaBr + 2 H2SO4(конц) = Br2 + SO2 + Na2SO4 + 2 H2O
8 KI + 5 H2SO4(конц) = 4 I2 + H2S + 4 K2SO4 + 4 H2O.
Домашний эксперимент на тему «Окислительно-восстановительные реакции».
Цель работы: предварительная подготовка к изучению коррозии, закрепление материала.
Опыт 1. Действие некоторых веществ на скорость коррозии металлов.
Три гвоздика положите в три маленькие пробирочки. Пробирки вверх дном опустите во флаконы, в которые налейте по 2 мл воды, раствора хлорида натрия и добавьте каплю йодной настойки. Через двое суток отметьте, какие произошли изменения с гвоздями. Которые из них наиболее сильно разрушились? Одинаков ли внешний вид продуктов коррозии? Какие еще произошли изменения в пробирках? Напишите уравнение реакции.
Почему нельзя хранить в химическом кабинете в одном и том же шкафу металлическое оборудование вместе с йодом, растворами кислот и солей?
Почему сельскохозяйственную технику (тракторы, комбайны) не рекомендуется хранить под открытым небом?
Цель работы: закрепление, совершенствование и углубление знаний и умений учащихся по электролизу.
Опыт 2. Электролиз раствора хлорида натрия.
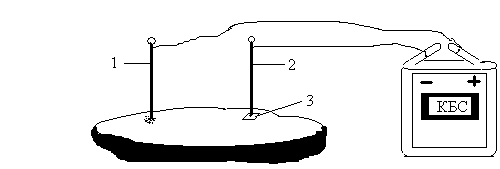
Соедините провода с полюсами батарейки от карманного фонаря. Провод-анод вставьте в свежий срез клубня картофеля (среда, в которой распределяется раствор соли). Провод-катод с укрепленными на нем гвоздиком также вставьте в срез картофеля на расстоянии 1,5-2 см от первого электрода. На срез картофеля нанесите3-4 капли раствора хлорида натрия. У гвоздика поместите маленький кусочек фенолфталеиновой бумажки (рис.3). В таком положении оставьте установку на 15-20 минут. Какие происходят изменения на срезе картофеля? Чем объяснить эти изменения? Напишите уравнение реакции.
Рис.3. Электролиз раствора хлорида натрия: 1 – раствор хлорида натрия; 2 – фенолфталеиновая бумажка.
Опыт 3. Электролиз раствора хлорида натрия с применением бумажной диафрагмы.
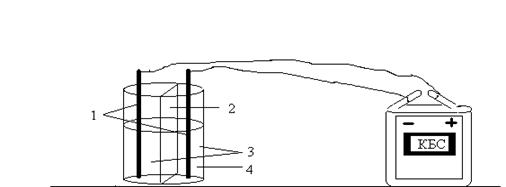 |
В сосуд налейте раствор поваренной соли и разгородите сосуд бумажной перегородкой. Соедините графитовые стержни карандаша проводами с батарейкой. В катодное пространство опустите кусочек фенолфталеиновой бумажки (рис.4) и наблюдайте за происходящими изменениями. Как изменяется окраска жидкости в катодном пространстве? Какой газ выделяется па поверхности катода? Определите по запаху выделяющийся у анода газ. Напишите уравнение реакции.
Рис.4. Электролиз раствора хлорида натрия с применением бумажной диафрагмы: 1 – стержни от карандаша; 2 – бумажная перегородка; 3 – раствор хлорида натрия; 4 – раствор фенолфталеина.
Опыт 4. Электролиз раствора хлорида натрия с применением пористой перегородки.
В стакане приготовьте 70-80 ìë раствора хлорида натрия. Тщательно вымойте яичную скорлупу, заполните ее на 3/4 раствором и опустите осторожно в стакан. В стакан и скорлупу на поверхности растворов опустите по кусочку фенолфталеиновой бумажки. Соедините графитовые стержни с проводами. Один стержень опустите в яйцо, второй — в стакан. Электроды (стержни с проводами) соедините с батарейкой (рис.5). Оставьте в таком положении установку на 35-40 мин. Раствор какого вещества образуется внутри скорлупы? Что образуется в анодном пространстве? Напишите уравнение реакции.
Рис.5. Электролиз раствора хлорида натрия с применением пористой перегородки: 1 – графитовые стержни; 2 – раствор хлорида натрия; 3 – раствор фенолфталеина. Напишите уравнение реакции.
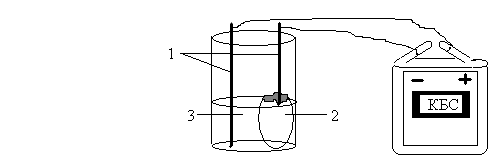
Опыт 5. Электролиз раствора хлорида натрия в соленом огурце.
В срез соленого огурца вставьте кусочек медной проволоки и железный гвоздь. Медную проволочку соедините со знаком «+» батарейки, гвоздик — со знаком «-«. У гвоздика на срез поместите кусочек фенолфталеиновой бумажки (Рис.6). Через 10-15 минут проследите за происходящими изменениями на срезе огурца.
Рис.6. Электролиз раствора хлорида натрия в соленом огурце: 1 – медный электрод; 2 – железный электрод; 3 – фенолфталеиновая бумажка.
Цель работы: закрепление знаний и умений учащихся по окислительно-восстановительным реакциям.
Опыт 6. Горение сахара.
Измельченным чаем, который содержит растворимые соли лития (катализатор), посыпьте один из уголков кусочка сахара. Если чай плохо пристает к поверхности сахара, смочите его немного водой. Спичкой подожгите эту часть кусочка сахара. Каким пламенем он горит? Напишите уравнение реакции.
Во флаконе раздавите 3-4 ягоды смородины, налейте 1-2 мл воды, прилейте 1 мл раствора пероксида водорода и все это перемешайте. Какие происходят изменения в сосуде? Напишите уравнения реакции.
Практическая работа: «Окислительно-восстановительные реакции».
Цель: развивать умения работы с веществами и оборудованием, умение применять теоретические знания для объяснения наблюдаемых явлений.
Оборудование: на столах учащихся пробирки, растворы K2SO3, KMnO4, KOH, HCl, CuSO4, KI, Н2SO4, гранулы цинка, алюминия, медная проволока.
Опыт 1. В 3 пробирки налейте раствор KMnO4, в первую добавьте раствор Н2SO4, во вторую – KOH, во все пробирки прилейте раствор K2SO3 до появления изменений. Запишите уравнения реакций, расставьте коэффициенты методом электронного баланса.
Опыт 2. В раствор HCl и CuSO4 положите гранулы алюминия. Запишите свои наблюдения, составьте уравнения реакций. Укажите причину протекания этих реакций.
Опыт 3. В две пробирки поместите гранулы цинка, прилейте соляную кислоту, к одной из гранул прикоснитесь медной проволокой, что наблюдаете? Объясните эти явления. Запишите процессы, происходящие при контакте меди с цинком.
Опыт 4. К раствору CuSO4 прилейте раствор KI. Что наблюдаете? Составьте уравнение реакции, если один из продуктов йодид меди (I).
Сделайте вывод по работе.
Результаты анкетирования экспериментального класса:
Видео:СЕРНАЯ КИСЛОТА разбавленная и концентрированная - в чем отличия? | Химия ОГЭСкачать

Бромид натрия: способы получения и химические свойства
Бромид натрия — NaBr соль щелочного металла натрия и бромоводородной кислоты. Белое кристаллическое вещество. Плавится без разложения. Хорошо растворяется в воде (гидролиза нет).
Относительная молекулярная масса Mr = 102,89; относительная плотность для тв. и ж. состояния d = 3,211; tпл = 755º C
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Способ получения
1. Бромид натрия можно получить путем взаимодействия концентрированного и холодного гидроксида натрия и брома, образуются гипобромит натрия, бромид натрия и вода:
2NaOH + Br2 = NaBrO + NaBr + H2O,
при взаимодействии брома с концентрированным и горячим гидроксидом натрия образуется бромат натрия, бромид натрия и вода:
6NaOH + 3Br2 = NaBrO3 + 5NaBr + 3H2O
2. При температуре 150–200º C, в результате взаимодействия натрия и брома, образуется бромид натрия:
2Na + Br2 = 2NaBr
3. Холодный йодид натрия реагирует с бромом . При этом образуются бромид натрия и осадок йод:
2NaI + Br2 = 2NaBr + I2↓
Видео:ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

Качественная реакция
Качественная реакция на бромид натрия — взаимодействие с нитратом серебра, в результате реакции происходит образование осадка бледно — желтого цвета:
1. При взаимодействии с нитратом серебра , бромид натрия образует нитрат натрия и осадок бромид серебра:
NaBr + AgNO3 = NaNO3 + AgBr↓
Видео:Химическая реакция KI с H2SO4 и NaNO2Скачать

Химические свойства
1. Бромид натрия вступает в реакцию с простыми веществами :
1.1. Горячий бромид натрия взаимодействует с хлором. В результате реакции происходит образование хлорида натрия и газа брома:
2NaBr + Cl2 = 2NaCl + Br2↑
2. Бромид натрия способен вступать в реакцию со сложными веществами :
2.1. Бромид натрия реагирует с кислотами :
2.1.1. Твердый бромид натрия реагирует с холодной серной кислотой с концен трацией 10–50% . Взаимодействие данных веществ приводит к образованию сульфата натрия и бромоводородной кислоты:
Если концентрацию горячей серной кислоты поднять выше 50 %, то в результате реакции образуется гидросульфат натрия, бром, оксид серы (IV) и вода:
Видео:Решение цепочек превращений по химииСкачать

Используя метод электронного баланса, составьте уравнения реакций Определите окислитель и восстановитель NaBr + NaBrO3 + H2SO4 →
Видео:8 класс. ОВР. Окислительно-восстановительные реакции.Скачать

Ваш ответ
Видео:Химическая реакция KI с H2SO4 и H2O2Скачать

решение вопроса
Видео:ЭТОТ метод поможет на уроках ХИМИИ / Химия 9 классСкачать

Похожие вопросы
- Все категории
- экономические 43,293
- гуманитарные 33,622
- юридические 17,900
- школьный раздел 607,176
- разное 16,830
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
📸 Видео
Окислительно-восстановительные реакции. 1 часть. 9 класс.Скачать

Учимся составлять электронный баланс/овр/8классСкачать

Составление ур-й окислительно-восст. реакций методом ионно-электронного баланса. 1ч. 10 класс.Скачать

9 класс. Реакции ионного обмена. Ионные уравнения.Скачать

Серная кислота. Химические свойства. Реакции с металлами.Скачать

Окислительно-восстановительные реакции в кислой среде. Упрощенный подход.Скачать

Ba(NO3)2+H2SO4=BaSO4+HNO3 Ионное и молекулярное уравнения реакции, демонстрация.Скачать

89. Как расставить коэффициенты реакции методом электронного баланса (закрепление)Скачать

Качественные реакции на хлорид-, бромид- и йодид-ионыСкачать

Реакция Йодида Калия, Перманганата Калия и Серной Кислоты. Выпадение Йода. Реакция KI, KMnO4 и H2SO4Скачать

Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Химическая реакция KMnO4 с H2SO4 и NaNO2Скачать