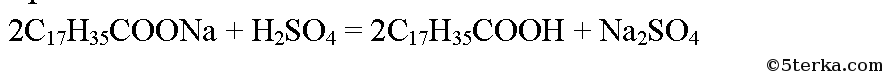Мыло представляет собой смесь натриевых солей высших карбоновых кислот. Карбоновые кислоты — слабые кислоты, поэтому серная кислота вытесняет их из солей. Для примера составим уравнение реакции между стеаратом натрия и серной кислотой:
Стеарат натрия растворим в воде, а стеариновая кислота — нет, она и всплывает на поверхность.

задача №14
к главе «Глава IX. Сложные эфиры. Жиры. §§1, 2 (стр. 122) Вопросы».
Видео:Серная кислота и ее соли. 9 класс.Скачать

Please wait.
Видео:СЕРНАЯ КИСЛОТА разбавленная и концентрированная - в чем отличия? | Химия ОГЭСкачать

We are checking your browser. gomolog.ru
Видео:Серная кислота. Химические свойства. Реакции с металлами.Скачать

Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
Видео:Взаимодействие серной кислоты с металламиСкачать

What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6e215ea60e40faa4 • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Видео:Льем воду в кислоту. Шок контент. Химия – ПростоСкачать

ХИМИЯ
мыла и моющих средств
Да здравствует мыло душистое,
И полотенце пушистое,
И зубной порошок,
И густой гребешок!
Давайте же мыться, плескаться,
Купаться, нырять, кувыркаться
И в ванне, и в бане, везде.
Вечная слава воде!
К.Чуковский
Цели и задачи. Рассмотреть состав и строение мыла и моющих средств, показать взаимосвязь строения и свойств моющих средств; закрепить навыки работы в малых группах, расширить кругозор учащихся, развить их мышление.
Оборудование и реактивы. Упаковки из-под мыла и моющих средств, информационные листы для учащихся, набор химической посуды (пробирки, спиртовки, химические стаканчики, пробиркодержатели, стеклянные палочки); жир, маргарин или сливочное масло, мыло, синтетическое моющее средство, жидкое мыло, 15%-й раствор гидроксида натрия, раствор хлорида натрия (насыщенный), разбавленный раствор серной кислоты, растворы ацетата свинца, хлорида кальция, сульфата меди, фенолфталеина, растворы, содержащие ионы кальция или магния, дистиллированная вода.
Изучение темы занимает два урока, один из которых – теоретическое занятие, второй – практическая работа.
Учащиеся работают в малых группах, рассаживаясь по периметру класса. На их столах упаковки из-под мыла и синтетических моющих средств, набор химической посуды и реактивов.
Учитель. Ребята, сегодняшнее наше занятие посвящено химии мыла и моющих средств и будет состоять из двух частей.
На первом уроке мы рассмотрим теоретические вопросы:
• мыло в древности, история мыловарения;
• строение мыла, его свойства;
• состав мыла и синтетических моющих средств;
• применение мыла и синтетических моющих средств.
На втором уроке мы проведем лабораторные опыты, подтверждающие свойства мыла и синтетических моющих средств.

«Мыло в древности, история мыловарения»
Ученик. Мыло было известно человеку до новой эры летоисчисления. Самое раннее упоминание о мыле в европейских странах встречается у римского писателя и ученого Плиния Старшего (23–79 гг.). В трактате «Естественная история» Плиний писал о способах получения мыла омылением жиров. Мало того, он писал о твердом и мягком мыле, получаемом с использованием соды и поташа соответственно.
Для мытья и стирки белья на Руси использовали щелок, получаемый при обработке золы водой, т.к. зола от сгоревшего топлива растительного происхождения содержит поташ.
Развитию мыловарения способствовало наличие сырьевых источников. Например, марсельская мыловаренная отрасль промышленности, известная с эпохи раннего средневековья, располагала оливковым маслом и содой. Мыловарение развивалось также в Италии, Греции, Испании, на Кипре, т.е. в районах, культивирующих оливковые деревья. Первые германские мыловарни были основаны в XIV столетии.
Химическая сущность мыловаренных процессов долгое время была не ясна. Лишь в конце XVIII в. была выяснена химическая природа жиров, и затем поняты реакции их омыления. В 1779 г. шведский химик К.В.Шееле показал, что при взаимодействии оливкового масла с оксидом свинца и водой образуется растворимое в воде сладкое вещество. В 1817 г. французский химик М.Э.Шеврель открыл стеариновую, пальмитиновую и олеиновую кислоты как продукты разложения жиров при их омылении водой и щелочами. Сладкое вещество, полученное Шееле, было Шеврелем названо глицерином. Сорок лет спустя французский химик П.Э.М.Бертло установил природу глицерина и объяснил химическое строение жиров.

«Строение мыла, его свойства»
Учитель. Мыла – это натриевые или калиевые соли высших жирных кислот (схема 1), гидролизующихся в водном растворе с образованием кислоты и щелочи.
Общая формула твердого мыла:
Cоли, образованные сильными основаниями щелочных металлов и слабыми карбоновыми кислотами, подвергаются гидролизу:
Образовавшаяся щелочь эмульгирует, частично разлагает жиры и освобождает таким образом прилипшую к ткани грязь. Карбоновые кислоты с водой образуют пену, которая захватывает частицы грязи. Калиевые соли по сравнению с натриевыми лучше растворимы в воде и поэтому обладают более сильным моющим свойством.
Гидрофобная часть мыла проникает в гидрофобное загрязняющее вещество, в результате поверхность каждой частицы загрязнения оказывается окруженной оболочкой гидрофильных групп. Они взаимодействуют с полярными молекулами воды. Благодаря этому ионы моющего средства вместе с загрязнением отрываются от поверхности ткани и переходят в водную среду. Так происходит очистка загрязненной поверхности моющим веществом.

Используя информационные листы (приложение) и раздаточный материал, учащиеся выполняют следующие задания.
1. Заполнить таблицу.
| Хозяйственное мыло | Туалетное мыло | Синтетическое моющее средство |
|---|
2. Ответить на вопрос: в чем преимущества использования синтетических моющих средств по сравнению с мылом?

Один из учащихся выступает в роли технолога, рассказывающего о стадиях производства мыла. Каждая группа выбирает корреспондента от средств массовой информации: журнала «Мыло», газеты «Мыльный пузырь», телекомпании «СМС».
Технолог. Производство мыла состоит из двух стадий: химической и механической. На первой стадии (варка мыла) получают водный раствор натриевых (реже калиевых) солей, жирных кислот или их заменителей.
Получение высших карбоновых кислот при крекинге и окислении нефтепродуктов:
Получение натриевых солей:
Варку мыла заканчивают обработкой мыльного раствора (мыльного клея) избытком щелочи или раствором хлорида натрия. В результате этого на поверхность раствора всплывает концентрированный слой мыла, называемый ядром. Полученное мыло называют ядровым, а процесс его выделения из раствора – отсолкой или высаливанием.
Механическая обработка заключается в охлаждении и сушке, шлифовке, отделке и упаковке готовой продукции.
В результате мыловаренного процесса мы получаем самую разнообразную продукцию, с которой вы можете ознакомиться.
Корреспондент журнала «Мыло». Стадии производства хозяйственного и туалетного мыла одинаковы или имеют различия?
Технолог. Производство хозяйственного мыла заканчивают на стадии высаливания, при этом происходит очистка мыла от белковых, красящих и механических примесей. Производство туалетного мыла проходит все стадии механической обработки. Наиболее важной из них является шлифовка, т.е. переведение ядрового мыла в раствор кипячением с горячей водой и повторным высаливанием. При этом мыло получается особо чистым и светлым.
Корреспондент газеты «Мыльный пузырь». Получают ли при производстве мыла побочные продукты и как их используют?
Технолог. Если мыло варилось из животных или растительных жиров, то из раствора после отделения ядра выделяют образующийся при омылении глицерин, который находит широкое применение: в производстве взрывчатых веществ и полимерных смол, как умягчитель ткани и кожи, при изготовлении парфюмерных, косметических и медицинских препаратов, в производстве кондитерских изделий.
Корреспондент телекомпании «СМС». В настоящее время часть мыла и синтетических моющих средств получают из нефтепродуктов. В чем заключаются технологические секреты такого производства?
Технолог. В производстве мыла применяют нафтеновые кислоты, выделяемые при очистке нефтепродуктов (бензина, керосина). С этой целью нефтепродукты обрабатывают раствором гидроксида натрия и получают водный раствор натриевых солей нафтеновых кислот. Этот раствор упаривают и обрабатывают поваренной солью, в результате чего на поверхность раствора всплывает мазеобразная масса темного цвета – мылонафт. Для очистки мылонафта его обрабатывают серной кислотой. Этот нерастворимый в воде продукт называют асидолом или асидол-мылонафтом. Непосредственно из асидола изготовляют мыло.
Работа по схеме 2.
В конце первого занятия учитель подводит итог изучения учебного материала, указывает на меры профилактики при использовании моющих средств.
Стиральные порошки могут:
• раздражать дыхательные пути;
• стимулировать проникновение в кожу ядовитых веществ;
• вызывать аллергию и дерматит кожи.
Во всех этих случаях необходимо перейти на использование мыла, единственным недостатком которого является то, что оно сушит кожу.

«Свойства мыла и синтетических моющих средств»
(Перед началом работы – инструктаж по ТБ.)
Опыт «Омыление жиров в водно-спиртовом растворе»
В пробирку поместите жир, маргарин и сливочное масло, прилейте 8–10 мл 15%-го спиртового раствора гидроксида натрия. Смесь перемешайте, нагрейте до кипения. Омыление ведите до тех пор, пока жидкость не станет однородной. К полученной густой жидкости добавьте насыщенный раствор хлорида натрия и кипятите раствор 1–2 минуты.
Задания для самостоятельных выводов
1. Какое вещество появилось на поверхности в результате проделанного опыта?
2. Напишите уравнение происходящей реакции.
3. Для каких практических целей используется процесс омыления жиров?
Опыт «Выделение жирных кислот»
В пробирку поместите кусочек твердого мыла, прилейте к нему 8–10 мл дистиллированной воды, взболтайте и подогрейте полученный раствор. К раствору мыла прилейте раствор разбавленной серной кислоты и нагрейте до кипения.
Задания для самостоятельных выводов
1. Какие изменения происходят при нагревании и охлаждении раствора?
2. Напишите уравнение происходящей реакции.
Опыт «Получение нерастворимых солей жирных кислот»
В пробирку поместите кусочек твердого мыла, прилейте к нему 8–10 мл дистиллированной воды, взболтайте и подогрейте полученный раствор. Разделите раствор по трем пробиркам, в первую добавьте раствор ацетата свинца, во вторую – раствор хлорида кальция, в третью – раствор сульфата меди.
Задания для самостоятельных выводов
1. Объясните изменения, происходящие в каждой пробирке.
2. Напишите уравнения происходящих реакций.
Опыт «Сравнение мыла и синтетических моющих средств»
Приготовьте в трех пробирках по 10 мл разбавленных растворов:
а) твердого мыла;
б) одного из синтетических порошкообразных моющих средств;
Разделите полученные растворы на две части (в каждой из них – по три пробирки).
а) В каждую из трех пробирок первой части с различными растворами добавьте по нескольку капель фенолфталеина. (Если моющее средство предназначено для хлопчатобумажных тканей, то среда бывает щелочной, а если для шелковых и шерстяных – нейтральной.)
б) В три оставшиеся пробирки второй части с растворами мыла и синтетических моющих средств добавьте при встряхивании по 2–3 мл воды, содержащей ионы Са 2+ и Mg 2+ .
Задания для самостоятельных выводов
1. Почему раствор мыла имеет щелочную среду? Ответ поясните уравнением реакции.
2. Какое из указанных выше моющих средств следует использовать для стирки:
а) хлопчатобумажных тканей;
б) шелковых и шерстяных тканей;
в) в жесткой воде?
По окончании занятия учитель подводит итог работы на уроке, кратко повторяя его основные этапы.
ПРИЛОЖЕНИЕ
Животные жиры – древнее и весьма ценное сырье мыловаренной отрасли промышленности. Они содержат до 40% насыщенных жирных кислот.
Синтетические жирные кислоты получают из парафина нефтей каталитическим окислением кислородом воздуха:
При производстве мыла используют две фракции: С10–С16 и С17–С20. В хозяйственном мыле синтетических кислот 35–40%.
В производстве мыла используют канифоль, получаемую при переработке живицы хвойных деревьев. Канифоль состоит из смеси смоляных кислот, содержащих в цепи около 20 углеродных атомов. В рецептуру хозяйственного мыла вводят 12–15% канифоли от массы жирных кислот, а в рецептуру туалетных мыл – не более 10%. Введение канифоли делает мыло мягким и липким.
Содержание воды в хозяйственном мыле достигает 30%, а в туалетном снижается до 12%. В состав мыла вводят парфюмерные отдушки, отбеливатели, красители. Хорошие сорта туалетного мыла содержат до 50% натурального кокосового или пальмового масла, которое хорошо растворяется в холодной воде и характеризуется высоким пенообразованием.
Для улучшения характеристик хозяйственного и туалетного мыла, а также для его удешевления в него вводят наполнители. К ним относятся натриевые соли, казеин и крахмал. Казеин и крахмал используются для пенообразования и стойкости пены. Основным наполнителем туалетного мыла является сапонин, получаемый выщелачиванием некоторых растений.
При стирке белья в жесткой воде, содержащей ионы кальция и магния, расход мыла повышается на 25–30%. Малорастворимые соли кальция и магния оседают на ткани, делая ее грубой, менее эластичной, блеклой, снижают ее прочность.
Для устранения вредных последствий жесткой воды в мыло вводят декаоксотрифосфат(V) натрия Na5P3O10. Ионы P3O10 5– связывают ионы кальция и магния в прочные нерастворимые соединения. По существу они играют роль смягчителя воды. С этой же целью Na5P3O10 добавляют и в стиральные порошки в объеме до 20%.
Основой синтетических моющих средств (детергентов) является Na-cоль алкансульфокислоты,
доля которой достигает 30%.
Общая формула синтетических моющих средств:
Производство этих веществ основано на продуктах переработки нефти.
Синтетические моющие средства – сложная композиция, содержащая отбеливатели (ультрамарин, перборат натрия) и пенообразователи (аминоспирты). Они одинаково хорошо моют как в мягкой, так и в жесткой воде.
В то же время детергенты очень медленно подвергаются биоразложению. Накапливаясь в водоемах, они ведут к сильному разрастанию зеленых растений, что вызывает заболачивание.
🔥 Видео
Взаимодействие сахара с концентрированной серной кислотойСкачать

СЕРНАЯ КИСЛОТА | H2SO4 | Химические свойства разбавленной и концентрированной СЕРНОЙ КИСЛОТЫ | ХимияСкачать

Серная кислота и металлы за 10 минут | ХИМИЯ ЕГЭ | СОТКАСкачать

Получение угольной пены - Реакция сахара и серной кислоты!Скачать

Сложные эфиры и мыла. 1 часть. 11 класс.Скачать

Изучаем химические свойства концентрированной серной кислоты!Скачать

Взаимодействие серы с конц. серной кислотойСкачать

Реакция взаимодействия цинка и серной кислоты | Zn + H2SO4 → ZnSO4 + H2Скачать

Серная кислота. Химические свойства. Взаимодействие с НЕметаллами.Скачать

Перекись водорода H2O2 + серная кислота H2S04 Потребляет практически любые органические вещества!Скачать

Реакция Концентрированной Серной Кислоты и Хлората Натрия. Реакция H2SO4 и NaClO3. Выделение ClO2.Скачать

Опасно для здоровья! ⚠️ Опыты с серной кислотойСкачать

ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать

ОВР с серной и азотной кислотами.Скачать
распознавание растворов соляной, азотной и серной кислотСкачать