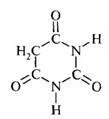
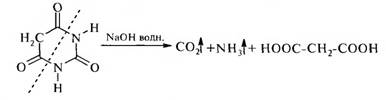
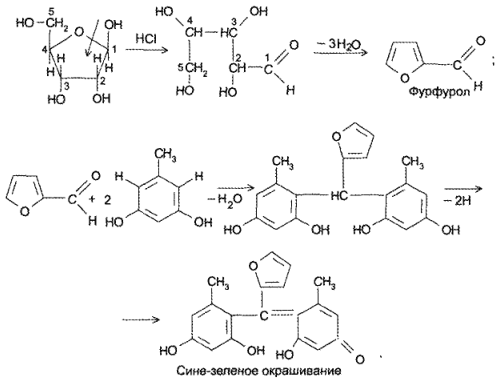
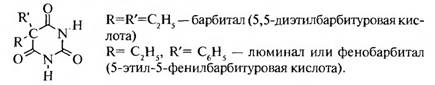Важнейшее производное пиримидина. Этоциклический уреидмалоновой кислоты, малонил- мочевина. Представляет собой бесцветное кристал лическое вещество, легко растворяется в теплой воде, трудно в холодной. В результате щелочногогидролиза барбитуровая кислота разлагается, обра зуямалоновую кислоту, NH, и С02. Эта реакциясвидетельствует о неароматическом характере соединения.
Группа -СН2 в положении 5 обладает высокой реакционной способностью. Метиленовая группа в барбитуровой кислоте фланкирована с обеих сторон кетогруппами, которые повышают подвижность атомов водорода.
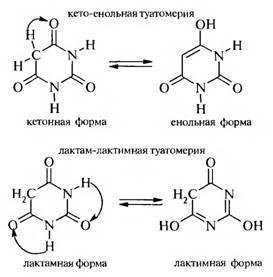
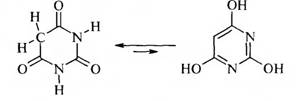
Барбитуровая кислота — это таутомерное вещество. Для нее характерны два вида таутомерии: кето-енольная и лактам-лактимная.
Таким образом, барбитуровая кислота существует в двух таутомерных формах: триоксо-форме и тригидрокси-форме.
Говоря о барбитуровой кислоте, следует отметить, что она в 5—6 раз сильнее, чем уксусная. Кислотность барбитуровой кислоты обусловлена существованием подвижных атомов водорода в 5 положении. Если один из атомов водорода замешен на радикал, то сила кислоты несколько уменьшается, при замене же двух атомов водорода сила кислоты резко снижается.
Используя в качестве исходных продуктов производные малоновой кислоты, можно получить реакцией конденсации с мочевиной целый ряд фармацевтических препаратов.
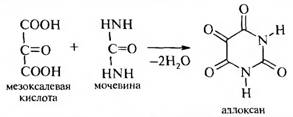
К производным пиримидина следует отнести аллоксан, который получается при конденсации мезоксалевой кислоты и мочевины.
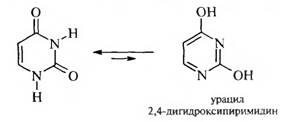
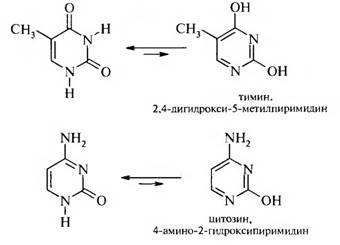
Важными производными пиримидина являются пиримидиновые основания, которые входят в состав нуклеиновых кислот:
Пурин и его производные
Группа пурина включает природные продукты, не менее важные для физиологии животных и растений, чем моносахариды или аминокислоты.
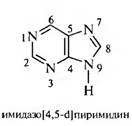
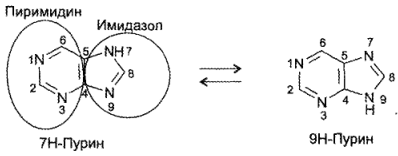
ПУРИН
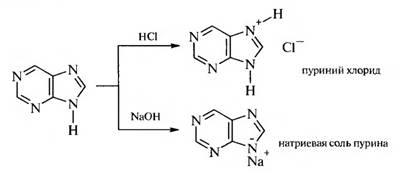
Пурин — бициклическая система, состоящая из пиримидинового и имидазольного колеи. Пурин представляет собой бесцветное кристаллическое вещество нейтрального характера, легко растворимое в воде. Образует соли как с кислотами, так и со щелочами, обладает ароматическим характером. Амфотерность пурина связана с наличием в его структуре имидазольного ядра.
Слабые кислотные свойства пурин проявляет за счет атома азота пиррольного типа, а основные — за счет атома азота пиридинового типа в имидазольном фрагменте молекулы.
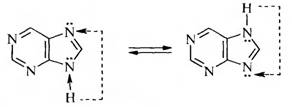
Как и для имидазола, для пурина характерна азольная таутомерия:
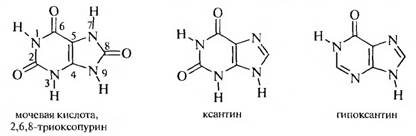
Важнейшими производными пурина являются оксо- и аминопроизводные. К оксопуринам относятся мочевая кислота, ксантин и гипоксантин.
В нормальной моче человека и животных содержится незначительное количество мочевой кислоты. Основным продуктом азотистого обмена является мочевина. При некоторых заболеваниях, в частности при подагре (откладывание мочевой кислоты в виде Na солей в суставах), увеличивается количество мочевой кислоты. У птиц и змей мочевая кислота является главной составной частью экскрементов (у змей до 90%).
Мочевая кислота — бесцветное кристаллическое вещество, труднорастворимое в воде, не растворимое в С2Н5ОН и эфире. Мочевая кислота очень слабая кислота; ее нельзя обнаружить при помощи обычных индикаторов, так как она не изменяет их цвет. Она образует соли с одним или двумя эквивалентами одновалентных металлов.
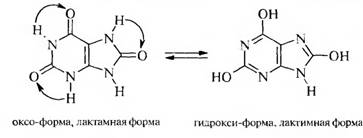
Для мочевой кислоты характерна лактам-лактимная таутомерия.
В кристаллическом состоянии мочевая кислота находится в лактамной (оксо-) форме, а в растворе между лактамной и лактимной формами устанавливается динамическое равновесие, в котором преобладает лактамная форма.
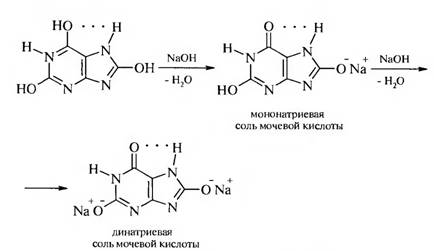
Мочевая кислота является двухосновной кислотой. Кислотные свойства мочевой кислоты определяются лактимной формой. Солеобразующими являются гидроксильные группы, находящиеся в положении 2 и 8. Как двухосновная мочевая кислота образует два ряда солей — кислые и средние.
Соли мочевой кислоты называются уратами. Средние соли хорошо растворимы в воде, из кислых наиболее растворим урат лития. Поэтому для лечения подагры применяют соли лития.
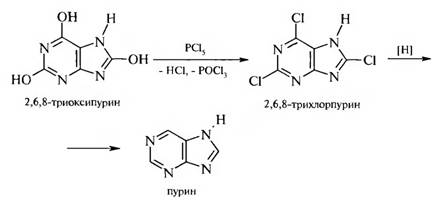
Из мочевой кислоты получают пурин.
1. Строение мочевой кислоты установлено при помощи реакций окисления:
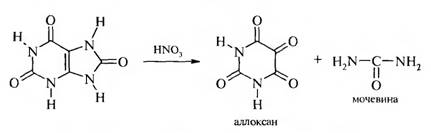
а) окисление азотной кислотой:
Таким образом, при окислении азотной кислотой сохраняется пиримидиновое ядро и раскрывается имидазольный цикл.
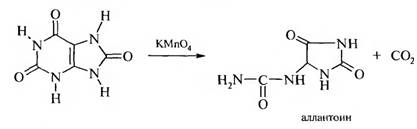
б) окисление перманганатом калия в нейтральной или щелочной среде:
Эта реакция доказывает наличие в мочевой кислоте пятичленного имидазольного цикла.
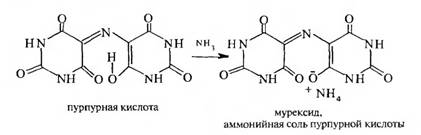
2. Мурексидная проба — качественная реакция на мочевую кислоту. Мочевую кислоту нагревают с конц. HN03 и добавляют концентрированный раствор аммиака — образуется пурпурно-фиолетовое окрашивание. При этом образуется аммонийная соль пурпурной кислоты следующего строения:
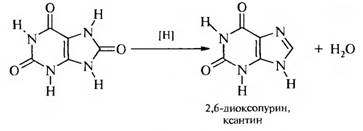
При частичном восстановлении мочевой кислоты образуется ксантин.
Ксантин проявляет амфотерные свойства. Для него характерна лактам-лактимная и азольная таутомерия.
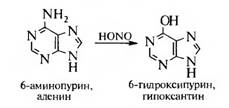
Из аминопроизводных пурина отметим аденин или 6-аминопурин, который входит в состав нуклеиновых кислот, содержится в печени. Окисляется азотистой кислотой до 6-оксипурина (гипоксантина):
В природе встречаются N-метильные производные ксантина.
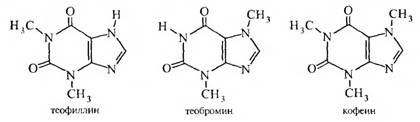
Теофиллин, теобромин и кофеин относятся к алкалоидам.
Видео:Подагра. Что делать? Моментально растворяет Кристаллы Мочевой КислотыСкачать
Мурексидная проба на мочевую кислоту уравнение реакции
Лекарственные вещества принадлежащие к группе алкалоидов. Производные пурина, индола и вещества содержащие экзоциклический азот. Лекарственные вещества из группы углеводов и гликозидов.
Алкалоиды производные пурина
Пуриновые алкалоиды являются производными ксантина — 2,6-дигидроксипурина, который может существовать в виде енольной и кетонной формы:

В медицинской практике применяются:
Кофеин (Coffeinum) Теофиллин (Theophyllinum) 
1,3,7-триметилксантин 1,3 — диметилксантин
Теобромин (Theobrominum)

Свойства
Кофеин — белые игольчатые кристаллы, горьковатого вкуса. На воздухе выветривается, при нагревании — возгоняется. Медленно р-рим в воде, легко р-рим в горячей воде и хлороформе, трудно р-рим в спирте и эфире.
Теобромин — белый кристаллический порошок, горького вкуса. Очень мало растворим в воде, мало растворим в горячей воде, очень мало растворим в спирте, легко растворим в разведенных кислотах и щелочах.
Теофиллин — белый кристаллический порошок. Мало растворим в воде, спирте и хлороформе, легко растворим в горячей воде, растворим в разведенных кислотах и щелочах.
Кофеин — очень слабое основание, образует с кислотами нестойкие соли за счет азота в 9 положении.
Теобромин и теофиллин — амфотерные соединения с преобладанием кислотных свойств (за счет подвижного атома водорода при азоте в положении 1 или 7).
Природные источники этих алкалоидов — листья чая, бобы какао, зерна кофе. В настоящее время их получают синтетическим путем из мочевой кислоты.
Идентификация
Групповая фармакопейная реакция — реакция на ксантины (мурексидная проба): лекарственное вещество в фарфоровой чашке обрабатывают раствором пероксида водорода концентрированным, разведенной НС1 и выпаривают на водяной бане до получения сухого желтовато-красного окрашивания. При смачивании остатка 1-2 каплями раствора аммиака появляется красно-фиолетовое окрашивание: 
Кофеин:
1. Определяют Тпл. (234° — 239°С), ИК-спектральные характеристики.
2. Реакция с ацетилацетоном и диметиламинобензальдегидом. Раствор субстанции в смеси ацетилацетона и раствора натрия гидроксида разведенного нагревают на водяной бане, охлаждают и прибавляют раствор диметиламинобензальдегида и еще раз нагревают. Охлаждают и прибавляют воду — появляется интенсивное синее окрашивание: 
3. Реакция с раствором калия йодида йодированным в присутствии кислоты хлористоводородной разведенной — появляется коричневый осадок, который растворяется при добавлении раствора натрия гидроксида.
4. Потеря в массе при высушивании не должна превышать 0,5 % — в отличие от кофеина моногидрата.
5. Реакция на ксантины (мурексидная проба).
6. С раствором танина образуется белый осадок, растворимый в избытке реактива.
Теобромин:
1. Реакция его натриевой соли, полученной при взаимодействии щелочи с избытком теобромина (используется фильтрат) с раствором CоCl2 — появляется быстро исчезающее интенсивное фиолетовое окрашивание и образуется осадок серовато — голубого цвета: 
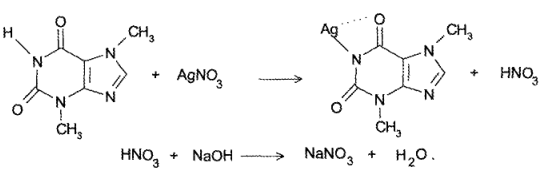
2. Реакция натриевой соли теобромина с раствором AgNО3 — образуется густая желатинообразная масса (серебрянная соль), которая разжижается при нагревании до 80° С и снова застывает при охлаждении.
Теофиллии:
1. Реакция натриевой соли теофиллина с раствором CоCl2 — образуется белый с розовым оттенком осадок кобальтовой соли (см. теобромин).
2. Со щелочным раствором нитропруссида натрия — образуется зеленое окрашивание, исчезающее при добавлении избытка кислоты.
Количественное определение
Кофеин:
1. Ацидиметрия в неводной среде. Точку эквивалентности определяют потенциометрически:
Теобромин и теофиллин определяют методом заместительного титрования. Метод основан на образовании солей серебра и выделении эквивалентных количеств азотной кислоты, которую оттитровывают 0,1 М раствором натрия гидроксида (индикатор — феноловый красный):

HNO3 + NaOH > NaNО3 + H2O
Применение. Кофеин используется как стимулятор ЦНС, кардиотоничный препарат, при спазмах сосудов; теобромин и теофилин спазмолтические (сосудо-, бронхорасширяющие) и диуретические препараты.
Хранение.В хорошо укупоренной таре.
В медицине применяются также кофеин-бензоат натрия и эуфилин, которые отличаются лучшей растворимостью в воде, чем соответствующие им алкалоиды.
Кофеин-бензоат натрия (Coffeinum—natrii benzoas)
Свойства
Белый порошок без запаха, слабогорького вкуса, легко растворим в воде, трудно — в спирте.
Получают смешиванием водных растворов, содержащих эквимоле-кулярные количества кофеина и натрия бензоата с последующим выпариванием досуха.
Идентификация.
1. Кофеин:
а) по Тпл. (234°-237°С) после осаждения и извлечения хлороформом;
б) реакцией на ксантины (мурексидная проба);
в) реакцией с раствором танина;
г) реакцией с раствором йода.
2. Бензоат натрия:
а) по реакции с FeCl3 — осадок розовато-желтого цвета (бензоат);
б) по желтой окраске пламени горелки — Na+.
Количественное определение
1. Кофеин определяют йодометрически (см. кофеин). Кофеина в пересчете на сухое вещество должно быть не менее 38,0% и не более 40,0%.
2. Бензоат натрия определяют ацидиметрически в присутствии смешанного индикатора (раствор метилового оранжевого и метиленового синего в соотношении (1:1) и эфира (для извлечения выделяющейся бензойной кислоты). Бензоата натрия в пересчете на сухое вещество должно быть не менее 58,0% и не более 62,0%.

Кофеин-бензоат натрия в лекарственных формах чаще всего определяют по бензоату натрия, который оттитровывают ацидиметрически.
Применение. Cтимулятор ЦНС, кардиотоничный препарат.
Хранение. В хорошо укупоренной таре.

Теофиллин с 1,2-этилендиамином
Свойства
Белый или белый с желтоватым оттенком кристаллический порошок со слабым аммиачным запахом. На воздухе поглощает углекислоту, при этом уменьшается растворимость. Растворим в воде, водные растворы имеют щелочную реакцию.
Идентификация
1.Теофиллин:
а) реакция на ксантины (мурексидная проба);
б) по Тпл. теофиллина, после подкисления НС1 до рН 4-5 (269°-274° С).
2. Этилендиамин: реакция с раствором сульфата меди — образуется ярко-фиолетовое окрашивание:
Количественное определение
- Этилендиамин определяют ацидиметрически, индикатор метиловый оранжевый:
Этилендиамина в эуфиллине должно быть 14-18% или в эуфиллине для инъекций — 18-22 %.
2.Теофиллин определяют так же как в лекарственном веществе после высушивания навески в сушильном шкафу при 125-130° С до исчезновения запаха аминов.
Содержание безводного теофиллина в эуфиллине должно быть 80,0-85,0%; в эуфиллине для инъекций — 75-82%.
В лекарственных формах эуфиллин чаще всего определяют по этилендиамину, при этом содержание эуфиллина рассчитывают по этилендиамину с учетом его процентного содержания в эуфиллине.
Применение. Кофеин и кофеин-бензоат натрия — стимуляторы центральной нервной системы и кардиотонические средства.
Теобромин и теофиллин — спазмолитические (сосудорасширяющие, бронхорасширяющие ) и диуретические средства.
Эуфиллин — спазмолитическое (сосудорасширяющее, бронхорасширяющее) средство.
Хранение. Лекарственные средства пуриновых алкалоидов хранят в сухом, защищенном от света.
Близкими к теофиллину по действию и структуре являются синтетические вещества:
Дипрофиллин (Diprophyllinum)

7-(2′,3′-Диоксипропил)-теофиллин
Применение. Менее токсичен чем теофиллин, применяют при спазмах коронарных сосудов, сердечной и бронхиальной астме, гипертонической болезни.
Ксантинола никотинат (Xantinoli nicotinas)

7-[2?-Окси-3?-(N-метил-?-оксиэтиламино)-пропил]-теофиллинаникотинат
Применение. Улучшает перефирическое и церебральное кровообращение.
Алкалоиды производные индола
Основными представителями индольных алкалоидов являются:
1. Акалоиды калабарских бобов — физостигмин.
2. Алкалоиды рвотного ореха-стрихнин.
3. Алкалоиды раувольфии — резерпин.
4. Алкалоиды спорыньи — эргоалкалоиды.
Физостигмина салицилат (Fhysostigmini salicylas)

Синтетический заменитель по действию Прозерин (Proserinum)

Применение. Антихолинэстеразные, миотические средства — при глаукоме. Прозерин применяют также при миастении, двигательных нарушениях, невритах.
Алкалоиды производные имидазола
Пилокарпина гидрохлорид (Pilocarpini hydrochloridum) 
a-Этил-?-( 1 -метилимидазолил-5 -метил )-?-бутиролактона гидрохлорид
Активностью обладает природный правовращающий цис-изомер.
Свойства
Бесцветные кристаллы или белый кристаллический порошок. Гигроскопичен. Очень легко расворим в воде, легко расворим в спирте.
Идентификация
1.Реакция на Сl—.
2. Реакция образования надхромовых кислот (Н2О2 + H2SO4 + К2Сг2О7), которые в присутствии пилокарпина извлекаются бензолом и окрашивают бензол в сине-фиолетовый цвет. В отсуствие пилокарпина окрашенный продукт бензолом не экстрагируется. Удельное вращение от +88,5° до +91° (2% водный расвор).
4. С нитропруссидом натрия в щелочной среде — вишневое окрашивание, не исчезающее при добавлении избытка НСl. Гидроксамовая проба (на лактонное кольцо)/
Количественное определение
1. Ацидиметрия в неводной среде.
2. Алкалиметрия в спиртовой среде.
Применение. Холинолитическое средство.
Хранение. В хорошо укупоренной таре, предохраняющей от действия света и влаги.
Алкалоиды, содержащие экзоциклический азот
Эфедрина гидрохлорид (Ephedrini hydrochloridum) 
(-)1-Фенил-2-метиламинопропанола-1 гидрохлорид
Эфедрин и его изомер псевдоэфедрин в настоящее время получают синтетически. Природный алкалоид является левовращающим эритро-изомером эфедрина.

Свойства
Бесцветные игольчатые кристаллы или белый кристаллический
порошок без запаха, горького вкуса. Легко растворим в воде, растворим в спирте.
Основание эфедрина растворимо в воде, поэтому при действии растворов едких щелочей на раствор соли осадок не выпадает. Этим эфедрина гидрохлорид отличается от многих других солей алкалоидов.
Идентификация
1. Реакция на С1-.
2. При добавлении к раствору лекарственного вещества CuSO4 в присутствии гидроксида натрия образуется комплексное соединение синего цвета: 
При взбалтывании этого раствора с эфиром — эфирный слой окрашивается в фиолетово-красный цвет, водный — сохраняет синее окрашивание.
3. При нагревании с кристалликом феррицианида калия — запах бензальдегида (горького миндаля): 
4. Удельное вращение от -33° до -36° (5% водный раствор).
Количественное определение
1. Ацидиметрия в неводной среде.
2. Алкалиметрия по связанной НС1.
3. Аргентометрия по связанной НС1.
Применение. Симпатомиметическое (сосудосуживающее, бронхорасширяющее) средство.
Хранение. В хорошо укупоренной таре, предохраняющей от действия света.
Лекарственные вещества из группы углеводов и гликозидов
Лекарственные вещества из группы углеводов
Углеводы (глициды) — группа органических соединений, состоящая из углерода, водорода и кислорода. Большинство углеводов соответствуют общей формуле Cm(H2O)n. По химическим свойствам углеводы — полигидроксильные соединения, содержащие или образующие при гидролизе альдегидную или кето-группу.
Углеводы классифицируют:
1. По количеству углеродных атомов в молекуле различают тетрозы, пентозы, гексозы, гептозы и т.д.
2. По основной функциональной группе различают альдозы и кетозы.
З.По количеству атомов в цикле (для циклических структур) различают фуранозы и пиранозы.
4. По числу моносахаридных единиц различают простые углеводы (моносахариды, монозы), олигосахариды (от 2 до 10 моносахаридов) и полисахариды (свыше 10 моносахаридов).
Наиболее известным и широко применяемым в медицинской практике моносахаридом является глюкоза.
Глюкоза (Glucosum) Glucose anhydrous*
Свойства
Бесцветные кристаллы или белый мелкокристаллический порошок без запаха, сладкого вкуса. Растворим в 1,5 ч воды, трудно растворим в 95% спирте, практически нерастворим в эфире.
Для медицинских целей глюкозу получают гидролизом картофельного или кукурузного крахмала в присутствии минеральных кислот.
(C6H10O5)n + nН2О > + nC6H12O6
Очищают глюкозу перекристаллизацией из водных или водно-спиртовых растворов, причем, если кристаллизацию вести при температуре выше 30° С — получается безводная глюкоза, а при температуре ниже 30° С — кристаллогидрат, содержащий одну молекулу воды: C6H12O6·H2O
Идентификация
1.Тонкослойная хроматография. Пятно на хроматограмме испытуемого раствора по положению, размеру и цвету должно соответствовать пятну на хроматограмме раствора фармакопейного стандартного образца глюкозы. Проявление проводят метанолъным раствором тимола и серной кислоты.
2.Фармакопейной реакцией подлинности на глюкозу является реакция с медно-тартратным реактивом (реактивом Фелинга): при нагревании до кипения раствора глюкозы с этим реактивом выпадает кирпично-красный осадок:

Помимо реактива Фелинга для может быть использован аммиачный раствор нитрата серебра (реакция серебрянного зеркала).
В методиках экспресс-анализа лекарственных форм для идентификации глюкозы используют также реакцию с тимолом и концентрированной серной кислотой — (появляется темно-красное окрашивание), или взаимодействие с резорцином и разведенной хлористоводородной кислотой — (при нагревании до кипения появляется розовое окрашивание).
Фармакопея регламентирует прозрачность, цветность, кислотность или щелочность раствора глюкозы, удельное вращение, содержание сульфитов, сульфатов, мышьяка, бария, кальция, свинца, воды, сульфатной золы и пирогенов. Содержание посторонних cахаров, растворимого крахмала, декстринов определяют после кипячения с 90 % спиртом — раствор должен оставаться прозрачным.
3. Поскольку глюкоза является оптически активным веществом, для подтверждения подлинности и чистоты фармакопея рекомендует устанавливать удельное вращение (от +52,5° до +53,3°, в пересчете на сухое вещество; 10 % водный раствор в присутствии аммиака).
Для глюкозы характерно явление мутаротации — явление изменения с течением времени угла вращения свежеприготовленных растворов углеводов. Существование явления мутаротации объясняется следующим образом: глюкоза может существовать в нескольких таутомерных формах. Кристаллическая глюкоза, полученная перекристаллизацией из водно-спиртовых растворов, представляет собой на 100% a- D-(+)-глюкопиранозу. При растворении в воде происходит ее переход в другие таутомерные формы.
a- D -(+)-глюкопираноза имеет удельное вращение около +119°; ?-D-(+)-глюкопираноза — около +19°. В результате взаимных превращений образуется равновесная смесь различных таутомерных форм D-глюкозы, содержащая »63% ?-D -(+)-глюкопиранозы, «36% a- D -(+)-глюкопиранозы и менее одного процента ациклической формы и глюкофураноз. Удельное вращение этой смеси и составляет +52,5° — +53,3°. Для ускорения наступления равновесия в качестве катализатора к раствору глюкозы добавляют 0,2 мл раствора аммиака.
Количественное определение
Фармакопея не требует проводить количественное определение глюкозы в субстанции. Содержание глюкозы в растворах для инъекций рекомендует определять методом рефрактометрии. Можно использовать также метод поляриметрии.
Из титриметрических методов для количественного определения глюкозы в лекарственных формах наиболее часто применяют йодометрию.
К испытуемому веществу прибавляют избыток титрованного раствора йода и раствор гидроксида натрия:
I2 + 2NaOH>NaI + NaOI + Н2О
RC(O)H + NaOI + NaOH> RC(O)ONa + NaI + Н2О
Через некоторое время прибавляют раствор серной кислоты и избыток йода оттитровывают тиосульфатом натрия:
NaI + NaOI + H2SO4 >Na2SO2 + I2+ Н2О
I2+ 2Na2S2O3> 2NaI + Na2S4O6
Параллельно проводят контрольный опыт.
Применение. При различных заболеваниях сердца, при шоке, коллапсе, в качестве источника легко усваиваемого организмом питания, улучшающего функции различных органов.
Хранение. В хорошо укупоренной таре.
Сахароза (Saccharum) Sucrose
(2-a —D -глюкопиранозидо-?-D -фруктофуранозид)
Свойства
Сахароза — тростниковый или свекловичный сахар представляет собой белое кристаллическое вещество, растворимое в 0,5 частей воды и в 60 частях спирта, не растворимое в эфире и хлороформе.
Плавится при температуре 184-185°С, при дальнейшем нагревании темнеет и превращается в бурую, горькую на вкус массу (карамель).
Поскольку гликозидную связь в молекуле сахара образуют полуацетальные гидроксилы глюкозы и фруктозы, она является не восстанавливающим и не мутаротирующим сахаром.
Идентификация
1. Инфракрасный спектр субстанции должен совпадать с инфра-красным спектром сахарозы.
2. Тонкослойная хроматография. Проявление проводят раствором тимола и серной кислоты в метаноле.
3. К раствору сахарозы добавляют растворы меди сульфата и натрия гидроксида — появляется голубое окрашивание, которое не изменяется при кипячении (реакция на не восстанавливающие сахара). К горячему раствору прибавляют хлористоводородную кислоту и кипятят в течении 1 минуты, затем раствор подщелачивают добавлением раствора натрия гидроксида — постепенно образуется оранжевый осадок (реакция на глюкозу, образовавшуюся в результате гидролиза).
4.Реакция с нитратом кобальта. В щелочной среде появляется характерное фиолетовое окрашивание.
5.В лекарственных формах сахарозу идентифицируют по реакции с резорцином. При нагревании в присутствии НС1 появляется красное окрашивание.
При нагревании подкисленных водных растворов сахароза легко гидролизуется с образованием инвертного сахара.
Удельное вращение раствора сахарозы до гидролиза составляет:
[a]D20 = +66°
В результате гидролиза образуется равновесная смесь сахаров состоящая из равных количеств:
глюкозы [a]D20 = +52,5° и фруктозы [a]D20 = -93°
Общее суммарное вращение будет отрицательным (»-40°). Таким образом явление изменения не только угла, но и знака вращения после гидролиза называют явлением инверсии.
Примесь глюкозы и инвертного сахара определяют по взаимодействию с раствором метиленового синего в щелочной среде; голубое окрашивание не должно исчезать .
ГФУ регламентирует прозрачность и окраску раствора, кислотность или щелочность, проводимость, удельное вращение, содержание декстринов (по реакции с йодом), сульфатов, свинца, бактериальных эндоксинов, потерю в весе при высушивании.
Количественное определение
Проводят рефрактометрическим, поляриметрическим методом или, после гидролиза в присутствии хлористоводородной кислоты, методом Бертрана по продуктам взаимодействия с реактивом Фелинга.
Применяют сахарозу для приготовления сиропов и как вспомогатель-ное вещество при изготовлении лекарственных форм.
Лактоза, сахар молочный (Saccharum lactis); Lactose
4-?-D –галактопиранозидо-a— D-глюкопираноза
Уже название этого сахара говорит о том, что он встречается в молоке млекопитающих; женское молоко содержит 5—8% лактозы, коровье — 4-6%.В промышленном масштабе лактозу получают в качестве побочного продукта при производстве сыра.
Полученное вещество представляет собой белые кристаллы или белый кристаллический порошок, без запаха, слабого сладкого вкуса.
Полуацетальный гидроксил глюкозы в молекуле лактозы, в отличие от молекулы сахарозы, остается свободным, поэтому лактоза является мутаротирующим и восстанавливающим сахаром.
Идентификация
1. Инфракрасная спектроскопия .
2. Тонкослойная хроматография .
3. 0,25 г лактозы растворяют в 5 мл воды, добавляют 5 мл раствора аммиака и нагревают на водяной бане при 80° в течении 10 минут — появляется красное окрашивание .
4. Раствор лактозы восстанавливает медно-тартратный реактив (реактив Феллинга).
(ГФУ) регламентирует прозрачность и окраску раствора , кислотность или щелочность, поглощение раствора в УФ- и видимом свете, содержание тяжелых металлов, воды, сульфатной золы.
Удельное вращение 10 % раствора лактозы в пересчете на сухое вещество должно составлять от +54,4° до +55,9. Измерение угла вращения проводят через 30 минут после прибавления к раствору лактозы 0,2 мл раствора аммиака.
Количественное определение лактозы можно проводить теми же методами, что и глюкозы.
Применение. Лактоза отличается от других сахаров отсутствием гигроскопичности и поэтому используется для приготовления порошков с легко гидролизующимися веществами, как наполнитель при производстве таблеток и капсул. Она имеет плотность, близкую к плотности большинства ядовитых и сильнодействующих веществ и поэтому широко применяется для изготовления тритураций. Входит лактоза и в состав питательных смесей для детского диетического питания.
Гликозиды
Гликозиды — это природные углеводсодержащие вещества, в которых гликозильная часть молекулы (циклическая форма сахаров) связана с органическим радикалом не являющимся сахаром (aнгликон или генин).
По природе сахарной части гликозиды делят на две группы: пиранозиды и фуранозиды. Различают также a- и ?-гликозиды в зависимости от конфигурации углевода, связанного с агликоном. Сахарная часть молекулы может содержать один или несколько связанных между собой сахаров.
Связь сахарного остатка с генином осуществляется либо через кислород (О-гликозиды), либо через азот (N-гликозиды) либо через серу (тиогликозиды).
О-гликозиды по характеру агликона делят на:
1) фенологликозиды (гликозиды толокнянки — арбутин);
2) антрахинонгликозиды (гликозиды крушины, ревеня, алоэ);
3) флавонгликозиды (катехины, рутин);
4) азотосодержащие О-гликозиды (амигдалин);
5) глюкоалкалоиды (соласодин);
6) стероидные гликозиды (сердечные гликозиды);
7) дубильные вещества (танин);
8) сапонины.
Сердечные гликозиды — биологически активные вещества, содержащиеся в некоторых видах растений или выделениях некоторых видов жаб и обладающие способностью в малых дозах оказывать специфическое действие на сердечную мышцу.
Сахара, входящие в состав сердечных гликозидов, за исключением глюкозы и рамнозы, специфичны для данной группы веществ и представляют собой 6-дезоксигексозы (L-рамноза), 2,6-дезоксигексозы (D-дигитоксоза) или их З-О-метиловые эфиры (D-цимароза, L-олеандроза).
Агликоны (генины) сердечных гликозидов имеют стероидную структуру, т.е. являются производными циклопентанпер-гидрофенантрена.
По химическому строению агликоны можно разделить на две группы, отличающиеся структурой присоединенного в положении 17 лактонного цикла. Сердечные гликозиды, содержащие пятичленное лактонное кольцо принято называть карденолидами, а имеющие шестичленное лактонное кольцо с двумя двойными связями — буфадиенолидами.
Специфическое действие гликозида на сердце обусловлено наличием в молекуле агликона лактонного цикла в положении 17 и гидроксила в положении 14. На кардиотоническое действие большое влияние оказывает заместитель в положении 10. Для большинства агликонов это метальная или альдегидная группа.
Радикалы агликонов некоторых кардиенолидов
Видео:Мочевая кислота. Как вывести ее из организма? ☝️Скачать

Производные пурина. Фармацевтический анализ пурина
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
Производные пурина. Фармацевтический анализ пурина
Глава 16. Анализ лекарственных средств группы пурина
В природе производные пурина имеют большое биологическое значение. Соединения группы пурина содержатся в растениях и тканях животных в свободном виде, а также входят в состав нуклеозидов, нуклеотидов и нуклеиновых кислот.
Кофеин содержится в листьях чая (до 5%) и зернах кофе (до 1,5%). Впервые кофеин выделен и описан Ф. Рунге (1819); строение этого алкалоида доказано Э. Фишером в 1882 г. В листьях чая содержится также теофиллин, а в бобах какао – теобромин.
Нуклеиновые кислоты присутствуют в клетках всех живых организмов и выполняют важнейшие функции по хранению и передаче генетической информации.
К производным пурина относится большая труппа лекарственных веществ, обладающих рахтичной фармакологической активностью — бронхолитической, диуретической, кардиотонической, противоопухолевой, действием на ЦНС.
В основе химической структуры указанных лекарств лежит бициклическая система пурина, существующая в виде 2 изомеров:
ЛС — производные пурина по химическому строению разделяются на следующие группы:
- производные ксантина;
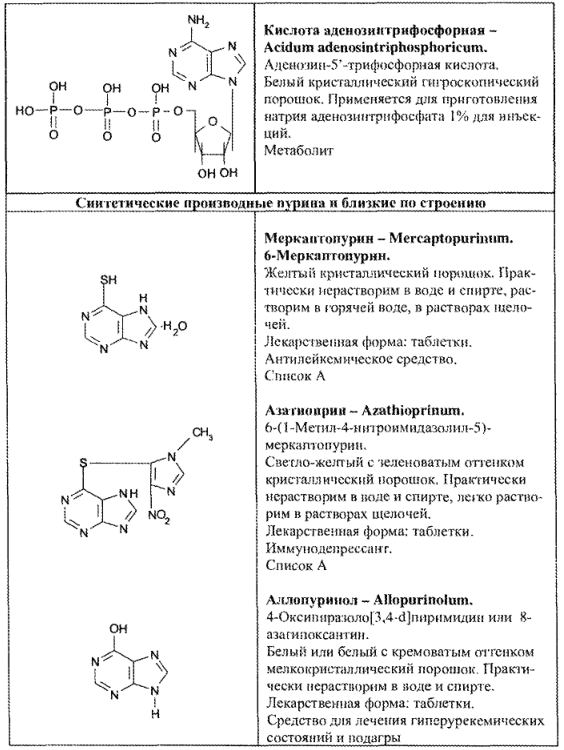
- нуклеозиды и нуклеотиды пурина (рибоксин, АТФ, динатриевая соль аденозинтрифосфорной кислоты);
- синтетические производные пурина и близкие по строению (табл. 67).
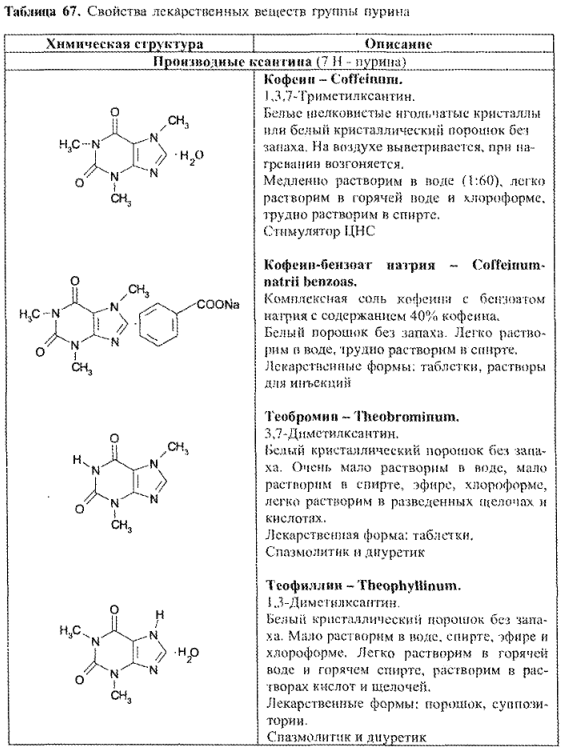
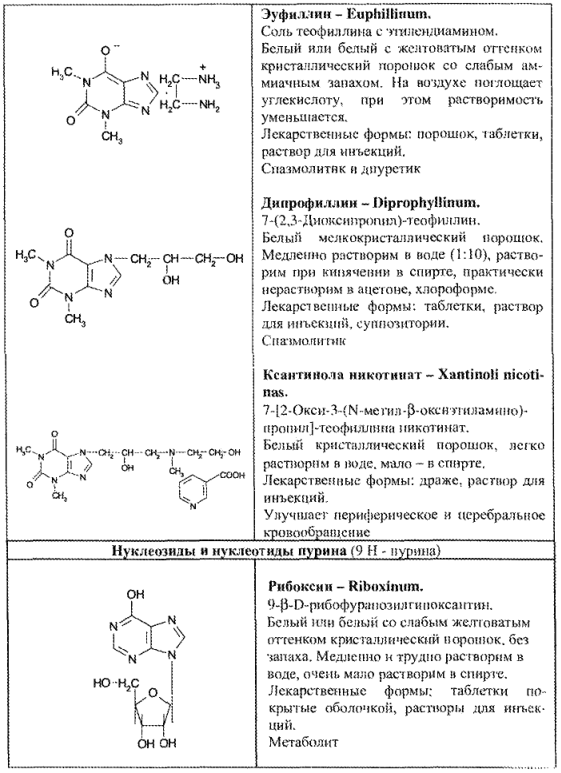
ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА И АНАЛИЗ КАЧЕСТВА
Физические свойства
Все соединения группы пурина – кристаллические порошки белого цвета с характерными Тпл и спектрами поглощения в УФ- и ИК-областях.
Способы получения
Вещества группы пурина можно получать из природных источников и синтетически. Пуриновые алкалоиды (кофеин, теофиллин, теобромин) — растительного происхождения.
С конца XIX в. успешно развиваются различные методы синтеза пурина и его производных. Впервые пурин был синтезирован Э. Фишером в 1899 г. при восстановлении 2,6,8-трихлорпурина. В настоящее время наибольшее практическое значение имеют 4 способа синтеза пуринов:
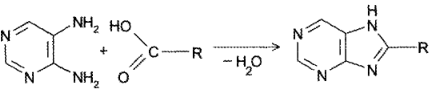
- Конденсация 4,5-диаминопиримидинов с карбоновыми кислотами (синтез Траубе, 1910). Этот способ в дальнейшем многократно модифицировался и до сих пор не утратил своего значения:
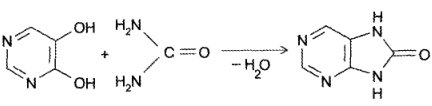
- Конденсация 4,5-диоксипиримидинов с. мочевиной (Беренд, Розен, 1888):
- Присоединение цианатов или изотиоцианатов к 5-амино-2,4,6- гриоксиоксипиримидину с последующей циклизацией образующегося карбамида пои нагревании в кислой среде (Э. Фишер, Аш, 1895):
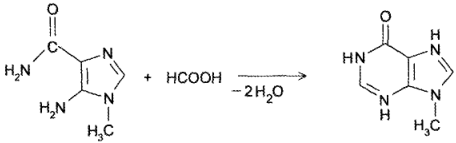
- Конденсация амида 5-амино-1-метилимидазол-4-карбоновой кислоты с муравьиной кислотой:
Кислотно-основные свойства
Пурин — ароматическая система с сильной делокализацией тг-электронов, которые играют большую роль в образовании различных молекулярных комплексов. Он обладает электронодонорными свойствами и представляет собой растворимое в воде слабое основание (рКа = 2,4), образующее с кислотами непрочные соли. В то же время благодаря наличию подвижного атома водорода в NН- группе пурин проявляет слабые кислотные свойства (рКа – 8,9) и образует соли с металлами.
Лекарственные вещества группы пурина — слабые основания, образующие с кислотами неустойчивые соли при протонировании гетероатома азота в 9-м положении.
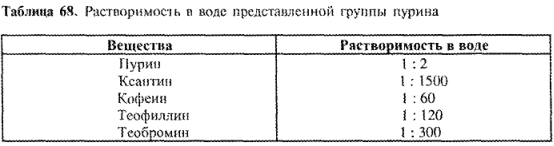
Как правило, производные ксантина с трудом растворяются в воде (лучше — в горячей). Для получения хорошо растворимых лекарственных препаратов используется их способность к комплексообразованию. Данные о растворимости различных веществ группы пурина представлены в табл. 68:
Хорошая растворимость пурина объясняется тем, что он образует водородные мостики с молекулами воды. Особенно мала растворимость ксантина. При метилировании атомов азота она значительно улучшается, как видно на примере кофеина, теофиллина, теобромина. Различия в растворимости объясняются разной межмолекулярной ассоциацией.
У кофеина 3 гетероатома азота метилированы. Вещество является мономером (не образует ассоциатов через водородные мостики), что объясняет его лучшую растворимость и низкую Тпл. Растворимость кофеина увеличивается в горячей воде, а также в присутствии солей органических кислот (за счет образования комплексов).
В теофиллине имеется одна свободная, но мало активная NН- группа, способная образовывать слабые межмолекулярные водородные мостики. Как в твердом состоянии, так и в растворе предполагается димеризация. Это подтверждается меньшей, чем у кофеина, растворимостью и более высокой Тпл.
Теобромин в твердом состоянии образует еще большие межмолекулярные агрегаты, основанные на активной NН-группе и выгодных в пространственном отношении карбонильных группах. Плохую растворимость и высокую Тпл можно также объяснить этой стабильной ассоциацией, что доказано ПК-спектроскопией.
Тенденция ксантинов к «самокомплексообразованию» противостоит их предрасположенности к образованию комплексов с солями органических кислот (бензойной, салициловой, 4
аминобензойной, ацетилсалициловой и др.).
Кофеин — слабое органическое основание (рКa. = 0,61). Растворим в минеральных кислотах, но устойчивых солей не образует. Взаимодействует с общеалкалоидными осадительными реактивами. Но с раствором йода реагирует только при подкислении (что характерно для такого слабого основания) с образованием осадка перйодида (Соff*Cl*14 ). С танином кофеин образует осадок, растворимый в избытке реактива. В отличие от многих других оснований кофеин не осаждается реактивом Майера, что используется при определении чистоты препарата.
Теобромин и теофиллин являются амфотерными соединениями. Их основные свойства обусловлены наличием неподеленной пары электронов атома азота в 9-м положении. Кислотные свойства теобромина (рКа= 9,9) связаны с подвижностью атома водорода имидной группы, а теофиллина (рК,
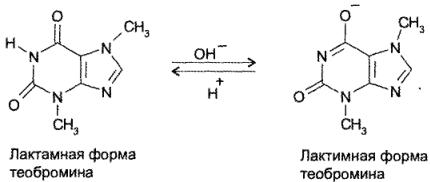
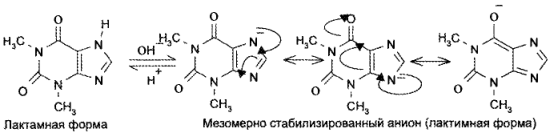
8,8) — с подвижностью атома водорода при гетероатоме азота в 7-м положении. Кислотные свойства у теофиллина выражены сильнее, чем у теобромина. Это связано с тем, что теобромин в растворах щелочей образует только лактимную форму, а теофиллин — мезомерно стабилизированный анион:
Обладая более выраженными, чем у теобромина, кислотными свойствами, теофиллин растворяется не только в щелочах, но и в растворе аммиака:
За счет кислотных свойств теофиллин и теобромин образуют растворимые соли не только со щелочами, но и с органическими основаниями. С солями тяжелых металлов (Аg + , Со 2+ , Сu 2+ ) получаются нерастворимые соединения.
Мурексидная проба (общегрупповая реакция)
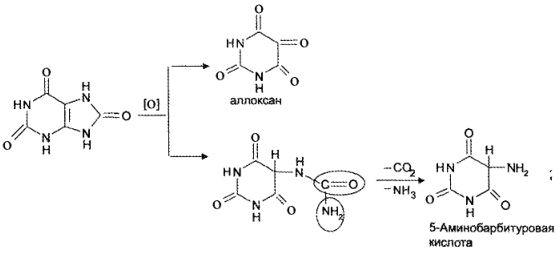
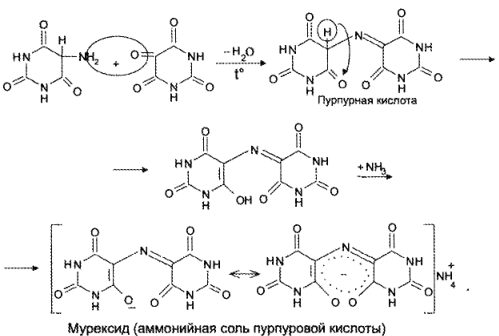
Реакция основана на окислительно-гидролитическом разложении веществ группы ксантина до производных пиримидина, в которых 1 или 2 аминогруппы конденсируются друг с другом до образования пурпурной кислоты, имеющей в виде аммонийной соли красно фиолетовое окрашивание. Для проведения реакции препарат нагревают на водяной бане до полного упаривания с окислителем (Н2О2, Вr2, НNО3) в кислой среде. Затем добавляют раствор аммиака; появляется пурпурно-красное окрашивание.
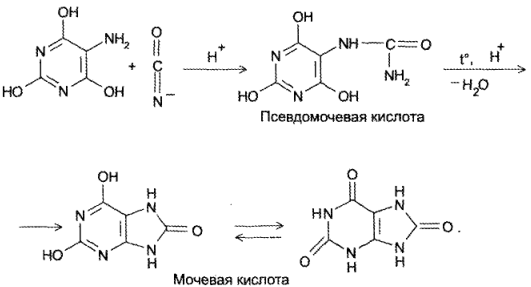
Химизм (на примере мочевой кислоты):
Для мочевой кислоты нагревание производят с кислотой азотной концентрированной, которая окислительно разлагает вещество до аллоксана и 5-аминобарбитуровой кислоты. Затем продукт окисления (как карбонильное соединение) конденсируется с продуктом гидролиза до пурпурной кислоты, которая в присутствии аммиака переходит в мезостабилизированный анион, назывемый мурексидом.
В случае метилированных производных ксантина вместо азотной кислоты применяют раствор пероксида водорода в солянокислой среде и затем добавляют аммиак (в случае, если он не образуется при гидролизе препарата).
Реакции электрофильного замещения после щелочного гидролиза
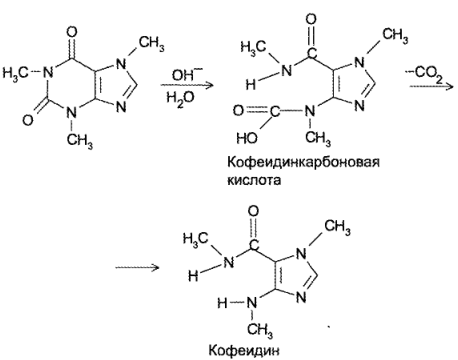
Кофеин, обладающий слабоосновными свойствами, неустойчив в щелочной среде. При pH > 9 происходит разложение кофеина до кофеидинкарбоновой кислоты, которая разлагается с образованием кофеидина и соответствующего карбоната. Причем кофеидия является антагонистом кофеина по фармакологическому действию, что может привести к нежелательным последствиям при применении разложившегося препарата.
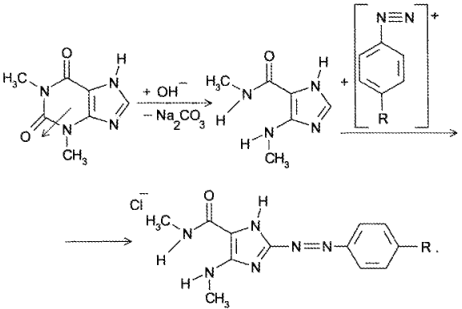
В сернокислой среде кофеин может разложиться до муравьиной кислоты. Аналогично разлагается теофиллин до теофиллидина, который далее может быть идентифицирован по реакции азосочетания с солью диазония с образованием азокрасителя:
Другие реакции
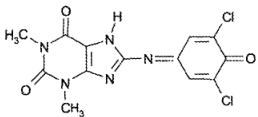
Теофиллин образует с 2,6-дихлорхинонхлоримидом в боратном буферном растворе (pH 8,5) мероцианиновый краситель интенсивно-голубого цвета:
Эуфиллин реагирует с раствором сульфата меди с образованием комплексного соединения красно-фиолетового цвета (реакция на остаток этилендиамина):
Аденозинтрифосфорная кислота (и натриевая соль) за счет остатка рибозы взаимодействует с орцином в присутствии небольшого количества хлорида железа (III) с образованием продукта конденсации сине-зеленого цвета:
В азатиоприне нитро-группу восстанавливают до первичной ароматической амино-группы и далее проводят диазотирование и азосочетание с фенолом (образование азокрасителя).
Остаток бензойной кислоты в кофеин-бензоате натрия открывают качественной реакцией с хлоридом железа (III) — образуется осадок телесного цвета.
Методы количественного определения
- Кислотно-основное титрование в неводной среде. Препараты-основания и соли оснований определяют в среде уксусного ангидрида (кофеин) или смеси ледяной уксусной кислоты и уксусного ангидрида (ксантинола никотинат). Титрант — 0,1М раствор хлорной кислоты.
Обладающие кислотными центрами теобромин, теофиллин растворяют в протофильных растворителях (диметилформамид, пиридин, бутил амин) и титруют растворами метилатов натрия или калия.
- Косвенный метод нейтрализации. При взаимодействии теобромина и теофиллина с раствором нитрата серебра образуется эквивалентное препаратам количество азотной кислоты, которую титруют стандартным раствором гидроксида натрия:
- Кислотно-основное титрование в водной среде. Кофеин-бензонат натрия определяют по остатку бензоата натрия титрованием стандартным раствором хлороводородной кислоты в присутствии эфира.
Эуфиллин за счет остатка этилендиамина количественно определяют титрованием стандартным раствором хлороводородной кислоты.
- Аргентометрия (обратный способ). К раствору теофиллина или теобромина добавляют аммиак и фиксированный избыток титрованного раствора нитрата серебра; образуется нерастворимая серебряная соль. Осадок отфильтровывают и в фильтрате определяют избыток нитрата серебра титрованием со стандартным раствором роданида аммония (индикатор – железоаммониевые квасцы).
- Йодометрия. Применяется для определения кофеина в кофе- ин-бензоате натрия. Метод основан на образовании осадка перйодида кофеина в кислой среде (соff • Нl • 14), который отфильтровывают и в фильтрате определяют избыток йода.
- Метод Кьельдаля (определение азота в органических веществах).
Данным методом определяют дипрофиллин.
- Весовой метод. Метод иногда используют для определения кофеина в лекарственных формах заводского производства (кофеин извлекают из смеси в щелочной среде хлороформом; далее хлороформ отгоняют, остаток высушивают и взвешивают).
- Физико-химические методы (УФ-спектрофотометрия, ГЖХ и ВЭЖХ) применяют для количественного определения препаратов группы пурина в лекарственных формах заводского производства. Метод рефрактометрии применяют для анализа растворов кофеинбензоата натрия в условиях аптеки.
🔍 Видео
Идеальный уровень мочевой кислоты, который снижает риски смерти и старенияСкачать

Что делать если повышена мочевая кислота?Скачать

Всего 1 стакан! В Китае только так растворяют кристаллы мочевой кислоты! ПодаграСкачать

1 СТОЛОВАЯ ЛОЖКА в неделю. Как в Китае растворяют кристаллы мочевой кислоты. Как остановить ПОДАГРУ?Скачать

💊 Мочевая кислота и подагра. Как снизить мочевую кислоту диетой? Врач эндокринолог Ольга Павлова.Скачать

Вывод мочевой кислоты, Ксенобиотики и Янтарная кислота. Алименко А.Н. (29.05.2019)Скачать

Что вызывает подагру? / Что делать с повышенной мочевой кислотой в организме?Скачать
Моментально Растворяют Кристаллы МОЧЕВОЙ Кислоты! Еда от Подагры, Камней в Почках, Болей в СуставахСкачать

Мочевая кислота и подаграСкачать

Как вывести избыток мочевой кислоты с помощью массажа?Скачать

Мочевая кислота и уратные камни | Прямые эфиры с урологаСкачать

⚠️ МОЧЕВАЯ КИСЛОТА. Как вывести мочевую кислоту из организма? ПОДАГРА. Мочекаменная болезньСкачать

вот как удалить мочевую кислоту чтобы избавится от подагры и артрита #народнаямедицина #полезныеСкачать

МОЧЕВАЯ КИСЛОТА КАК СНИЖАТЬ #атеросклероз #болезнисердца #болитсердце #подаграСкачать

Анализ мочи на мочевую кислотуСкачать

МОЧЕВАЯ КИСЛОТА И СЕРДЦЕ | СТАТИНЫ И ДИАБЕТСкачать

удалить мочевую кислоту чтобы избавится от болей в суставахСкачать

мочевая кислотаСкачать