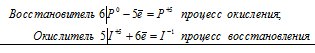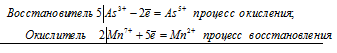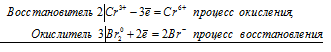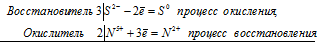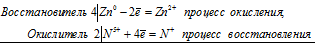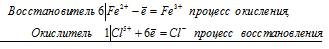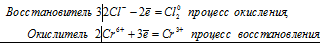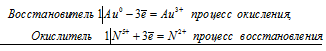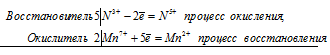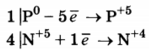- We are checking your browser. gomolog.ru
- Why do I have to complete a CAPTCHA?
- What can I do to prevent this in the future?
- Как правильно расставить коэффициенты в уравнении реакции окисления-восстановления
- Решение задач на составление уравнений окислительно-восстановительных реакций
- Привет! Это онлайн школа «Умскул»
- Задание № 11286
- 📸 Видео
Видео:ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать

We are checking your browser. gomolog.ru
Видео:МОЛЯРНАЯ МАССА ХИМИЯ // Урок Химии 8 класс: Относительная Молекулярная МассаСкачать

Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
Видео:Молярная масса. 8 класс.Скачать

What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 7015e3074e866b3f • Your IP : 87.119.247.227 • Performance & security by Cloudflare
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Как правильно расставить коэффициенты в уравнении реакции окисления-восстановления
Видео:Как за 4 МИНУТЫ выучить Химию? Химическое Количество, Моль и Закон АвогадроСкачать

Решение задач на составление уравнений окислительно-восстановительных реакций
Задание 231.
Реакции выражаются схемами:
Р + НClО3 + Н2О ⇔ Н3РО4 + НCl;
Н3AsO3 + KMnO4 +Н2SO4 ⇔ Н3AsO4 + K2SO4 + MnSO4 + H2O
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое — восстановителем; какое вещество окисляется, какое — восстанавливается.
Решение:
Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях. Коэффициенты для восстановителя и окислителя идентичны для продуктов окисления и восстановления. . Коэффициент перед веществами, атомы которых не меняют свою степень окисления, находят подбором.
а)Р + НClО 3 + Н 2О ⇔ Н 3РО 4 + НCl;
уравнения электронного баланса:
6P 0 + 5I +5 = 6P +5 + I -1
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов тридцать. Разделив это число на 6, получаем коэффициент 5 для окислителя и продукта его восстановления, а при делении 30 на 5 получаем коэффициент 6 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
В данной реакции: P – восстановитель, НIО3 – окислитель; P окисляется до Н3PO4, НIО3 – восстанавливается до HI.
5As 3+ + 2Mn 7+ = 5As 5+ + 2Mn 2+
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов десять. Разделив это число на 5, получаем коэффициент 2 для окислителя и продукта его восстановления, а при делении 10 на 2 получаем коэффициент 5 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
5Н 3 AsO 3 +2KMnO 4 + 3Н 2 SO 4 ⇔ 5Н 3 AsO 4 + K 2 SO 4 + 2MnSO 4 + 3H 2 O
В данной реакции: Н 3 AsO 3 – восстановитель, KMnO 4 – окислитель; Н 3 AsO 3 окисляется до Н 3 AsO 4, KMnO 4 – восстанавливается до MnSO 4.
Задание 232.
Реакции выражаются схемами:
NaCrO2 + Br2 + NaOH ⇔ Na2CrO4 + NaBr + H2O
FeS + HNO3 ⇔ Fe(NO3)2 + S + NO + H2O
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое — восстановителем; какое вещество окисляется, какое — восстанавливается.
Решение:
Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях. Коэффициенты для восстановителя и окислителя идентичны для продуктов окисления и восстановления. . Коэффициент перед веществами, атомы которых не меняют свою степень окисления, находят подбором.
2Cr 3+ + 3Br2 0 = 2Cr 6+ + 6Br —
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов шесть. Разделив это число на 2, получаем коэффициент 3 для окислителя и продукта его восстановления, а при делении 6 на 3 получаем коэффициент 2 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
В данной реакции: NaCrO2 – восстановитель, Br2 – окислитель; NaCrO2 окисляется до Na2CrO4, Br2 – восстанавливается до NaBr.
3S 2- + 2N 5+ = 3S 0 + 2N 2+
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов шесть. Разделив это число на 3, получаем коэффициент 2 для окислителя и продукта его восстановления, а при делении 6 на 2 получаем коэффициент 3 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
В данной реакции: FeS – восстановитель, HNO3 – окислитель; FeS окисляется до S, HNO3 – восстанавливается до NO.
Задание 233.
Реакции выражаются схемами:
HNO3 + Zn ⇔ N2O + Zn(NO3)2 + H2O;
FeSO4 + KClO3 + H2SO4 ⇔ Fe2(SO4)3 + KCl + H2O
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое — восстановителем; какое вещество окисляется, какое — восстанавливается.
Решение:
Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях. Коэффициенты для восстановителя и окислителя идентичны для продуктов окисления и восстановления. . Коэффициент перед веществами, атомы которых не меняют свою степень окисления, находят подбором.
4Zn 0 + 2N 5+ = 4Zn 2+ + 2N +
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов восемь. Разделив это число на 4, получаем коэффициент 2 для окислителя и продукта его восстановления, а при делении 8 на 2 получаем коэффициент 4 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
В данной реакции: Zn – восстановитель, HNO3 – окислитель; Zn окисляется до Zn(NO3)2, HNO3 – восстанавливается до N2O.
6Fe 2+ + Cl 5+ = 6Fe 3+ + Cl —
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов шесть. Разделив это число на 6, получаем коэффициент 1 для окислителя и продукта его восстановления, а при делении 6 на 1 получаем коэффициент 6 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
В данной реакции: FeSO4 – восстановитель, KClO3 – окислитель; FeSO4 окисляется до Fe2(SO4)3, KClO3 – восстанавливается до KCl.
Задание 234.
Реакции выражаются схемами:
K2Cr2O7 + HCl ⇔ Cl2 + CrCl3 + KCl + H2O;
Au + HNO3 + HCl ⇔ AuCl3 + NO + H2O
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое — восстановителем; какое вещество окисляется, какое — восстанавливается.
Решение:
Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях. Коэффициенты для восстановителя и окислителя идентичны для продуктов окисления и восстановления. . Коэффициент перед веществами, атомы которых не меняют свою степень окисления, находят подбором.
2Cr 6+ + 6Cl — = 2Cr 3+ + 3Cl2 0
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов шесть. Разделив это число на 3, получаем коэффициент 2 для окислителя и продукта его восстановления, а при делении 6 на 2 получаем коэффициент 3 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
В данной реакции: HCl – восстановитель, K2Cr2O7 – окислитель; HCl окисляется до Сl2, K2Cr2O7 – восстанавливается до CrCl3.
Au 0 + N 5+ = Au 3+ + N 2+
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Здесь число отданных электронов и число принятых электронов равно 3, поэтому коэффициенты при восстановителе и окислителе, и перед продуктами окисления и восстановления равны 1. Молекулярное уравнение реакции:
В данной реакции: Au – восстановитель, HNO3 – окислитель; Au окисляется до AuCl3, HNO3 – восстанавливается до NO.
Задание 235.
Могут ли происходить окислительно-восстановительные реакции между веществами: а) NH3 и КМnO4 б) HNO2 и HI; в) НСI и Н2S? Почему? На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме:
КМnO4 + КNO2 + Н2SO4 ⇔ МnSO4 + КNO3 + К2SO4 + Н2O
Решение:
а) Степень окисления в NH3 n(N) = -3 (низшая); в KMnO4 n(Mn) = +7 (высшая). Так как азот находится в своей низшей степени окисления, а марганец – в своей высшей степени окисления, то взятые вещества могут взаимодействовать друг с другом, причём NH3 является окислителем, а KMnO4 – восстановителем.
б) в HNO2 n(N) = +3 (промежуточная); в HI n(I) = -1 (низшая). Следовательно, взаимодействие этих веществ возможно, причем HI является окислителем, а HNO2 – восстановителем.
в) в HCl n(Cl) = -1 (низшая); в H2S n(S) = -2 (низшая). Так как и хлор, и сера находятся в своей низшей степени окисления, то оба вещества проявляют только восстановительные свойства и взаимодействовать друг с другом не могут.
г) КМnO4 + КNO2 + Н2SO4 ⇔ МnSO4 + КNO3 + К2SO4 + Н2O
Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях. Коэффициенты для восстановителя и окислителя идентичны для продуктов окисления и восстановления. . Коэффициент перед веществами, атомы которых не меняют свою степень окисления, находят подбором.
2Mn 7+ + 5N 3+ = 2Mn 2+ + 5N 5+
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов десять. Разделив это число на 5, получаем коэффициент 2 для окислителя и продукта его восстановления, а при делении 10 на 2 получаем коэффициент 5 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Привет! Это онлайн школа «Умскул»
Легендарный курс — Предбанник. Повтори весь материал ЕГЭ и ОГЭ за 5-9 дней!
Задание № 11286
Используя метод электронного баланса, составьте уравнение реакции
Определите окислитель и восстановитель.
1. Составлен электронный баланс.
2) Расставлены коэффициенты в уравнении реакции:
Указано, что восстановителем является Р 0 , а окислителем N +5 .
📸 Видео
Окислительно-восстановительные реакции в кислой среде. Упрощенный подход.Скачать

8 класс. ОВР. Окислительно-восстановительные реакции.Скачать

Химия | Относительная атомная и молекулярная массаСкачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Химия ПростоСкачать

Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

Химия. 8 класс. Решение задач по уравнениям химических реакций /25.11.2020/Скачать

Химическое количество вещества. Молярная масса. Химия 8 класс.Скачать

Решение цепочек превращений по химииСкачать

ЭТОТ метод поможет на уроках ХИМИИ / Химия 9 классСкачать

Относительная атомная и молекулярная масса. Количество вещества. Молярная масса. 10 класс.Скачать

Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

8 класс. Химия. Химические формулы. Относительная молекулярная массаСкачать

Решение задач на термохимические уравнения. 8 класс.Скачать