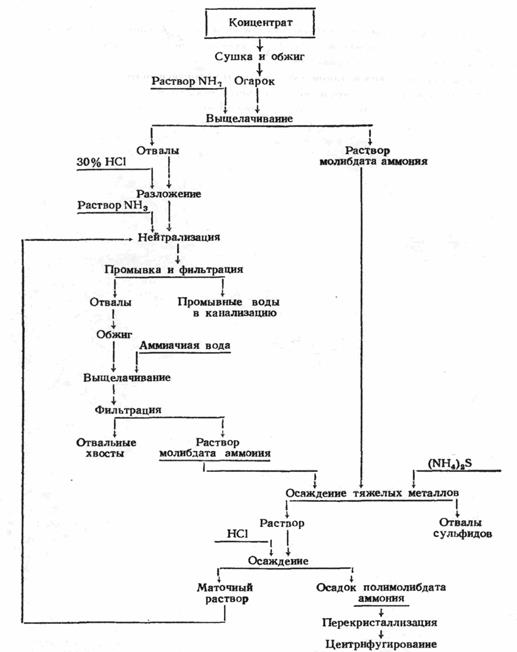
| Молибден | |
|---|---|
| Блестящий металл серебристо-белого цвета | |
 | |
| Название, символ, номер | Молибден / Molybdaenum (Mo), 42 |
| Атомная масса (молярная масса) | 95,96(2) а. е. м. (г/моль) |
| Электронная конфигурация | [Kr] 4d 5 5s 1 |
| Радиус атома | 139 пм |
| Ковалентный радиус | 130 пм |
| Радиус иона | (+6e) 62 (+4e) 70 пм |
| Электроотрицательность | 2,16 (шкала Полинга) |
| Электродный потенциал | −0,2 |
| Степени окисления | 6, 5, 4, 3, 2 |
| Энергия ионизации (первый электрон) | 684,8 (7,10) кДж/моль (эВ) |
| Плотность (при н. у.) | 10,22 г/см³ |
| Температура плавления | 2623 °C |
| Температура кипения | 4885 K |
| Уд. теплота плавления | 28 кДж/моль |
| Уд. теплота испарения | |
| Молярная теплоёмкость | 23,93 Дж/(K·моль) |
| Молярный объём | 9,4 см³/моль |
| Структура решётки | кубическая объёмноцентрированая |
| Параметры решётки | 3,147 Å |
| Температура Дебая | 450 K |
| Теплопроводность | (300 K) 138 Вт/(м·К) |
| Номер CAS | 7439-98-7 |
Молибден — элемент шестой группы (по старой классификации — побочной подгруппы шестой группы) пятого периода периодической системы химических элементов Д. И. Менделеева, атомный номер 42. Обозначается символом Mo (лат. Molybdaenum ). Простое вещество молибден — переходный металл светло-серого цвета. Главное применение находит в металлургии.
- Содержание
- История и происхождение названия
- Нахождение в природе
- Месторождения
- В космосе
- Добыча
- Генетические группы и промышленные типы месторождений
- Получение
- Физические свойства
- Изотопы
- Химические свойства
- Применение
- Биологическая роль
- Круговорот азота
- Микроэлемент
- Стоимость
- Физиологическое действие
- Молибден
- Что такое молибден
- История открытия элемента
- Физические свойства молибдена
- Химические свойства молибдена
- Молибден содержащие минералы
- Окисление молибдена кислотами щелочами
- Получение молибдена
- Применение молибдена
- Молибден в медицине
- Часто задаваемые вопросы и ответы о молибдене?
- Похожие страницы:
- Leave a Comment
- Глава 3. Методы и методики получения молибдена и его соединений
Видео:ПОЛУЧЕНИЕ Молибденовой Кислоты. Реакция Молибдена и Азотной КислотыСкачать

Содержание
- 1 История и происхождение названия
- 2 Нахождение в природе
- 2.1 Месторождения
- 2.2 В космосе
- 3 Добыча
- 3.1 Генетические группы и промышленные типы месторождений
- 4 Получение
- 5 Физические свойства
- 5.1 Изотопы
- 6 Химические свойства
- 7 Применение
- 8 Биологическая роль
- 8.1 Круговорот азота
- 8.2 Микроэлемент
- 9 Стоимость
- 10 Физиологическое действие
Видео:Молибден - Металл, СОЗДАЮЩИЙ СТРАННЫЕ РАСТВОРЫ!Скачать

История и происхождение названия
Открыт в 1778 году шведским химиком Карлом Шееле, который, прокаливая молибденовую кислоту, получил MoO3. В металлическом состоянии впервые получен П. Гьельмом в 1781 году восстановлением оксида углём: он получил молибден, загрязнённый углеродом и карбидом молибдена. Чистый молибден в 1817 году получил Й. Берцелиус восстановлением оксида водородом.
Название происходит от др.-греч. μόλυβδος , означающего «свинец». Оно дано из-за внешнего сходства молибденита (MoS2), минерала, из которого впервые удалось выделить оксид молибдена, со свинцовым блеском (PbS). Вплоть до XVIII века молибденит не отличали от графита из-за свинцового блеска, эти минералы носили общее название «молибден».
Видео:СТРАШНОЕ СОЕДИНЕНИЕ МОЛИБДЕНА (Mo)Скачать

Нахождение в природе
Содержание в земной коре — 3⋅10 −4 % по массе. В свободном виде молибден не встречается. В земной коре молибден распространён относительно равномерно. Меньше всего содержат молибдена ультраосновные и карбонатные породы (0,4—0,5 г/т). Концентрация молибдена в породах повышается по мере увеличения SiO2. Молибден находится также в морской и речной воде, в золе растений, в углях и нефти. Содержание молибдена в морской воде колеблется от 8,9 до 12,2 мкг/л для разных океанов и акваторий. Общим является то, что воды вблизи берега и верхние слои меньше обогащены молибденом, чем воды на глубине и вдали от берега. Наиболее высокие концентрации молибдена в породах связаны с акцессорными минералами (магнетит, ильменит, сфен), однако основная масса его заключена в полевых шпатах и меньше в кварце. Молибден в породах находится в следующих формах: молибдатной и сульфидной в виде микроскопических и субмикроскопических выделений, изоморфной и рассеянной (в породообразующих минералах). Молибден обладает большим сродством с серой, чем с кислородом, и в рудных телах образуется сульфид четырёхвалентного молибдена — молибденит. Для кристаллизации молибденита наиболее благоприятны восстановительная среда и повышенная кислотность. В поверхностных условиях образуются преимущественно кислородные соединения MO 6+ . В первичных рудах молибденит встречается в ассоциации с вольфрамитом и висмутином, с минералами меди (медно-порфировые руды), а также с галенитом, сфалеритом и урановой смолкой (в низкотемпературных гидротермальных месторождениях). Хотя молибденит считается устойчивым сульфидом по отношению к кислым и щелочным растворителям, в природных условиях при длительном воздействии воды и кислорода воздуха молибденит окисляется, и молибден может интенсивно мигрировать с образованием вторичных минералов. Этим можно объяснить повышенные концентрации молибдена в осадочных отложениях — углистых и кремнисто-углистых сланцах и углях.
Известно около 20 минералов молибдена. Важнейшие из них: молибденит MoS2 (60 % Mo), повеллит CaMoO4 (48 % Mo), молибдит Fe(MoO4)3·nH2O (60 % Mo) и вульфенит PbMoO4.
Месторождения
Крупные месторождения молибдена известны в США, Мексике, Чили, Канаде, Австралии, Норвегии, России. В России молибден выпускают на Сорском ферромолибденовом заводе. Более 7 % от мировых запасов молибдена расположены в Армении, причем 90 % из них сосредоточены в Каджаранском медно-молибденовом месторождении.
В космосе
Аномально высокое содержание молибдена наблюдается в звёздных образованиях, состоящих из красного гиганта (или сверхгиганта), внутри которого находится нейтронная звезда — объектах Ландау — Торна — Житковой.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Добыча
| Страна | Залежи (тыс. т) | 2001 | 2002 | 2003 | 2004 | 2005 | 2006 | 2007 | 2014 |
|---|---|---|---|---|---|---|---|---|---|
| США | 2700 | 37,6 | 32,3 | 29,9 | 41,5 | 58,0 | 59,8 | 59,4 | 68,2 |
| Китай | 3000 | 28,2 | 30,33 | 32,22 | 29,0 | 40,0 | 43,94 | 46,0 | 103,0 |
| Чили | 1905 | 33,5 | 29,5 | 33,4 | 41,48 | 47,75 | 43,28 | 41,1 | 48,8 |
| Перу | 850 | 8,35 | 8,32 | 9,63 | 9,6 | 17,32 | 17,21 | 17,25 | 17,0 |
| Канада | 95 | 8,56 | 7,95 | 8,89 | 5,7 | 7,91 | 7,27 | 8,0 | 9,7 |
| Россия | 360 | 3,93 | 4,29 | 3,57 | 3,11 | 3,84 | 3,94 | 4,16 | 4,8 |
| Мексика | 135 | 5,52 | 3,43 | 3,52 | 3,7 | 4,25 | 2,52 | 4,0 | 14,4 |
| Армения | 635 | 3,4 | 3,6 | 3,5 | 3,0 | 2,75 | 3,0 | 3,0 | 7,1 |
| Иран | 120 | 2,6 | 2,4 | 2,4 | 1,5 | 2,0 | 2,0 | 2,5 | 4,0 |
| Монголия | 294 | 1,42 | 1,59 | 1,6 | 1,7 | 1,19 | 1,2 | 1,5 | 2,0 |
| Узбекистан | 203 | 0,58 | 0,5 | 0,5 | 0,5 | 0,57 | 0,6 | 0,5 | 0,5 |
| Болгария | 10 | 0,4 | 0,4 | 0,2 | 0,2 | 0,2 | 0,4 | 0,4 | ? |
| Казахстан | 130 | 0,09 | 0,05 | 0,05 | 0,23 | 0,23 | 0,25 | 0,4 | — |
| Киргизия | 100 | 0,25 | 0,25 | 0,25 | 0,25 | 0,25 | 0,25 | 0,25 | ? |
| Прочие | 1002 | — | — | — | — | — | — | — | — |
| Итого | 11539 | 134,4 | 124,91 | 129,63 | 141,47 | 186,26 | 185,66 | 188,71 |
Генетические группы и промышленные типы месторождений
1. Контактово-метасоматические (скарновые).
А. Высокотемпературные (грейзеновые). Б. Среднетемпературные. а. кварц-молибденитовые. б. кварц-сфалерит-галенит-молибденитовые. в. кварц-халькопирит-молибденитовые (меднопорфировые руды). г. настуран-молибденитовые.
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Получение
Промышленное получение молибдена начинается с обогащения руд флотационным методом. Полученный концентрат обжигают до образования оксида MoO3:
который подвергают дополнительной очистке. Далее MoO3 восстанавливают водородом:
Полученные заготовки обрабатывают давлением (ковка, прокатка, протяжка).
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Физические свойства
Молибден — светло-серый металл с кубической объёмноцентрированной решёткой типа α-Fe (a = 3,14 Å; z = 2; пространственная группа Im3m), парамагнитен, шкала Мооса определяет его твёрдость 4,5 баллами. Механические свойства, как и у большинства металлов, определяются чистотой металла и предшествующей механической и термической обработкой (чем чище металл, тем он мягче). Обладает крайне низким коэффициентом теплового расширения. Молибден является тугоплавким металлом с температурой плавления 2620 °C и температурой кипения 4639 °C.
Изотопы
Природный молибден состоит из семи изотопов: 92 Mo (15,86 % по массе), 94 Mo (9,12 %), 95 Mo (15,70 %), 96 Mo (16,50 %), 97 Mo (9,45 %), 98 Mo (23,75 %) и 100 Mo (9,62 %). Шесть из них стабильны, 100 Mo слаборадиоактивен (период полураспада 8,5⋅10 18 лет, что в миллиард раз больше возраста Вселенной). Из искусственных изотопов самым стабильным является 93 Mo, с периодом полураспада 4 тысячи лет, период полураспада остальных изотопов не превышает 3 суток.
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Химические свойства
При комнатной температуре на воздухе молибден устойчив. Начинает окисляться при 400 °C. Выше 600 °C быстро окисляется до триоксида MoO3. Этот оксид получают также окислением дисульфида молибдена MoS2 и термолизом молибдата аммония (NH4)6Mo7O24·4H2O.
Mo образует оксид молибдена (IV) MoO2 и ряд оксидов, промежуточных между MoO3 и MoO2.
С галогенами Mo образует ряд соединений в разных степенях окисления. При взаимодействии порошка молибдена или MoO3 с F2 получают гексафторид молибдена MoF6, бесцветную легкокипящую жидкость. Mo (+4 и +5) образует твердые галогениды MoHal4 и MoHal5 (Hal = F, Cl, Br). С йодом известен только дийодид молибдена MoI2. Молибден образует оксигалогениды: MoOF4, MoOCl4, MoO2F2, MoO2Cl2, MoO2Br2, MoOBr3 и другие.
При нагревании молибдена с серой образуется дисульфид молибдена MoS2, с селеном — диселенид молибдена состава MoSe2. Известны карбиды молибдена Mo2C и MoC — кристаллические высокоплавкие вещества и силицид молибдена MoSi2.
Особая группа соединений молибдена — молибденовые сини. При действии восстановителей — сернистого газа, цинковой пыли, алюминия или других на слабокислые (pH=4) суспензии оксида молибдена образуются ярко-синие вещества переменного состава: Mo2O5·H2O, Mo4O11·H2O и Mo8O23·8H2O.
Mo образует молибдаты, соли не выделенных в свободном состоянии слабых молибденовых кислот, xH2O· MoO3 (парамолибдат аммония 3(NH4)2O·7MoO3·zH2O; CaMoO4, Fe2(MoO4)3 — встречаются в природе). Молибдаты металлов I и III групп содержат тетраэдрические группировки [MoO4].
При подкислении водных растворов нормальных молибдатов образуются ионы MoO3OH − , затем ионы полимолибдатов: гепта-, (пара-) Mo7O26 6− , тетра-(мета-) Mo4O13 2− , окта- Mo8O26 4− и другие. Безводные полимолибдаты синтезируют спеканием MoO3 с оксидами металлов.
Существуют двойные молибдаты, в состав которых входят сразу два катиона, например, M +1 M +3 (MoO4)2, M +1 5M +3 (MoO4)4. Оксидные соединения, содержащие молибден в низших степенях окисления — молибденовые бронзы, например, красная K0,26MoO3 и синяя K0,28MoO3. Эти соединения обладают металлической проводимостью и полупроводниковыми свойствами.
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Химия ПростоСкачать

Применение
Молибден используется для легирования сталей как компонент жаропрочных и коррозионностойких сплавов. Молибденовая проволока (лента) служит для изготовления высокотемпературных печей, вводов электрического тока в лампах накаливания. Соединения молибдена — сульфид, оксиды, молибдаты — являются катализаторами химических реакций, пигментами красителей, компонентами глазурей. Гексафторид молибдена применяется при нанесении металлического Mo на различные материалы, MoS2 используется как твёрдая высокотемпературная смазка. Mo входит в состав микроудобрений. Радиоактивные изотопы 93 Mo (T1/2 = 6,95 ч) и 99 Mo (T1/2 = 66 ч) — изотопные индикаторы.
Молибден — один из немногих легирующих элементов, способных одновременно повысить прочностные, вязкие свойства стали и коррозионную стойкость. Обычно при легировании одновременно с увеличением твёрдости растёт и хрупкость металла. Известны случаи использования молибдена при изготовлении в Японии холодного оружия в XI—XIII веках.
Молибден-99 используется для получения технеция-99, который используется в медицине при диагностике онкологических и некоторых других заболеваний. Общее мировое производство молибдена-99 составляет около 12 000 кюри в неделю (из расчёта активности на шестой день), стоимость молибдена-99 — 46 млн долларов за 1 грамм (470 долларов за 1 Ки).
В 2005 году мировые поставки молибдена (в пересчёте на чистый молибден) составили, по данным «Sojitz Alloy Division», 172,2 тыс. тонн (в 2003 году — 144,2 тыс. тонн). Чистый монокристаллический молибден используется для производства зеркал для мощных газодинамических лазеров. Теллурид молибдена является очень хорошим термоэлектрическим материалом для производства термоэлектрогенераторов (термо-ЭДС 780 мкВ/К). Трёхокись молибдена (молибденовый ангидрид) широко применяется в качестве положительного электрода в литиевых источниках тока.
Молибден применяется в высокотемпературных вакуумных печах сопротивления в качестве нагревательных элементов и теплоизоляции. Дисилицид молибдена применяется в качестве нагревателей в печах с окислительной атмосферой, работающих до 1800 °C.
Из молибдена изготовляются крючки-держатели тела накала ламп накаливания, в том числе ламп накаливания общего назначения.
Молибденовая проволока диаметром 0,05—0,2 мм используется в проволочных электроэрозионных станках для резки металлов с очень высокой точностью (до 0,01 мм), в том числе и заготовок большой толщины (до 500 мм). В отличие от медной и латунной проволоки, которые используются однократно в подобных станках, молибденовая — многоразовая (
300—500 метров хватает на 30—80 часов непрерывной работы), что несколько уменьшает точность обработки, но повышает её скорость и снижает её стоимость.
Видео:25. Схема реакции и химическое уравнениеСкачать

Биологическая роль
Физиологическое значение молибдена для организма животных и человека было впервые показано в 1953 году, с открытием влияния этого элемента на активность фермента ксантиноксидазы. Молибден промотирует (делает более эффективной) работу антиокислителей, в том числе витамина С. Важный компонент системы тканевого дыхания. Усиливает синтез аминокислот, улучшает накопление азота. Молибден входит в состав ряда ферментов (альдегидоксидаза, сульфитоксидаза, ксантиноксидаза и др.), выполняющих важные физиологические функции, в частности, регуляцию обмена мочевой кислоты. Молибденоэнзимы катализируют гидроксилирование различных субстратов. Альдегидоксидаза окисляет и нейтрализует различные пиримидины, пурины, птеридины. Ксантиноксидаза катализирует преобразование гипоксантинов в ксантины, а ксантины — в мочевую кислоту. Сульфитоксидаза катализирует преобразование сульфита в сульфат.
Недостаток молибдена в организме сопровождается уменьшением содержания в тканях ксантиноксидазы. При недостатке молибдена страдают анаболические процессы, наблюдается ослабление иммунной системы. Тиомолибдат аммония (растворимая соль молибдена), является антагонистом меди и нарушает её утилизацию в организме.
Круговорот азота
Молибден входит в состав активного центра нитрогеназы — фермента для связывания атмосферного азота (распространён у бактерий и архей).
Микроэлемент
Микроколичества молибдена необходимы для нормального развития организмов, используется в составе микроэлементной подкормки, в частности, под ягодные культуры.
Влияет на размножение (у растений).
Видео:Расчеты по уравнениям химических реакций. 1 часть. 8 класс.Скачать

Стоимость
На 2016 год стоимость молибдена составляет около 11 750 USD за тонну.
Видео:Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Физиологическое действие
Пыль молибдена и его соединений раздражает дыхательные пути, при длительном вдыхании — неизлечимое и необратимое заболевание (пневмокониоз). Также могут развиться полиартралгии, артрозы, гипотония, в крови может снизиться концентрация гемоглобина, число эритроцитов и лейкоцитов.
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||||||||||||||
| 1 | H | He | ||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| 8 | Uue | Ubn | Ubu | Ubb | Ubt | Ubq | Ubp | Ubh | Ubs |
Eu, Sm, Li, Cs, Rb, K, Ra, Ba, Sr, Ca, Na, Ac, La, Ce, Pr, Nd, Pm, Gd, Tb, Mg, Y, Dy, Am, Ho, Er, Tm, Lu, Sc, Pu,
Th, Np, U, Hf, Be, Al, Ti, Zr, Yb, Mn, V, Nb, Pa, Cr, Zn, Ga, Fe, Cd, In, Tl, Co, Ni, Te, Mo, Sn, Pb, H2,
W, Sb, Bi, Ge, Re, Cu, Tc, Te, Rh, Po, Hg, Ag, Pd, Os, Ir, Pt, Au
Видео:ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать

Молибден
Молибден это метал, простое вещество, микроэлемент, имеет формулу Мо, отличающиеся исключительной тугоплавкостью . В чистом виде он представляет собой плотные, твердые, белые и блестящие вещества.
Хорошо обрабатывается прокатной, штамповкой и другими способами. На воздухе покрывается плотной оксидной шлейкой и поэтому устойчив к действию обычных коррозионных агентов.
Видео:Химия | Тепловой эффект химической реакции (энтальпия)Скачать

Что такое молибден
(Molybdaenum; от греч. — свинец), Мо — химический элемент 6-й группы (химический элемент VI группы устаревший) периодической системы элементов; ат. н. 42, ат.м. 95,94.
Светло-серый тугоплавкий металл. В соединениях проявляет степени окисления +2, +3, +4, +5,+6. Природный молибден — смесь стабильных изотопов 92Мо (15,86%), 94Мо (9,12%), 95Мо (15,70)%, 96Мо (16,50%), 97Мо (9,45%), 98Мо (23,75%) и 100Мо (9,62%).
Получены 10 радиоактивных изотопов. Основной минерал молибдена — молибденит (молибденовый блеск) до 18 в. не отличали от графита и свинцового блеска из-за их внешнего сходства.
Близость радиусов обусловливает большее сходство молибдена с вольфрамом, чем этих металлов с хромом. Устойчивость степеней окисления у молибдена , чем у хрома.
Состояние +2 у него почти не встречается, а +3 для Мо , более устойчивы +4 и +6 (у некоторых соединений молибдена степень окисления +5 .
Сходство с элементами подгруппы VIA проявляется в образовании соединений SF6, WF6 , связи в которых в значительной степени ковалентны.
Видео:Проклятая химическая реакция 😜 #shortsСкачать

История открытия элемента
Молибден открыл (1778) швед, химик К .В. Шееле, выделивший при обработке молибденита азотной к-той молибденовую к-ту.
Металлический молибден впервые получил (1782) швед, химик П. Гьельм восстановлением трехокиси молибдена углеродом.
Промышленное применение молибдена относится к началу 20 в. (произ-во молибденовых сталей).
Видео:11-класс | Химия | Ртуть и благородные металлы. Титан и молибденСкачать

Физические свойства молибдена
Плотность (т-ра 20° С) 10,22 г/см3; tпл 2620° С; tкип около 4830° С. Теплота плавления 6,6 ± 0,7 ккал/г-атом , теплота сублимации 155,55 ккал/г-атом. Атомная теплоемкость (т-ра 25° С) 5,867 и (т-ра 1200° С) 7,430 кал/г-атом · град.
Удельная теплоемкость изменяется соответственно от 0,061 до 0,077 кал/г · град. Коэфф. теплопроводности (в интервале т-р 927 —1627° С) от 0,259 до 0,159 кал/см · сек · град, при т-ре — 183°С равен 0,438 кал/см · сек · град.
Средний температурный коэфф. линейного расширения в интервале т-р 0° С — температура плавления составляет αср•10 6 = 5,05 + 0,31 · 10 -3 t + 0,36 · 10 -6 t2.
Удельное электрическое сопротивление увеличивается от 5,20 · 10 -6 (т-ра 20° С) до 81,40 · 10 -6 ом · см (т-ра 2620° С), температурный коэфф. электр. сопротивления (в интервале т-р 20—2620° С) 0,00479.
Температура перехода молибдена в сверхпроводящее состояние 0,90—0,98 К. Работа выхода электронов 4,15—4,37 эв. Термоэдс от 10 (т-ра 480° С) до 30 мв (т-ра 1030° С). Молибден парамагнитен.
Механические свойства молибдена зависят от предшествующей мех. и термической обработки и чистоты металла. Молибден высокой чистоты с низким содержанием примесей внедрения пластичен.
Прочность на растяжение увеличивается с возрастанием степени деформации от 52,5 кгс/мм2 для прутка диаметром 6,2 мм до 250 кгс/мм2 для проволоки диаметром 0,02 мм.
Прочность на растяжение: спеченного штабика (0,02% 02; 0,04% N2) — 50 100 кгс/мм2; слитка дуговой плавки (0,003% О2 0,001% N2; 0,0003% Н2) — 57,1 кгс/мм2, монокристаллического М. (0,0008% 02; 0,0006% N2; 0,0004% Н2) — 31 кгс/мм2, микротвердость соответственно 150—200; 170—200 и 160—170 кгс/мм2.
Твердость поли 189,5;20 и 1857° С равна соответственно 373; 159,2 и 12,6 кгс/мм2. Модуль норм, упругости понижается от 32 300 кгс/мм2 при комнатной т-ре до 28 040 кгс/мм2 при т-ре 870° С. Коэфф. сжимаемости 0,347 · 10 -6 см2/кг.
Переходные металлы V, VI групп периодической системы и титан образуют с молибденом непрерывный ряд твердых растворов, металлы VII, VIII групп, цирконий и гафний — металлические соединения.
Видео:ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

Химические свойства молибдена
С переходными элементами III группы соединений или образования твердых растворов не наблюдается. Диаграммы состояния М. с элементами I, II групп и непереходными металлами III группы не изучены, иногда указывается на отсутствие соединений или растворимости металлов.
Бериллий, цинк, бор, алюминий, галлий и германий образуют с молибденом соединения. Неметаллические элементы IV—VI групп также образуют соединения, наиболее важные из них — карбиды, силициды, нитриды и сульфиды.
При низкой т-ре молибден не взаимодействует с воздухом и кислородом, окисление начинается при т-ре 400° С и сильно зависит от зернистости порошка.
Реагирует с галогенами, придем чем меньше их атомная масса, тем взаимодействие сильнее. Фтор действует на молибден при комнатной т-ре, йод не взаимодействует даже при нагреве.
Видео:МолибденСкачать

Молибден содержащие минералы
Содержание его в земной коре 1,1 · 10-4 %. Известны около 20 минералов молибдена. Из них наиболее часто встречаются в природе: молибденит, повеллит СаМоO4, молибдит Fe2 (МоO4)3 х nН2O, вульфенит РbМoО4, молибдошеелит Са (W, Мо)O4.
Чиллагит Рb(Мо, W)O4, кехлинит Bi2(МоO4)O2, линдгренит Сu (МоO4)2(ОН)2, ильземанит МоO3·SO3·5Н2O, ураномолибдат UO2 · UО3 · 2МоО3, эозит 3РbО х V2O4 · MoO3; белонезит MgMoO4 и патерзит СоМоO4. Пром. значение имеют молибденит, повеллит, молибдит и вульфенит.
Кристаллическая решетка молибдена объемноцентрированная кубическая с периодом а = 3,1466 А. Атомный радиус 1,39 А (для координационного числа 12); ионный радиус Мо+4 составляет 0,68 А, ионный радиус Мо+6 равен 0,62 А.
Видео:Химические уравнения. Как составлять химические уравнения.Скачать

Окисление молибдена кислотами щелочами
Соляная и серная к-ты в холодном состоянии не действуют на молибден, реакция начинается при т-ре 110° С. Азотная к-та и «царская водка» действуют уже в холодном состоянии, быстро — при нагревании.
Гидроокиси натрия и калия в холодном состоянии не реагируют с молибденом, в расплавленном состоянии растворяют его на воздухе медленно, при наличии окислителей — быстро.
В большинстве пром. месторождений молибдена содержание молибденита не превышает 1%. Руды молибдена обогащают главным образом флотацией, доводя Содержание MoS2 до 85—90%.
Разложение молибденовых концентратов может быть осуществлено окислением кислородом под давлением в щелочном растворе, азотной кислотой, растворами гипохлорита натрия, хлорированием и др.
Основной промышленный способ— окислительный обжиг. Огарок, содержащий МоО3, служит исходным материалом для выплавки ферромолибдене.
Молибден реагирует с кислотами: растворяется в «царской водке», горячих концентрированных соляной, серной и азотной, а также в окислительно -щелочных расплавах (например, в смеси NaOH И КОН).
Вода медленно окисляет порошкообразный молибден в сложную смесь гидратированных оксидов — «молибденовая синь»
С неметаллами молибден и реагирует при значительном нагревании, образуя прочные карбиды, силициды, сульфиды, галогениды и целый ряд оксидов , самыми устойчивыми из которых являются высшие МоО3 .
Им соответствуют соль Na2MoО4 молибденовой кислоты . В кислой среде анионы этих солей способны к конденсации, и образуется ряд полимолибденовых кислот. Состав растворов молибдатов и вольфраматов сильно зависит от pH среды .
Видео:Как за 4 МИНУТЫ выучить Химию? Химическое Количество, Моль и Закон АвогадроСкачать

Получение молибдена
Молибден в чистом виде из руд получить очень трудно. Поэтому чаше всего из полиметаллических или молибдено- и вольфрамово-железных руд выделяют ферромолибден — основное сырье для металлургической промышленности.
Анализ молибден содержащие минералы производят в специализированных предприятиях с помощью органического анализа.
Для получения чистых металлов его подвергают обжигу до оксидов или хлоридов и последующему восстановлению.
Чистую трехокись МоО3 получают возгонкой или гидрометаллургическим способом, обрабатывая огарок аммиаком, едким натром или содой.
Трехокись восстанавливают до металла водородом, углеродом, углеродсодержащими газами или металлотермическим восстановлением (алюминием, кремнием).
В промышленном произ-ве применяют в основном восстановление водородом, получая молибденовый порошок, к-рый превращают в компактные заготовки методами порошковой металлургии или плавкой.
Молибден получают также термической диссоциацией дисульфида молибдена, термической диссоциацией и восстановлением галогенидов молибдена, электролизом расплавленных сред и др.
Молибден производят в виде штабиков, проволоки, пластин, лент, фольги, жести и слитков.
Видео:Реакции ионного обмена. 9 класс.Скачать

Применение молибдена
Около 75% производимого молибдена используют для легирования чугуна и сталей (конструкционных, инструментальных, быстрорежущих, нержавеющих, для штампов, антикоррозионных и жаропрочных).
Молибден и молибдена сплавы применяют в электровакуумной, авиационной и ракетной технике, в производстве рентгеновских трубок, нагревательных элементов высокотемпературных печей.
Покрытие молибденом (см. Молибденирование) поверхности металлических изделий повышает твердость, поверхностную прочность, коррозионную стойкость и др.
Из соединений молибдена в технике используют дисульфид молибдена MoS2 — эффективный молибденовая смазка для трущихся частей механизмов (область использования от — 40 до 350° С).
Молибдат Na2MoО4 — в произ-ве красок и лаков; трисульфида MoS3, двуокись МоО2 и трехокись МоО3 т— катализаторы в хим. и нефтяной пром-сти, в частности при гидрировании углей и нефти.
Применение молибдена зависит от сферы его получения.
Молибден в медицине
Молибдену принадлежит видная роль в ряде биологических процессов. Он относится к числу микроэлементов, обладающих специфическим действием на растительные и животные организмы.
Спектральными исследованиями обнаружено его присутствие в клетках головного мозга млекопитающих. В азотфиксирующих бактериях он, по-видимому, входит в состав ферментов, обеспечивающих связывание атмосферного азота.
Повышение молибдена в почвах вредно влияет па состояние травоядных животных. Молибден один из виновников подагры. Он входит в состав фермента ксантиноксидазы, ускоряющей азотистый (в частности, пуриновый обмен) веществ.
В результате распада пуринов образуется мочевая кислота.
Если этой кислоты слишком много , почки не успевают выводить из организма, то соли ее скапливаются в суставах и мышечных сухожилиях, вызывая подагрическую боль.
Одно из соединений молибдена — молибдат аммония нашел в медицине специфическое применение. Он губителен для микроорганизмов и его используют в качестве дезинфицирующего средства. Им пропитывали ткани, чтобы уберечь их от гниения и продлить срок службы.
Потом оказалось, что это соединение может служить основой для получения тканей различных расцветок. Так из медицины молибдат аммония перекочевал в текстильную и лакокрасочную промышленность.
Часто задаваемые вопросы и ответы о молибдене?
Какая температура плавления молибдена?
Молибден является тугоплавким металлом с температурой плавления 2620 °C и температурой кипения 4639 °C.
Где применяется молибден?
Чистый монокристаллический молибден используется для производства зеркал для мощных газодинамических лазеров.
Теллурид молибдена является очень хорошим термоэлектрическим материалом для производства термоэлектрогенераторов (термо-ЭДС 780 мкВ/К).
Трёхокись молибдена (молибденовый ангидрид) широко применяется в качестве положительного электрода в литиевых источниках тока.
Какая у молибдена степень окисления?
Атомы молибдена в соединениях имеют степени окисления +2, +3, +4, +5,+6. Степень окисления — это условный заряд атома в соединении: связь в молекуле между атомами основана на разделении электронов, таким образом.
Если у атома виртуально увеличивается заряд, то степень окисления отрицательная (электроны несут отрицательный заряд), если заряд уменьшается, то степень окисления положительная.
Где в России добывают молибден?
В России молибден выпускают на Сорском ферромолибденовом заводе. Более 7 % от мировых запасов молибдена расположены в Армении, причем 90 % из них сосредоточены в Каджаранском медно-молибденовом месторождении.
Что такое молибден в породах?
Молибден в породах находится в следующих формах: молибдатной и сульфидной в виде микроскопических и субмикроскопических выделений, изоморфной и рассеянной (в породообразующих минералах).
Молибден обладает большим сродством с серой, чем с кислородом, и в рудных телах образуется сульфид четырёхвалентного молибдена — молибденит.
Какие основные свойства молибдена?
Рассматривая различные применения молибдена в качестве металла, наиболее важными свойствами следует считать плотность, температуру плавления, электрическое сопротивление, коэффициент линейного расширения.
МВ — сплав молибдена с вольфрамом. для молибдена характерна высокая коррозионная стойкость. Данный металл устойчив в большей части щелочных растворов, а также в серной, соляной и плавиковой кислотах при разных температурах и концентрациях.
Что такое чистый молибден?
Чистый молибден в 1817 году получил Й. Берцелиус восстановлением оксида водородом. Название происходит от др.-греч. μόλυβδος, означающего « свинец ».
Оно дано из-за внешнего сходства молибденита (MoS2 ), минерала, из которого впервые удалось выделить оксид молибдена, со свинцовым блеском (PbS).
Статья на тему молибден
Похожие страницы:
Понравилась статья поделись ей
Leave a Comment
Для отправки комментария вам необходимо авторизоваться.
Глава 3. Методы и методики получения молибдена и его соединений
3.1 Основы технологии переработки молибденовых руд
Основной метод обогащения молибденовых руд – флотация. Наиболее просто обогащаются руды жильных кварц молибденовых месторождений. В результате первоначальной коллективной флотации получают концентрат с 5 – 10% Мо [2, 8]. Селективную флотацию молибденита проводят затем при подавлении флотации других сульфидов. После переочисток получают стандартный концентрат с 80 – 90% MoS2 при общем извлечении до 90 – 95 % и выше. Низкосортные молибденовые концентраты и промежуточные продукты подвергают «химическому» обогащению, иначе говоря, гидрометаллургической переработке с получением в итоге молибдата кальция для ферросплавной промышленности. Такая комбинация флотационного обогащения и гидрометаллургической обработки позволяет экономичнее достигать большего извлечения молибдена из руды, чем это можно было бы сделать флотационными методами. Концентраты, содержащие молибден в виде молибденита, обрабатывают, прежде всего, для окисления серы сульфидов. С этой целью в промышленности наиболее часто прибегают к окислительному обжигу. Вместо обжига может применяться малораспространенная в заводской практике обработка сильными окислителями в водной среде: азотной кислотой, гипохлоритом, кислородом или воздухом под давлением, либо хлорирование [8]. Огарки, получаемые после обжига богатых и чистых концентратов, используют в производстве ферромолибдена, для получения чистой трехокиси методом возгонки и для химической переработки на чистые соединения молибдена. Последние, в свою очередь, могут использоваться для получения металла высокой чистоты. Огарки от обжига более бедных, низкосортных концентратов и промпродуктов обогащения обязательно подвергают химической переработке. В процессе обжига до 30 – 40% Мо и основная масса Re переходят в пыль и газы.
Первичная обработка в окисляющих растворах может быть применена для любых концентратов. Растворы, полученные после окислительного выщелачивания концентратов, очищают от примесей, после чего из них выделяют необходимые соединения молибдена и рения. Из полученных растворов чистые молибденовые и рениевые соединения могут быть селективно выделены ионообменом или экстракцией.
Химическую переработку «огарков» после обжига богатых высококачественных концентратов производят с целью получения чистых соединений молибдена – парамолибдата аммония и молибденового ангидрида [20, 23]. Из этих последних в случае необходимости легко получить любые другие соединения, в том числе и соединения высокой чистоты. Молибденовый ангидрид, находящийся в огарке, растворяется в растворах аммиака, щелочей, соды, некоторых кислот. Но щелочные металлы – нежелательные примеси для соединений молибдена, применяемых в электротехнической и химической промышленности. В щелочах, соде и кислотах растворяется большое число и других примесей.
Раствор аммиака обладает тем преимуществом, что в нем не растворимо большинство примесей, сопутствующих молибдену в огарке. Поэтому аммиачный способ переработки богатых молибденовых огарков более распространен. Его преимуществами, помимо высокого извлечения МоО3 в раствор и достаточно полного отделения примесей, являются простота дальнейшей очистки аммиачного раствора, легкость выделения молибдена в виде чистого парамолибдата аммония, простота подбора материала для аппаратуры. Схема аммиачного метода переработки огарков после обжига молибденита представлена на рис.3
Рис. 3. Cхема переработки огарков с кислотным разложение хвостов выщелачивания
Перед обработкой раствором аммиака рекомендуется промывать огарок водой для удаления растворимых в воде сульфатов (CuSO4, части CaSO4 и др.) и солей щелочных металлов. Но так как при этом несколько теряется молибден, то промывают не всегда. Потеря молибдена при промывке достигает 4 – 5% [20].
При обработке огарка аммиаком происходят реакции:
Аналогично молибдатам реагируют сульфаты меди, цинка, никеля и железа, если они образовались при обжиге. Железо (II) (в составе сульфата или окиси) частично реагирует по уравнению
и переходит в раствор в составе комплекса. Железо (III), образующееся в результате окисления Fe 2+ кислородом воздуха при обжиге и выщелачивании, частично остается в составе химически стойкого Fe3O4, частично дает нерастворимую гидроокись Fe(OH)3.
Остаются без изменения МоО2, СаМоО4, кварц, неокислившиеся при обжиге сульфиды. В аммиачные растворы в зависимости от минералогического состава концентрата и условий обжига переходит 80 – 95% молибдена. Для более полного перевода молибдена в раствор добавляют 60 – 80 кг (NH4)2CO3 на 1 т огарка. Влияние карбоната аммония на извлечение молибдена связано со следующими реакциями:
Растворимость CaSO4 и СаМоО4 соответственно 2 и 0,028 г/л при 20°С. Поэтому реакция смещена в сторону образования СаМоО4. Без добавки (NH4)2CO3 в процессе выщелачивания раствором аммиака сульфат кальция, образовавшийся в огарке в ходе обжига, превращается в СаМоО4, устойчивый в аммиачных растворах. Добавка (NH4)2CO3 ведет к образованию СаСО3 из CaSO4. Возможно и частичное растворение СаМоО4:
Осаждение СаСО3 на частицах CaSO4 затрудняет растворение последнего [20]. Осаждение его же на зернах СаМоO4 прекращает растворение последнего. Кроме того, благодаря наличию ионов СО 
В заводских условиях огарок выщелачивают 8 – 10%-ным раствором аммиака при 20 – 60° С [23]. Процесс проводят во вращающихся горизонтальных герметических стальных барабанах с шарами или в вертикальных реакторах с мешалками. Вращающиеся герметические барабаны более экономичный по извлечению молибдена, и по расходу аммиака процесс. Процесс в обоих случаях периодический и идет в несколько стадий, хотя в принципе возможна организация непрерывного или полунепрерывного выщелачивания в каскадах герметизированных реакторов. Раствор с первых стадий поступает на очистку и дальнейшее извлечение молибдена. Слабые растворы и промывные воды поступают на первую стадию. Общий расход аммиака на всех стадиях в зависимости от состава концентрата и аппаратуры колеблется в пределах 115 – 140% от теоретически необходимого количества. В крепких растворов плотность более 1,1 г/см 3 ,они содержат 140 – 190 г/л МоО3. Остатки от выщелачивания отфильтровывают на фильтрах непрерывного или периодического действия [8].
В последнее время предложено выщелачивать огарки аммиаком в кипящем слое. Это интенсифицирует выщелачивание и может осуществляться в непрерывном процессе.
Концентрированные растворы после фильтрования очищают от тяжелых металлов, осаждая их в виде сульфидов:
где Ме 2+ — Cu 2+ , Pb 2+ .
Fe 2+ частично осаждается в виде FeS, частично захватывается осадком других сульфидов. Благодаря очень малому произведению растворимости сульфидов, все тяжелые металлы осаждаются практически полностью. Это, в частности, можно наглядно наблюдать по исчезновению характерной интенсивной сине-фиолетовой окраски раствора. характерной для медно-аммиачного комплекса..
Из очищенного аммиачного раствора молибден может быть выделен:
1) кристаллизацией парамолибдата аммония;
2) осаждением тетрамолибдата;
3) осаждением молибденовой кислоты;
4) осаждением СаМоО4:
Кристаллизацию парамолибдата производят в несколько стадий. После первых стадий получается наиболее чистый продукт, но с небольшим выходом. Увеличения выхода достигают дальнейшей, более глубокой кристаллизацией, но при этом продукт получается более низкого качества. Молибденовая кислота частично растворима в кислотах и выделяется в виде трудно отстаивающихся и трудно промываемых осадков. Осаждение тетрамолибдата дает высокое извлечение молибдена и богатый молибденом продукт. Осадок его лучше отстаивается, но продукт требует переочистки. Осаждение СаМоО4 из аммиачных растворов нерационально, так как он применяется лишь при выплавке ферромолибдена и может быть получен более простым путем. Для других же целей требовалась бы дальнейшая химическая переработка СаМоО4. Введение иона Са 2+ усложняло бы дальнейшую очистку соединений молибдена.
Для осаждения парамолибдата аммония аммиачный раствор упаривают до 400 г/л МоО3, что соответствует плотности раствора 1,40 г/см 3 . В производственных условиях выпаривают сначала до плотности 1,20 – 1,23 г/см 3 . После этого дают отстояться дополнительно выпавшему осадку сульфидов Cu(II), Fe(II), Pb(II) и гидроокиси железа. Осадок отделяют, раствор упаривают далее. Горячий раствор фильтруют и направляют в кристаллизаторы. Кристаллизовать рациональнее при перемешивании и искусственном охлаждении. При этом выделяются более мелкие кристаллы, но процесс протекает быстрее. После первых двух операции получают продукт наивысшей чистоты [9, 17]. Последующие кристаллы более грязны. Их либо направляют на перекристаллизацию, либо квалифицируют более низшим сортом. Выпаривают и кристаллизуют в аппаратуре, стойкой против действия раствора аммиака.
3.3 Получение молибденовой кислоты Н2МоО4 или молибдата кальция СаМоО4
Остатки (отвалы) от выщелачивания раствором NH3 огарков, полученных после обжига богатых молибденовых концентратов, могут содержать до 20 – 25% Мо в составе соединений, не разлагаемых растворами аммиака, — СаМоО4, MoO2, MoS2. Молибден из остатков от выщелачивания извлекают одним из трех методов: 1) спеканием остатков (отвалов) с содой и последующим выщелачиванием спеков водой; 2) выщелачиванием растворами соды в автоклавах; 3) обработкой отвалов кислотами. В первых двух способах молибден переходит в раствор в составе Na2MoО4:
Из раствора Na2MoO4 молибден осаждается в составе молибдатов кальция или железа (после удаления избытка ионов СО 
Получаемые молибдаты кальция и железа (III) используются в промышленности ферросплавов. Кроме того, молибдат железа может быть разложен раствором аммиака:
Полученный аммиачный раствор после очистки перерабатывают на парамолибдат аммония. При кислотной обработке отвалов используется азотная или соляная кислота. Молибдаты разлагаются кислотами, выделяя молибденовую кислоту:
MOS2 и МоО2, оставшиеся в отвалах в результате неполного окисления концентрата при обжиге, окисляются при выщелачивании азотной кислотой, также образуя молибденовую кислоту:
При обработке отвалов на холоду соляной кислотой образующаяся молибденовая кислота переходит в раствор. Это удобно при переработке отвалов, содержащих значительное количество соединений вольфрама. Вольфрамат кальция соляной кислотой на холоду не разлагается. Таким образом можно в принципе частично разделять соединения вольфрама и молибдена. Поэтому солянокислая обработка рациональна, если в отвалах от аммиачного выщелачивания есть соединения вольфрама.
Режим и схема спекания отвалов с содой следующие. Смесь отвалов с содой спекают 6 – 9 частями при 700 – 750°С на поду пламенной печи. Спек выщелачивают водой. Пульпу фильтруют и промывают. Из фильтрата осаждают молибдаты железа или кальция (молибдат железа осаждается при рН 3,5 – 5). В осадке получается смесь молибдата и гидроокиси железа. Осадок выщелачивают раствором аммиака. Полученный раствор молибдата аммония перерабатывают на парамолибдат аммония обычным путем. Хвосты после выщелачивания осадка молибдата железа содержат 1 – 1,5% МоО3 и являются отвальными. Выщелачивают отвалы растворами соды в автоклавах при 180 – 200°С, что соответствует давлению 12 – 15 атмосфер. Автоклавный процесс рационален при низком содержании MoS2 и МоО2 в отвале [20].
3.4 Возгонка из огарков МоО3
Возгонка и испарение из расплава МоО3 применяются для получения чистого окисла [20, 23]. Возгонка начинается заметно с 800°С, расплав кипит при 1150°С. Способы возгонки и испарения МоО3 из расплава дают возможность получить чистый МоО3 по очень короткой схеме. Количество МоО3, испарившегося с поверхности расплава при 930°С за 1,5 ч (1,0 г/см 2 )10 -4 , за 4 ч (1,5 г/см 2 )10 -4 . Значительное влияние на возгонку МоО3 оказывают примеси. Это связано с образованием молибдатов, особенно Са и Mg, устойчивых при температуре испарения. Эти соединения растворяются в расплаве МоО3, понижая упругость его пара. Упругость пара молибдатов повышается с температурой, и перенос примеси увеличивается. Так, давление пара РbМоО4 при 1016°С 0,08, при 1060°С 0,23 мм. рт. ст. В процессе возгонки к порошку МоО3 добавляют кварц, облегчающий разгрузку невозогнанного остатка. В противном случае остаток МоО3 налипает на под и пропитывает его.
В промышленности при малом масштабе производства МоО3 при 1100 — 1200°С возгоняют в тигельных наклонных вращающихся электропечах, при большом масштабе – в карусельной электропечи с вращающимся подом и силитовыми нагревателями. На поду находится слой кварцевого песка. Воздух в тигли вдувают через трубку на поверхность испарения, а возгон выносится током воздуха из тигля через приемный зонт и трубопровод в приемные устройства. В карусельных печах воздух продувают над поверхностью пода; газы выносятся через отверстия в своде печи в общий приемный коллектор, далее в кулеры и мешочные фильтры. В печи есть две зоны: зона питания с загрузочными бункерами и зона возгонки с отверстиями для вывода возгона и пара. За один оборот пода возгоняется около 60% МоО3, имеющегося в огарке. Подовый остаток поступает на химическую переработку растворением или на выплавку ферромолибдена. За сутки печь дает 3,75 т чистой МоО3. Чистота зависит от температуры, состава исходного огарка и может быть достаточно высокой. Повышение температуры снижает чистоту возгона, которая колеблется от 99,5 до 99,75%.
Исходные для возгонки огарки получаются обжигом богаты и
чистых концентратов и содержат 80 – 90% МоО3. Для этого в концентратах должны быть не менее 60% молибдена,
5% SiO2 и сотые доли процента примесей металлов.
3.5 Получение гетерополикислот
Тетрамолибдат аммония, или, точнее, полимолибдат, так как состав осадка может отклоняться от формулы (NН4)2О∙4МоО3∙2Н2О, осаждают, нейтрализуя аммиачный раствор кислотой, непрерывно перемешивая, до рН 2,5 – 3,5; температуру поддерживают около 55°С [23]. При начальной концентрации раствора 280 – 300 г МоО3 на 1 л в осадок в составе полимолибдата выделяется 96 – 97% Мо, находившегося в растворе до нейтрализации. Необходимо быстро отделять осадок полимолибдата от маточного раствора, иначе может образовываться мелкокристаллическая труднофильтрующаяся безводная соль. Осадки достаточно чисты, так как примеси металлов, мышьяка, фосфора, серы остаются в основном в растворе.
В осадок полимолибдат увлекает большое количество ионов хлора и вольфрам. Перекристаллизацией полимолибдата в парасоль 3(NH4)2О ∙ 7МоО3 ∙ 4Н2О эти примеси удаляют. Для этого полисоль растворяют в 3 – 5 % -ном растворе аммиака при 70 – 80°С столько, чтобы плотность стала 1,41 – 1,42. Затем, охлаждая раствор до 15 – 20°С, кристаллизуют парамолибдат аммония:
В кристаллы выделяется до 60% всего молибдена, бывшего в растворе. Оставшийся маточный раствор без очистки используют для перекристаллизации ряда порций осадков полимолибдата.
Описанный метод переработки дает конечный продукт более высокой чистоты, чем просто парамолибдатный. Содержание примесей в конечном продукте (%): Fe 2- . В газовой фазе, помимо NО, находятся другие окислы азота и пары кислот. К концу разложения молибденита азотной кислотой в растворе содержится 15—25 г/л Мо. Растворимость Н2МоО4 в воде
Рис. 4. Получение молибдена с использованием азотной кислоты
Из азотнокислых растворов молибден можно выделить в зависимости от избытка кислоты, содержания молибдена и примесей экстракцией или осаждением ферромолибдата.
Окисление MoS2 гипохлоритом в растворах. Молибденит окисляется гипохлоритом кальция по реакции.
MoS2 + 9СlО — + 6ОН — = МоО 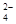
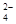
Реакция протекает со значительным выделением свободной энергии: ΔZ298= — 343, 6 ккал. Преимущества процесса гипохлоритного окисления – это избирательность окисления молибдена и полнота извлечения его в раствор при низкой температуре. Практический расход в 1,5 – 2 раза выше теоретического. В заводской практике способ не применяется.
Oкисление молибденита кислородом в автоклавах [20]. Окисление может производиться в растворах КОН, NH4ОН, NaOH, Na2CO3. Принципиальная реакция окисления кислородом проходит по уравнению
2MoS2 + 9O2 +2OH — = 2МоО 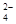

Окисление проходит через промежуточную стадию образования тиосульфата и гидроксокатиона молибдена (VI) [МоО2Н ] + . На степень перехода молибдена в раствор влияют давление, температура, концентрация щелочи. Скорость реакции зависит от концентрации ионов ОН — , поэтому она возрастает в ряду растворов аммиака→соды→щелочи. Ионы меди действуют на окисление каталитически: при концентрациимеди 100 мг/л скорость его в два раза выше, чем в отсутствие меди. Добавка меди позволяет снизить давление, температуру и время обработки.
При автоклавном окислении молибдено – медных промпродуктов (5,8 – 6,3% Мо и 6 – 9% Сu) рекомендуется проводить процесс в растворе соды или аммиака при 200°С, а в растворе едкого натра при 130 – 140°С и давлении кислорода соответственно 9 – 10 и 1 – 2 атмосфер. Работая с едким натром, кислород можно заменить сжатым воздухом. В растворах аммиака вместе с молибденом растворяется много меди, что нежелательно. При работе с содой образуется гидрокарбонат:
Избыток соды поэтому должен быть выше, чем щелочи. В качестве аппаратуры можно использовать автоклавы с механическим перемешиванием из нержавеющей стали специальных сортов . Автоклавное выщелачивание связано с трудностями подбора аппаратуры из-за образования больших количеств CaSO4 и в отношении техники безопасности.
Хлорирование молибденовых огарков, окисленных промежуточных продуктов и чистых соединений молибдена. Хлорирование – перспективный метод переработки низкосортных огарков, окисленных концентратов и промежуточных продуктов обогащения, окисленных руд, содержащих молибден. Хлорирование может также применяться для получения чистых хлоридов с целью выработки из них металлического молибдена методами диссоциации или металлотермии. Хлорировать можно хлором, летучими хлоридами (например, S2Cl2, ССl4), твердыми хлоридами. Хлорирование низкосортных концентратов, содержащих сульфиды, целесообразно применять к обожженным «огаркам» таких концентратов. Ректификацией продуктов хлорирования могут быть получены соединения высокой чистоты.
Ионный обмен в технологии молибдена может применяться для:
а) селективного извлечения Мо из основных растворов как относительно богатых им, так и бедных;
б) извлечения очень малых количеств Мо из сбросных растворов и промывных вод;
в) извлечения Мо из рудничных молибденсодержащих вод,
г) разделения Мо и Re в кислых растворах;
д) очистки молибденовых растворов от примесей тяжелых, щелочноземельных и щелочных металлов.
До настоящего времени наиболее широко распространено ионообменное извлечение молибдена из бедных маточных и сбросных растворов и промывных вод [20,11]. Остальные возможности применения ионитов в технологии молибдена весьма перспективны. Ионообменное извлечение из растворов после кислотной обработки бедных окисленных руд и концентратов – актуальная задача, так как эти руды и методы обработки приобретают большое промышленное значение.
Молибден сорбируется и катионитами, и анионитами. Большое практическое значение имеет сорбция молибдена на анионитах. Ион МоО2 2+ существует лишь в сильнокислых растворах, в которых одновременно могут сорбироваться и многие другие металлические ионы и где велика концентрация конкурирующего иона Н + . В этих условиях может вестись ионитная очистка молибденовых растворов от примесей тяжелых цветных, щелочных и других металлов. В сильнощелочной среде (рН = 8) молибден находится в форме неполимеризованного аниона МоО4 2- . Полная обменная емкость анионитов по молибдену в сильнощелочной среде ниже, чем при более низком рН, при котором молибден в растворе находится в виде полимеризованных, большого объема, ионов пара-, мета- и других полимолибдатов. Но большой объем этих ионов вносит пространственные затруднения в процесс сорбции: требуется, чтобы активные группы ионита были возможно менее экранированы другими элементами его структуры.
В слабокислой среде для сорбции молибдена из растворов эффективен сульфоуголь [20]. Захват им молибдена носит сорбционный характер, без обмена ионами. Активированный уголь также хорошо сорбирует молибден из бедных кислых растворов. Так, уголь марки КАУ (8, с. 415)для раствора, содержащего 0,144 г/л Мо и 0,1 моль/л H2SO4, показал динамическую обменную емкость (емкость до проскока – ДОЕ) 14 мг Мо на 1 г сорбента и полную обменную емкость (ПОЕ) 145 мг/г.
В технологии извлечения молибдена из растворов и их очистки используются и испытываются аниониты с разными основностью, структурой, пористостью. В слабокислой среде (рН 2 – 5) эффективно применение как сильноосновных, так и слабоосновных смол. В нейтральных и слабощелочных растворах обладают достаточной емкостью лишь сильноосновные смолы.
При 1,6 г/л Мо и рН раствора равном 3, сильноосновная смола АВ-16 показала ПОЕ-394 мг/г и коэффициент распределения по молибдену Kр=20615, а слабоосновной анионит АН-1 показал ПОЕ 233 мг/г и Kр= -3598. Но так как сильноосновные смолы прочнее удерживают молибден и для десорбции (элюирования или вымывания) из них требуются растворы более сильных щелочей (NaOH, КОН), а для вымывания со среднеосновной и тем более со слабоосновной смолы вполне достаточны 5 – 10%-ные растворы аммиака, то в практических условиях чаще находят применение средне- и слабоосновные аниониты. Применение раствора аммиака как элюента не вносит загрязнений щелочами и дает возможность получать более технологичные аммиачные соединения молибдена – поли — и парамолибдаты.
Для очистки аммиачно-молибденовых растворов от тяжелых металлов в полупромышленном масштабе использовали амфолиты. Амфолит – амфотерный сложный анионит, синтезированный из более простых анионитов с введением в них дополнительных органических групп. В результате получаются конденсированные продукты с крупной внутриструктурной и межструктурной пористостью и не полностью насыщенными связями. Разным соотношением реагентов при синтезе могут быть получены различные модификации амфолита, отличающиеся соотношением кислотных и основных групп.
Глава 4.Извлечение молибдена из отработанных руд методом экстракции
Степень извлечения молибдена из рудного сырья зависит не только от полноты химического вскрытия минерала и перевода молибдена в раствор, но и от полноты последующего извлечения его из растворов. В изложенных выше технологических схемах молибден извлекался из первичных растворов осаждением пара — и полимолибдата аммония, молибдата кальция, ферримолибдатов, а из бедных растворов и промывных вод – ионным обменом.
Сейчас наиболее экономичны и перспективны методы извлечения молибдена из растворов экстракцией и ионным обменом. Их достоинства:
1) полнота выделения полезного элемента из раствора;
2) селективность выделения элементов из комплексных растворов:
3) полнота отделения примесей;
4) простота аппаратурного оформления;
5) высокая производительность (причем производительность экстракции выше ионного обмена).
Извлечение молибдена из растворов и пульп экстракцией до настоящего времени находится на стадии укрупненных лабораторных и полупромышленных испытаний, показывающих в ряде случаев весьма перспективные результаты для промышленного использования [11, 13]. Этому способствует то, что молибден может находиться в растворах в разнообразных формах (катионы, анионы, полианионы, комплексные анионы). Молибденсодержащие ионы способны сольватироваться и давать комплексы со многими органическими соединениями. Поэтому возможна экстракция молибдена экстрагентами различных типов, анионо- и катионообменными, нейтральными. К первому типу экстрагентов относятся амины и четвертичные аммониевые основания, ко второму – алкилфосфорные кислоты, к третьему – спирты, кетоны, эфиры, в том числе трибутилфосфат.
Как показала практика [20], из анионообменных экстрагентов молибден достаточно успешно экстрагируется триоктиламином (сокращенно ТОА) (C8H17)3N и аммониевым основанием – диалкилметилбензиламмонийхлоридом [СН3—NR2—СН2С6Н5]Cl (так называемый дамбас). Молибден экстрагируется катионообменным экстрагентом Д2ЭГФК – ди-2-этилгексилфосфорной кислотой (С8Н17)2HPO4, экстрагентом нейтрального типа — трибутилфосфатом (C4H9)3PO4 (ТБФ), метилизобутилкетоном C5H12CO (МИБК), циклогексаноном (СН2)5СО и метилфенилкетоном (ацетофеноном) СН3СОС6Н5.
Указанные соединения отвечают требованиям, предъявляемым к экстрагентам: мало растворимы в воде, кипят при высоких температурах, большинство из них легче воды. Для понижения их вязкости, увеличения разности в плотности с водой и повышения температур воспламенения применяются они в виде растворов в керосине или других растворителях. Повышение температуры воспламенения особенно важно для применения циклогексанона и ацетофенона.
В табл. 2 дан предположительный состав экстрагируемых разными экстрагентами соединений
Таблица 2. Состав экстрагируемых веществ
| Кислотность исходного раствора | Экстрагент | Мольное отношение | Формула | ||
| pH | HCl, и. | [Mo] | экстрагент | Cl свя занный | |
| 3,0 | — | ТОА | 2,3 | — | (R3NH)2MoO4 |
| 1,0 | — | » | 0,97 | — | (R3NH)2 [Mo6O14 (OH)10] |
| — | » | 1,0 | 3,1 | (R3NH) [MoO2Cl3] | |
| 1,0 | — | Д2ЭГФК | 4,10 | — | MoO2 (R2PO4)2 ∙ 2HR3PO4 |
| — | ТБФ | 2,05 | 2,0 | MoO2Cl2 ∙ 2ТБФ | |
| — | » | 2,0 | 2,9 | [H30 (H20) ∙ ТБФ [MoO2Cl3 ∙ (H20)] | |
| — | МИБК | 3,0 | 3,0 | [H30 (H20) ∙ 3МИБК [MoO2Cl3 ∙ (H20)] |
С помощью экстракции можно решать ряд задач технологии молибдена:
а) повышение извлечения из бедных и сбросных растворов;
б) извлечение из растворов, получаемых при выщелачивании бедных руд и некондиционных концентратов;
в) отделение молибдена от вольфрама, что особенно важно в тех случаях, когда молибден находится в малом количестве по сравнению с близким ему по свойствам вольфрама.
Выводы
В результате выполнения данной работы можно сделать следующие выводы, которые позволят повысить выход молибдена из отработанных молибденовых руд и отходов производства, а также позволят использовать отходы молибденовой промышленности в народном хозяйстве:
Для получения особо чистого МоО3 необходимо использовать метод возгонки при высоких температурах, что позволит получить особо чистый МоО3, необходимый в металлургии и других отраслях промышленности
Для повышения выхода молибдена из отходов молибденовой промышленности можно использовать получение молибдена при помощи ионного обмена или экстракции органическими растворителями. Учитывая большой объем отходов можно предложить использовать ионный обмен, поскольку этот метод позволяет повторно использовать катиониты и аниониты и не требует сложной аппаратуры для улавливания паров органических растворителей.
Производительность метода экстракции для получения молибдена является большей, но требует строительства установок по поглощению паров органических растворителей и герметизации установок. Метод ионного обмена является технологически более простым, что будет предпочтительнее.
Отходы производства после выделения молибдена можно использовать в виде комплексных молибден содержащих удобрений в сельском хозяйстве, что позволит повысить урожайность зерновых.
Список использованной литературы
1. Ахметов Н.С. «Общая и неорганическая химия» М.: Высшая школа, 2001.
2. Берт Р.О. «Технология гравитационного обогащения» М.: Недра, 1990.
3. Бусев А. И. Аналитическая химия молибдена. М.: Издательство АН СССР, 1962, — 300с.
4. Васильев В. П. Аналитическая химия. В 2 кн. Кн. 2. Физико-химические методы анализа: Учеб. для студ. вузов, обучающихся по химико-технологическим специальностям – 2-е изд., перераб. и доп. — М.: Дрофа, 2002. — 384 с.
5. Глинка Н. Л. Общая химия. – Л.: Химия, 1988. – 702 с.
6. Гороновский И. Т., Назаренко Ю. П., Некряч Е. Ф. Краткий справочник по химии К.: Издательство АН СССР, 1962, 658 с.