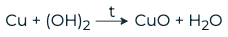- Содержание:
- Номенклатура оснований
- Классификация оснований
- Химические свойства щелочей (Щ)
- Химические свойства нерастворимых оснований
- Химические свойства амфотерных гидроксидов
- 2.5. Характерные химические свойства оснований и амфотерных гидроксидов.
- Химические свойства оснований
- Взаимодействие оснований с кислотами
- Взаимодействие с кислотными оксидами
- Взаимодействие оснований с амфотерными оксидами и гидроксидами
- Взаимодействие оснований с солями
- Термическая устойчивость оснований
- Химические свойства амфотерных гидроксидов
- Взаимодействие амфотерных гидроксидов с кислотами
- Взаимодействие амфотерных гидроксидов с кислотными оксидами
- Взаимодействие амфотерных гидроксидов с основаниями
- Взаимодействие амфотерных гидроксидов с основными оксидами
- Термическое разложение амфотерных гидроксидов
- Гидроксиды щелочных металлов (щелочи)
- Гидроксиды щелочных металлов (щелочи)
- Способы получения
- Химические свойства
- Молекулярные и ионные уравнения реакций взаимодействия гидроксидов с кислотой и щелочью
- 📺 Видео
Содержание:
Первое знакомство с основаниями состоялось при изучении взаимодействия воды с активными металлами и с оксидами активных металлов. В состав оснований входит одновалентная группа атомов OH (гидроксогруппа). Следовательно, основаниям можно дать следующее определение:
Основания – сложные вещества, в состав которых входят атомы металлов, соединенные с одной или нескольким группами атомов OH.
Общая формула оснований выглядит следующим образом: Ме (ОН)x, где Ме – металл; x – индекс.
Видео:Химия | Молекулярные и ионные уравненияСкачать

Номенклатура оснований
Название оснований включает в себя слово «гидроксид», названия металла и его валентности. Более того, для элементов с постоянной валентностью она не указывается.
Название основания = «Гидрооксид» + название Me + валентность (в скобках)
Видео:Щёлочи: химические свойства и способы получения #основания #гидроксиды #щелочи #химшкола #видеоурокСкачать

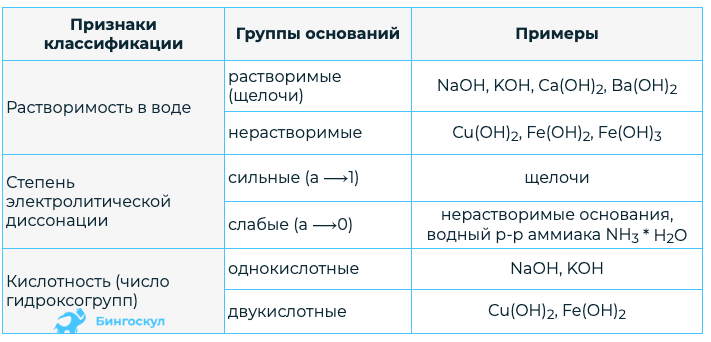
Классификация оснований
Все основания можно классифицировать по различным признакам. Рассмотрим это в нижеприведенной таблице.
Из таблицы мы видим, что наблюдается большое различие по некоторым признакам. В зависимости от этого, различные группы оснований, обладают не схожими химическими свойствами.
Видео:КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать

Химические свойства щелочей (Щ)
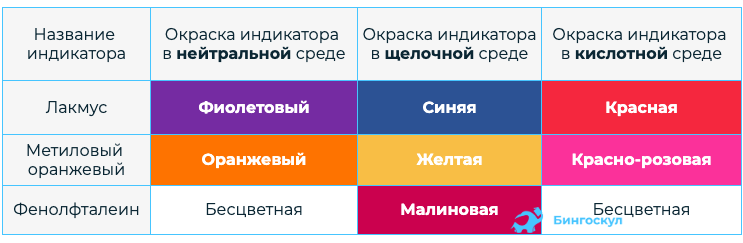
- Водные растворы Щ изменяют окраску индикаторов, тем самым можно определить реакцию среды.
Реакция нейтрализации заключается во взаимодействии основания и кислоты, ход которой можно проследить по изменению окраски индикаторов. Данная реакция характерна и для щелочей, и для нерастворимых оснований.
NaOH + HCl → NaCl + H2O
Для Щ характерны реакции с солями, в результате образуется другая соль и основание.
Могут вступать в реакции с кислотными оксидами, при этом образуется нерастворимая соль и вода.
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Химические свойства нерастворимых оснований
- Так же как и щелочи, могут изменять окраску индикаторов.
- Характерна реакция нейтрализации.
При нагревании разлагаются с образованием основного оксида и воды.
Видео:ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Химические свойства амфотерных гидроксидов
К амфотерным гидроксидам относятся сложные вещества, способные проявлять свойства кислот либо оснований при определенных условиях.
Формулы данных соединений можно представить в виде оснований и в виде кислот.
- ZnO — Zn(OH)2 ↔ H2ZnO2
- Al2O3 — Al(OH)2 ↔ H3AlO3
- GeO2 — Ge(OH)4 ↔ H4GeO4
- В нейтральной среде не растворяются и не диссоциируют на ионы. Способны разлагаться в кислотах и щелочах.
- При взаимодействии с кислотами образуется соль и вода.
В результате реакции со щелочами образуются те же соединения, что и в предыдущей реакции.
Способны взаимодействовать с основными оксидами
Так же как и щелочи взаимодействуют с солями.
Видео:Опыты по химии. Взаимодействие алюминия с кислотой и щелочьюСкачать
2.5. Характерные химические свойства оснований и амфотерных гидроксидов.
Прежде чем рассуждать о химических свойствах оснований и амфотерных гидроксидов, давайте четко определим, что же это такое?
1) К основаниями или основным гидроксидам относят гидроксиды металлов в степени окисления +1 либо +2, т.е. формулы которых записываются либо как MeOH , либо как Me(OH)2. Однако существуют исключения. Так, гидроксиды Zn(OH)2, Be(OH)2, Pb(OH)2, Sn(OH)2 к основаниям не относятся.
2) К амфотерным гидроксидам относят гидроксиды металлов в степени окисления +3,+4, а также в качестве исключений гидроксиды Zn(OH)2, Be(OH)2, Pb(OH)2, Sn(OH)2. Гидроксиды металлов в степени окисления +4, в заданиях ЕГЭ не встречаются, поэтому рассмотрены не будут.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать
Химические свойства оснований
Все основания подразделяют на:
Напомним, что бериллий и магний к щелочноземельным металлам не относятся.
Помимо того, что щелочи растворимы в воде, они также очень хорошо диссоциируют в водных растворах, в то время как нерастворимые основания имеют низкую степень диссоциации.
Такое отличие в растворимости и способности к диссоциации у щелочей и нерастворимых гидроксидов приводит, в свою очередь, к заметным отличиям в их химических свойствах. Так, в частности, щелочи являются более химически активными соединениями и нередко способны вступать в те реакции, в которые не вступают нерастворимые основания.
Взаимодействие оснований с кислотами
Щелочи реагируют абсолютно со всеми кислотами, даже очень слабыми и нерастворимыми. Например:
Нерастворимые основания реагируют практически со всеми растворимыми кислотами, не реагируют с нерастворимой кремниевой кислотой:
Следует отметить, что как сильные, так и слабые основания с общей формулой вида Me(OH)2 могут образовывать основные соли при недостатке кислоты, например:
Взаимодействие с кислотными оксидами
Щелочи реагируют со всеми кислотными оксидами, при этом образуются соли и часто вода:
Нерастворимые основания способны реагировать со всеми высшими кислотными оксидами, соответствующими устойчивым кислотам, например, P2O5, SO3, N2O5, с образованием средних солей:
Нерастворимые основания вида Me(OH)2 реагируют в присутствии воды с углекислым газом исключительно с образованием основных солей. Например:
С диоксидом кремния, ввиду его исключительной инертности, реагируют только самые сильные основания — щелочи. При этом образуются нормальные соли. С нерастворимыми основаниями реакция не идет. Например:
Взаимодействие оснований с амфотерными оксидами и гидроксидами
Все щелочи реагируют с амфотерными оксидами и гидроксидами. Если реакцию проводят, сплавляя амфотерный оксид либо гидроксид с твердой щелочью, такая реакция приводит к образованию безводородных солей:
Если же используют водные растворы щелочей, то образуются гидроксокомплексные соли:
В случае алюминия при действии избытка концентрированной щелочи вместо соли Na[Al(OH)4] образуется соль Na3[Al(OH)6]:
Взаимодействие оснований с солями
Какое-либо основание реагирует с какой-либо солью только при соблюдении одновременно двух условий:
1) растворимость исходных соединений;
2) наличие осадка или газа среди продуктов реакции
Термическая устойчивость оснований
Все щелочи, кроме Ca(OH)2, устойчивы к нагреванию и плавятся без разложения.
Все нерастворимые основания, а также малорастворимый Ca(OH)2 при нагревании разлагаются. Наиболее высокая температура разложения у гидроксида кальция – около 1000 o C:
Нерастворимые гидроксиды имеют намного более низкие температуры разложения. Так, например, гидроксид меди (II) разлагается уже при температуре выше 70 o C:
Химические свойства амфотерных гидроксидов
Взаимодействие амфотерных гидроксидов с кислотами
Амфотерные гидроксиды реагируют с кислотами:
Амфотерные гидроксиды металлов в степени окисления +3, т.е. вида Me(OH)3, не реагируют с такими кислотами, как H2S, H2SO3 и H2СO3 ввиду того, что соли, которые могли бы образоваться в результате таких реакций, подвержены необратимому гидролизу до исходного амфотерного гидроксида и соответствующей кислоты:
Взаимодействие амфотерных гидроксидов с кислотными оксидами
Амфотерные гидроксиды реагируют с высшими оксидами, которым соответствуют устойчивые кислоты (SO3, P2O5, N2O5):
Амфотерные гидроксиды металлов в степени окисления +3, т.е. вида Me(OH)3, не реагируют с кислотными оксидами SO2 и СO2.
Взаимодействие амфотерных гидроксидов с основаниями
Из оснований амфотерные гидроксиды реагируют только с щелочами. При этом, если используется водный раствор щелочи, то образуются гидроксокомплексные соли:
А при сплавлении амфотерных гидроксидов с твердыми щелочами получаются их безводные аналоги:
Взаимодействие амфотерных гидроксидов с основными оксидами
Амфотерные гидроксиды реагируют при сплавлении с оксидами щелочных и щелочноземельных металлов:
Термическое разложение амфотерных гидроксидов
Все амфотерные гидроксиды не растворимы в воде и, как любые нерастворимые гидроксиды, разлагаются при нагревании на соответствующий оксид и воду:
Видео:ОСНОВАНИЯ В ХИМИИ — Химические свойства оснований. Реакции оснований с кислотами и солямиСкачать
Гидроксиды щелочных металлов (щелочи)
Гидроксиды щелочных металлов (щелочи)
Способы получения
1. Щелочи получают электролизом растворов хлоридов щелочных метал-лов:
2NaCl + 2H2O → 2NaOH + H2 + Cl2
2. При взаимодействии щелочных металлов, их оксидов, пероксидов, гид-ридов и некоторых других бинарных соединений с водой также образуют-ся щелочи.
Например , натрий, оксид натрия, гидрид натрия и пероксид натрия при растворении в воде образуют щелочи:
2Na + 2H2O → 2NaOH + H2
Na2O + H2O → 2NaOH
2NaH + 2H2O → 2NaOH + H2
3. Некоторые соли щелочных металлов (карбонаты, сульфаты и др.) при взаимодействии с гидроксидами кальция и бария также образуют щелочи.
Например , карбонат калия с гидроксидом кальция образует карбонат кальция и гидроксид калия:
Химические свойства
1. Гидроксиды щелочных металлов реагируют со всеми кислотами (и сильными, и слабыми, и растворимыми, и нерастворимыми). При этом образуются средние или кислые соли, в зависимости от соотношения реагентов.
Например , гидроксид калия с фосфорной кислотой реагирует с образова-нием фосфатов, гидрофосфатов или дигидрофосфатов:
2. Гидроксиды щелочных металлов реагируют с кислотными оксидами . При этом образуются средние или кислые соли, в зависимости от соотношения реагентов.
Например , гидроксид натрия с углекислым газом реагирует с образованием карбонатов или гидрокарбонатов:
Необычно ведет себя оксид азота (IV) при взаимодействии с щелочами. Дело в том, что этому оксиду соответствуют две кислоты — азотная (HNO3) и азотистая (HNO2). «Своей» одной кислоты у него нет. Поэтому при взаимодействии оксида азота (IV) с щелочами образуются две соли- нитрит и нитрат:
А вот в присутствии окислителя, например, молекулярного кислорода, образуется только одна соль — нитрат, т.к. азот +4 только повышает степень окисления:
3. Гидроксиды щелочных металлов реагируют с амфотерными оксидами и гидроксидами . При этом в расплаве образуются средние соли, а в растворе комплексные соли.
Например , гидроксид натрия с оксидом алюминия реагирует в расплаве с образованием алюминатов:
в растворе образуется комплексная соль — тетрагидроксоалюминат:
Еще пример : гидроксид натрия с гидроксидом алюминия в растворе образует также комплексную соль:
4. Щелочи также взаимодействуют с кислыми солями. При этом образуются средние соли, или менее кислые соли.
Например : гидроксид калия реагирует с гидрокарбонатом калия с образованием карбоната калия:
5. Щелочи взаимодействуют с простыми веществами-неметаллами (кроме инертных газов, азота, кислорода, водорода и углерода).
При этом кремний окисляется щелочами до силиката и водорода:
Фтор окисляет щелочи. При этом выделяется молекулярный кислород:
Другие галогены, сера и фосфор — диспропорционируют в щелочах:
Сера взаимодействует с щелочами только при нагревании:
6. Щелочи взаимодействуют с амфотерными металлами , кроме железа и хрома . При этом в расплаве образуются соль и водород:
В растворе образуются комплексная соль и водород:
2NaOH + 2Al + 6Н2О = 2Na[Al(OH)4] + 3Н2
7. Гидроксиды щелочных металлов вступают в обменные реакции с растворимыми солями .
С щелочами взаимодействуют соли тяжелых металлов.
Например , хлорид меди (II) реагирует с гидроксидом натрия с образованием хлорида натрия и осадка гидроксида меди (II):
2NaOH + CuCl2 = Cu(OH)2↓+ 2NaCl
Также с щелочами взаимодействуют соли аммония.
Например , при взаимодействии хлорида аммония и гидроксида натрия образуются хлорид натрия, аммиак и вода:
NH4Cl + NaOH = NH3 + H2O + NaCl
8. Гидроксиды всех щелочных металлов плавятся без разложения , гидроксид лития разлагается при нагревании до температуры 600°С:
2LiOH → Li2O + H2O
9. Все гидроксиды щелочных металлов проявляют свойства сильных оснований . В воде практически нацело диссоциируют , образуя щелочную среду и меняя окраску индикаторов.
NaOH ↔ Na + + OH —
10. Гидроксиды щелочных металлов в расплаве подвергаются электролизу . При этом на катоде восстанавливаются сами металлы, а на аноде выделяется молекулярный кислород:
4NaOH → 4Na + O2 + 2H2O
Видео:Реакции ионного обмена. 9 класс.Скачать
Молекулярные и ионные уравнения реакций взаимодействия гидроксидов с кислотой и щелочью
Амфотерные гидроксиды (на примере гидроксидов цинка или алюминия).
Взаимодействие их с кислотами, щелочами, разложение при нагревании.
- определение
- взаимодействие с кислотами
- взаимодействие со щелочами
- разложение
Гидроксиды, которые проявляют свойства кислот и оснований, называются амфотерными. Их кислотные и основные свойства проявляются в реакциях со щелочами и сильными кислотами. В растворах тех и других амфотерные гидроксиды растворяются, отщепляя при взаимодействии с кислотами гидроксид-ионы, а при взаимодействии со щелочами – ионы водорода.
Амфотерные гидроксиды образуют переходные элементы, например, цинк, алюминий.
С кислотами амфотерные гидроксиды взаимодействуют как нерастворимые в воде основания, например: при взаимодействии гидроксида цинка с азотной кислотой образуются нитрат цинка и вода:
при взаимодействии гидроксида алюминия с азотной кислотой образуются нитрат алюминия и вода:
Со щелочами амфотерные гидроксиды взаимодействуют как нерастворимые в воде кислоты, например: при взаимодействии гидроксида цинка с гидроксидом натрия образуются цинкат натрия и
Zn(OH)2 + 2Na + + 2OH — = 2Na + + ZnO2 2- + 2H2O
при взаимодействии гидроксида алюминия с гидроксидом натрия образуются метаалюминат натрия и вода: Al(OH)3 + 2NaOH = NaAlO2 + 2H2O
Все амфотерные гидроксиды нерастворимы в воде, поэтому как нерастворимые основания при нагревании разлагаются на оксид и воду:
📺 Видео
Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать
ОКСИДЫ ХИМИЯ — Что такое Оксиды? Химические свойства Оксидов | Реакция ОксидовСкачать
Оксиды. Химические свойства. 8 класс.Скачать
Ионные уравнения реакций. Как составлять полные и сокращенные уравненияСкачать
Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать
СОЛИ ХИМИЯ 8 КЛАСС: Химические Свойства Солей и Получение // Реакция Солей с Кислотами и МеталламиСкачать
Опыты по химии. Получение и исследование амфотерных свойств гидроксида алюминияСкачать
Амфотерные гидроксиды | Химия ОГЭ 2022 | УмскулСкачать
Ионные уравнения | Химия 8 класс #42 | ИнфоурокСкачать
Амфотерные гидроксиды. Химия ОГЭ 2023 | TutorOnlineСкачать
8 класс. Основания.Химические свойства оснований.Скачать