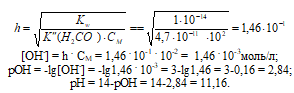Be(NO3)2 — соль образованная слабым основанием и сильной кислотой, поэтому реакция гидролиза протекает по катиону.
- Первая стадия (ступень) гидролиза
- Вторая стадия (ступень) гидролиза
- Среда и pH раствора нитрата бериллия
- Какое значение рН имеют растворы солей Bi(NO3)3, FeSO4, Na2SO3. Составьте молекулярные и ионные уравнения гидролиза
- Описание и исходные данные задания, 50% решения + фотография:
- Составьте молекулярные и ионные уравнения гидролиза солей Bi(NO3)3, BaCl2, Na2SO3.
- Как правильно написать в молекулярной и в ионно-молекулярной форме уравнения гидролиза солей
- 🎥 Видео
Видео:Гидролиз солей. 9 класс.Скачать

Первая стадия (ступень) гидролиза
Полное ионное уравнение
Be 2+ + 2NO3 — + HOH ⇄ BeOH + + NO3 — + H + + NO3 —
Сокращенное (краткое) ионное уравнение
Be 2+ + HOH ⇄ BeOH + + H +
Видео:Гидролиз солей. 1 часть. 11 класс.Скачать

Вторая стадия (ступень) гидролиза
Молекулярное уравнение
BeOHNO3 + HOH ⇄ Be(OH)2 + HNO3
Полное ионное уравнение
BeOH + + NO3 — + HOH ⇄ Be(OH)2 + H + + NO3 —
Сокращенное (краткое) ионное уравнение
BeOH + + HOH ⇄ Be(OH)2 + H +
Видео:Химия | Молекулярные и ионные уравненияСкачать

Среда и pH раствора нитрата бериллия
В результате гидролиза образовались ионы водорода (H + ), поэтому раствор имеет кислую среду (pH
Видео:Гидролиз солей. Классификация солей. Решение примеров.Скачать

Какое значение рН имеют растворы солей Bi(NO3)3, FeSO4, Na2SO3. Составьте молекулярные и ионные уравнения гидролиза






Чтобы получить решение , напишите мне в WhatsApp , оплатите, и я Вам вышлю файлы.
Кстати, если эта работа не по вашей теме или не по вашим данным , не расстраивайтесь, напишите мне в WhatsApp и закажите у меня новую работу , я смогу выполнить её в срок 1-3 дня!
Описание и исходные данные задания, 50% решения + фотография:
Какое значение рН имеют растворы солей Bi(NO3)3, FeSO4, Na2SO3. Составьте молекулярные и ионные уравнения гидролиза
Решение :
Bi ( NO 3 )3 – нитрат висмута — соль сильной кислоты и слабого основания, в водном растворе частично гидролизуется по катиону слабого основания:
Bi 3+ + H 2 O ↔ BiOH 2+ + H +
В водном растворе накапливаются катионы водорода, среда кислая, рН
| Если вам нужно решить химию, тогда нажмите ➔ помощь по химии. |
| Похожие готовые решения: |
- Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. KMnO4 + Na2SO3 + КОН → K2MnO4 + Na2SO4 + H2O P + HNO3 + H2O→ H3PO4+NO
- Могут ли происходить окислительно-восстановительные реакции между веществами: a) NH3 и КМnО4, б) HNO2 и HI; в) НС1 и H2Se? Почему? HCl +CrO3→ Cl2 + CrCl3 + Н2О Cd + KMnO4 +H2SO4 → CdSO4 + K2SO4 + Mn
- Какое значение рН (>или
Присылайте задания в любое время дня и ночи в ➔
Официальный сайт Брильёновой Натальи Валерьевны преподавателя кафедры информатики и электроники Екатеринбургского государственного института.
Все авторские права на размещённые материалы сохранены за правообладателями этих материалов. Любое коммерческое и/или иное использование кроме предварительного ознакомления материалов сайта natalibrilenova.ru запрещено. Публикация и распространение размещённых материалов не преследует за собой коммерческой и/или любой другой выгоды.
Сайт предназначен для облегчения образовательного путешествия студентам очникам и заочникам по вопросам обучения . Наталья Брильёнова не предлагает и не оказывает товары и услуги.
Видео:ГИДРОЛИЗ СОЛЕЙ | 9 класс | Кратко и понятноСкачать

Составьте молекулярные и ионные уравнения гидролиза солей Bi(NO3)3, BaCl2, Na2SO3.
| 🎓 Заказ №: 22173 |
| ⟾ Тип работы: Задача |
| 📕 Предмет: Химия |
| ✅ Статус: Выполнен (Проверен преподавателем) |
| 🔥 Цена: 153 руб. |
👉 Как получить работу? Ответ: Напишите мне в whatsapp и я вышлю вам форму оплаты, после оплаты вышлю решение.
➕ Как снизить цену? Ответ: Соберите как можно больше задач, чем больше тем дешевле, например от 10 задач цена снижается до 50 руб.
➕ Вы можете помочь с разными работами? Ответ: Да! Если вы не нашли готовую работу, я смогу вам помочь в срок 1-3 дня, присылайте работы в whatsapp и я их изучу и помогу вам.
⚡ Условие + 37% решения:
Составьте молекулярные и ионные уравнения гидролиза солей Bi(NO3)3, BaCl2, Na2SO3. Какое значение рН (рН 7, рН 7) имеют растворы этих солей? На основании табличных данных вычислите константы гидролиза по всем ступеням и сделайте вывод о том, какая ступень гидролиза протекает в большей степени. Сравните значения рН по всем ступеням.
Решение: Гидролизом называется обменная реакция вещества с водой. При этом происходит смещение равновесия диссоциации воды H2O H OH вследствие связывания одного из ионов (или обоих) с образованием малодиссоциирующего или труднорастворимого вещества. Гидролизу подвер-гаются соли, образованные либо слабой кислотой, либо слабым основанием, либо и тем и другим. Хлорид бария образован сильным основанием и сильной кислотой. В водных растворах хлорид бария не подверается гидролизу. Реакция среды нейтральная. рН = 7. Сульфит натрия образован сильным основанием и слабой кислотой. В растворе сульфита натрия гидролиз обусловлен анионами 2 SO3 , связывающими катионы водорода. Гидролиз проходит по двум ступеням. I ступень. Ионное уравнение гидролиза SO HOH HSO3 OH 2 3 Молекулярное уравнение гидролиза Na2 SO3 HOH NaHSO3 NaOH II ступень Ионное уравнение гидролиза HSO3 HOH H2 SO3 OH Молекулярное уравнение гидролиза NaHSO3 HOH H2 SO3 NaOH Константа гидролиза сульфита натрия по первой ступени равна отношению ионного произведения воды к константе диссоциации сернистой кислоты на 2 стадии 7 8 14 2 2 3 1 1,58 10 6,3 10 10 ( ) 2 K H SO K K Д H O Г Константа гидролиза сульфита натрия по второй ступени равна отношению ионного произведения воды к константе диссоциации сернистой кислоты на 1 стадии 13 2 14 1 2 3 2 6,25 10 1,6 10 10 ( ) 2 K H SO K K Д H O Г Таким образом, гидролиз сульфита натрия по первой ступени протекает в большей степени, чем по второй ступени. Избыток гидроксид-анионов обуславливает щелочную реакцию среды по каждой из ступеней, рН > 7. Точное значение рН можно вычислить, только зная концентрацию соли в растворе.
Научись сам решать задачи изучив химию на этой странице:
|
Услуги:
|
Готовые задачи по химии которые сегодня купили:




















































Образовательный сайт для студентов и школьников
Копирование материалов сайта возможно только с указанием активной ссылки «www.lfirmal.com» в качестве источника.
© Фирмаль Людмила Анатольевна — официальный сайт преподавателя математического факультета Дальневосточного государственного физико-технического института
Видео:Химия. Молекулярные и ионные уравненияСкачать

Как правильно написать в молекулярной и в ионно-молекулярной форме уравнения гидролиза солей
Задача 949.
Написать в молекулярной и в ионно-молекулярной форме уравнения гидролиза Na2СО3, КНСО3, (NH4)2СO3. Указать реакцию среды.
Решение:
а) Na2CO3 – соль сильного основания и слабой кислоты, гидролизуется по аниону:
При гидролизе соли образуется избыток ионов ОН – , которые придают раствору щелочную среду, рН > 7.
б) КНСО3 – кислая соль сильного основания и слабой кислотой гидролизуется по аниону:
При гидролизе соли образуется избыток ионов OH – , которые придают раствору щелочную среду, рН > 7.
в) (NH4)2СO3 – соль слабого основания и слабой кислоты, гидролизуется как по катиону, так и по аниону:
Гидролиз по аниону в основном протекает по 1-ой ступени. При гидролизе соли образуется дополнительное количество ионов Н + и ОН-, которые связываясь образуют молекулы Н2О ↔ Н + + ОН – ↔ Н2О. Раствор приобретает нейтральную среду, рН = 7. Но так как КDII(H2CO3) 4,7 . 10 -11 1.8 . 10 -5 , то преимущественно будет протекать гидролиз соли по аниону и в растворе будет наблюдаться некоторый избыток ионов ОН-, что придаёт ему слабощелочную среду, рН > 7.
Задача 950.
Вычислить рН 0,01 М раствора карбоната калия.
Решение:
К2СО3 – соль сильного основания и слабой кислоты гидролизуется по аниону:
Ответ: рН = 11,16.
Задача 951.
Для получения соды раствор NаОН разделили на две равные порции, одну из них насытили СО2, после чего смешали с другой порцией. Какое вещество образовалось после насыщения первой порции? Какая реакция произошла при смешении первой порции со второй? Написать уравнения реакций.
Решение:
При насыщении раствора едкого натра углекислым газом образуется гидрокарбонат натрия:
При смешивании растворов NaOH и NaHCO3 произойдёт реакция в результате которой образуется Na2CO3:
🎥 Видео
РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

составляем молекулярные уравнения по сокращённым ионнымСкачать

Ступенчатый гидролиз солей по аниону. Решаем примеры.Скачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

11 класс. Гидролиз солей.Скачать

Гидролиз солей. Теория для задания 23 ЕГЭ по химии.Скачать

Гидролиз солей.ПримерыСкачать

Гидролиз солей. 10 класс.Скачать

Реакции ионного обмена. 9 класс.Скачать

ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать

Гидролиз солей. Практическая часть. 10 класс.Скачать

Электролитическая диссоциация кислот, оснований и солей. 9 класс.Скачать

Химия | ГидролизСкачать

Гидролиз бинарных соединений. 11 класс.Скачать