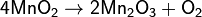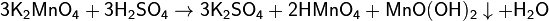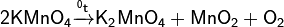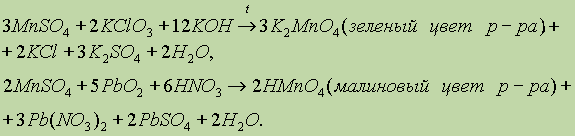| Гидроксид марганца II | |
|---|---|
| Систематическое наименование | Гидроксид марганца II |
| Традиционные названия | Гидроокись марганца |
| Хим. формула | Mn(OH)2 |
| Состояние | светло-розовые кристаллы |
| Молярная масса | 88,95 г/моль |
| Плотность | 3,258 г/см³ |
| Растворимость | |
| • в воде | 0,0002 г/100 мл |
| Показатель преломления | 1,681; 1,723 |
| Рег. номер CAS | 18933-05-6 |
| PubChem | 73965 |
| Рег. номер EINECS | 606-171-3 |
| SMILES | |
| ChEBI | 143901 |
| ChemSpider | 66594 и 23354143 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Гидроксид марганца II — неорганическое соединение, гидроксид металла марганца с формулой Mn(OH)2, светло-розовые кристаллы, не растворимые в воде.
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Содержание
Видео:How to write the equation for Mn(OH)2 + H2OСкачать

Описание
Гидроксид марганца II — студнеобразный светло-розовый осадок. Нерастворим в воде. Проявляет слабо основные свойства. Окисляется на воздухе.
Гидроксид марганца II образует светло-розовые кристаллы триклинной сингонии, пространственная группа P 3 m1, параметры ячейки a = 0,334 нм, c = 0,468 нм, Z = 1.
Видео:ОВР. Mn(OH)2+Cl2+KOHСкачать

Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Видео:Ni(OH)2+H2SO4=NiSO4+H2O Ионное и молекулярное уравнения реакции, демонстрация.Скачать  Оксиды и гидроксиды марганцаПолучение марганца Алюминотермическим методом, восстанавливая оксид Mn2O3, образующийся при прокаливании пиролюзита: Химические свойства При окислении на воздухе пассивируется. Порошкообразный марганец сгорает в кислороде: Марганец при нагревании разлагает воду, вытесняя водород: При этом слой образующегося гидроксида марганца замедляет реакцию. Марганец поглощает водород, с повышением температуры его растворимость в марганце увеличивается. При температуре выше 1200 °C взаимодействует с азотом, образуя различные по составу нитриды. Углерод реагирует с расплавленным марганцем, образуя карбиды Mn3C и другие. Образует также силициды, бориды, фосфиды. C соляной и серной кислотами реагирует по уравнению: С концентрированной серной кислотой реакция идёт по уравнению: С разбавленной азотной кислотой реакция идёт по уравнению: В щелочном растворе марганец устойчив. Оксиды и гидроксида марганца
Оксиды и гидроксиды марганца Соединения марганца (II).Оксид и гидроксид марганца (II) проявляют только основные свойства. Они нерастворимы в воде, но легко растворяются в кислотах с образованием солей двухвалентного марганца. Большинство солей двухвалентного марганца хорошо растворимы в воде и подвергаются гидролизу по катиону. К труднорастворимым солям относятся средние соли – сульфид, фосфат и карбонат. В кристаллическом состоянии соли марганца (II) имеют слабо розовую окраску, в водных растворах – практически бесцветны. Гидроксид двухвалентного марганца образуется косвенным путём – действием щёлочи на растворы солей. В момент образования образуется белый осадок (чаще наблюдаемый как телесный), который на воздухе постепенно буреет под действием кислорода воздуха: Оксид марганца (II) MnO — твердое вещество зеленого цвета — можно получить восстановлением оксида марганца (IV) в токе водорода: Соединения марганца (III).Соли трёхвалентного марганца окрашены в тёмный цвет и склонны к образованию комплексных солей (ацидокомплексов). Все соли марганца (III) малоустойчивы. В кислом растворе они легко восстанавливаются до солей марганца (II). В нейтральном растворе простые соли легко гидролизуются с образованием гидроксида Mn(III), который быстро переходит на воздухе в гидроксид марганца (IV). Гидроксид марганца (III) –Mn2O3 ּН2О или MnО(OH) встречается в природе в виде минерала манганита(бурая марганцевая руда). • В природе встречаются минералы браунит, курнакит и биксбиит — оксид марганца с различными примесями. • Окисление оксида марганца(II): • Восстановление оксида марганца(IV): Соединения марганца (IV).Оксид Mn(IV) наиболее устойчивое при обычных условиях кислородное соединение марганца.MnO2 и соответствующий ему гидроксид практически нерастворимы в воде. Получение оксида марганца 4: · В лабораторных условиях получают термическим разложением перманганата калия. · но реакция, в действительности, следует по уравнению: · Также можно получить реакцией перманганата калия с пероксидом водорода. · При температуре выше 100 °C перманганат калия восстанавливается водородом: Химические свойства 1)При сплавлении оксида марганца (IV) (пиролюзит) со щелочами в присутствии кислорода образуются манганаты: 2) Хлорид марганца(II) – в безводном состоянии представляет собой листочки светло-розового света и получается при обработке марганца, его оксида или карбоната сухим хлороводородом MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O (по этой реакции в лабораториях получают хлор) 3) MnO2 + KClO3 + 6KOH = 3K2MnO4 + KCl + 3H2O (реакция идет при сплавлении) Гидроксид марганца (IV) проявляет амфотерный характер– кислотный и основной в равн Диоксид марганца в лаборатории можно получить прокаливанием на воздухе Mn(NO3)2: Соединения марганца (VI).Оксид шестивалентного марганца в свободном виде не выделен. Гидроксид марганца (VI) проявляет кислотный характер. свободная марганцевая (VI) кислота неустойчива и диспропорционирует в водном растворе по схеме: Манганаты (VI) образуются при сплавлении диоксида марганца со щёлочью в присутствии окислителей и имеют изумрудно-зелёную окраску. В сильно щелочной среде манганаты (VI) довольно устойчивы. При разбавлении щелочных растворов происходит гидролиз, сопровождающийся диспропорционированием: Манганаты (VI) – сильные окислители, восстанавливающиеся в кислой среде доMn(II), а в нейтральной и щелочной средах – доMnO2. Под действием сильных окислителей манганаты (VI) могут быть окислены доMn(VII): При нагревании выше 500 о С манганат (VI) распадается на продукты: манганат (IV) и кислород: Соединения марганца (VII).Оксид марганца (VII) – Mn2O7 выделяется в виде темно-зеленой маслянистой жидкости при действии концентрированной серной кислоты на перманганат калия: Оксид марганца (VII) устойчив до 10 о С и разлагается со взрывом по схеме: При взаимодействии Mn2O7с водой образуется марганцовая кислотаHMnO4, которая имеет фиолетово-красную окраску: Безводную марганцовую кислоту получить не удалось, в растворе она устойчива до концентрации 20 %. Это очень сильная кислота, кажущаяся степень диссоциации в растворе концентрации 0,1 моль/дм 3 равна 93 %. Марганцовая кислота – сильный окислитель.Еще энергичнее взаимодействуетMn2O7, горючие вещества при соприкосновении с ним воспламеняются. Оксид марганца(VII) Mn2O7 – марганцевый ангидрид представляет собой зелено-бурое тяжелое масло, получающееся при действии концентрированной серной кислоты на твердый перманганат калия: 1)Раствор манганата имеет тёмно-зелёный цвет. При подкислении протекает реакция: 2) При прокаливании перманганаты разлагаются с выделением кислорода (один из лабораторных способов получения чистого кислорода). Реакция идёт по уравнению (на примере перманганата калия): 3) Под действием сильных окислителей ион Mn 2+ переходит в ион MnO4 − : 5)Перманганаты как в кислой, так и в щелочной средах окисляют органические вещества: 7) Все соли марганца (II) в ОВР, протекающих в растворах, являются восстановителями: 8) Соли марганца (II) не гидролизуются, образуя прочные аквакомплексы: 9) Mn(CN)2 – нерастворимое соединение белого цвета, за счет комплексообразования растворяется в присутствии KCN: 4KCN + Mn(CN)2 = K4[Mn(CN)6] гексоцианоманганат калия Применение цветов: 🎥 ВидеоХимические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать  Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать  Получение НЕРАСТВОРИМЫХ ОСНОВАНИЙ - Cu(OH)₂, Ni(OH)₂, Mn(OH)₂, Fe(OH)₂, Co(OH)₂, Mg(OH)₂, Fe(OH)₃,Скачать  Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать  РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать  Уравнения химический реакций на ОГЭ: как составлять без ошибок?Скачать  Расчеты по уравнениям химических реакций. 1 часть. 8 класс.Скачать  Как выучить Химию с нуля за 10 минут? Принцип Ле-ШательеСкачать  Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать  ЗАДАЧИ ГОДОВОГО ЦИКЛА - какие задачи ставит новый годовой кармический циклСкачать  Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать  Экзо- и эндотермические реакции. Тепловой эффект химических реакций. 8 класс.Скачать  Reacciones de Precipitación. Experimento de Química.Скачать  Самые красивые химические реакции - образование Сu(OH)₂Скачать  Решение цепочек превращений по химииСкачать  Качественные реакции с гидроксидами Cu(OH)2, Fe(OH)3, Fe(OH)2, Al(OH)3, Mg(OH)2, NH4OH, Ag2OСкачать  |