Биогеотехнология металлов (биогидрометаллургия) – это наука об извлечении металлов из руд, концентратов, горных пород и растворов под воздействием микроорганизмов или их метаболитов при нормальном давлении и температуре от 5 до 80 – 90 °С.
Наиболее ранние сведения о выщелачивании меди встречаются в записях об античных горных производствах. Около 160 г. до н.э. К. Гален (натуралист и врач) сообщил о методе выщелачивания меди в древних медных рудниках острова Кипр. В 1497 г. в северном районе Венгрии получали медь из растворов, поступающих из руды, методом цементации на железном скрапе. В 1566 г. там же осуществили полный цикл выщелачивания с использованием системы орошения. На территории Германии выщелачивание меди из отвалов практиковалось также в XVI в.
Извлечение меди из растворов, поступающих из шахт медно-колчеданных месторождений, активно практиковали на Урале в середине 40 – 50-х годов XX в. В 1949 г. на Урале было добыто 5 730 т меди из сточных вод.
В 60-е годы в Канаде начали промышленное подземное выщелачивание урана. В настоящее время разработкой и освоением биогидрометаллургических технологий занимается более 100 фирм и организаций в 25 странах мира.
Открытие микроорганизмов, важных для биогеотехнологии металлов.Исследования русского ученого С. Н. Виноградского в конце XIX в. в области литотрофии стимулировали изучение роли микроорганизмов в круговороте серы и других элементов в природе. В 1902 г. крупнейший голландский микробиолог М. Бейеринк выделил новый автотрофный микроорганизм Thiobacillus thioparus, окисляющий серу и ряд ее восстановленных соединений при высоких значениях рН среды.
В 1921 – 1922 гг. В. Рудольф и А. Хельброннер впервые провели исследования на рудниках, которые показали, что некоторые неидентифицированные сероокисляющие микроорганизмы способны окислять пирит и сульфиды цинка.
В это же время С. А. Ваксман и Дж. С. Джоффи выделили автотрофный ацидофильный микроорганизм Thiobacillus thiooxidans (ныне Acidithiobacillus thiooxidans), окисляющий серу и ряд ее восстановленных соединений до серной кислоты. Предположения о возможной роли бактерий в образовании серной кислоты в шахтных водах в угольных месторождениях впервые были высказаны Л. Карпентором и Дж. Херндоном в 1933 г. В настоящее время известен ряд хемолитотрофных бактерий, важных для биогидрометаллургии. В практике добычи металлов особое внимание уделяется бактериям A. ferrooxidans, A. thiooxidans, A. caldus и Leptospirillum ferrooxidans, которые окисляют Fe 2+ , S 2- , S° и сульфидные минералы.
Определенный интерес представляют ацидофильные гетеротрофные бактерии Acidiphilium cryptum, Ac. angustum, Ac. rubrum и Ac. facilis. Они способствуют выщелачиванию металлов хемолитотрофными бактериями.
Физико-химические основы выщелачивания металлов из руд. Бактериально-химическое выщелачивание – извлечение химических элементов из минералов, руд, концентратов и горных пород посредством их окисления и/или растворения микроорганизмами или продуктами их метаболизма. Основными физико-химическими факторами при кучном, подземном и чановом выщелачивании меди, цинка, никеля, урана являются рН, Eh, температура, наличие кислорода, ионов сернокислого оксидного железа (Fe 3+ ) и т.д. От совокупности благоприятных факторов (рН 1,2 – 2,0; Eh 700 мВ, и др.) зависит активность сообщества бактерий, окисляющих сернокислое закисное железо (Fe 2+ ), серу (S°, S 2+ ) и сульфидные минералы.
Химические реакции, происходящие в процессе бактериального окисления:


Образующиеся продукты этой реакции (Fe 2+ , S° и др.) окисляются бактериями до конечных продуктов:


Продукты этой и подобных ей реакций окисляются бактериями до Fe 3+ или H2SO4. Таким образом, эти бактериально-химические процессы едины и создают низкую величину рН, высокий окислительно-восстановительный потенциал среды, необходимую концентрацию Fe 3+ и обеспечивают активные процессы выщелаивания металлов из руд. Следует отметить особые окислительные свойства Fe 3+ в кислой среде в отношении вторичных сульфидных минералов меди, цинка и некоторых минералов никеля (окисное железо является сильным окислителем и растворителем сульфидов).
Механизм бактериального окисления Fe 2+ , S 2- /S° и сульфидных минералов.Хемолитотрофные бактерии окисляют неорганические субстраты и получают энергию в соответствии с хемиосмотической теорией Митчела, а также по электрохимическим (коррозионным) механизмам (рис 11.1).
Рис.11.1. Модель функционирования железоокисляющей системы A. ferrooxidans и транспорта электронов
Бактериальное окисление субстратов включает следующие стадии:
· взаимодействие поверхностных структур бактерий с окисляемым субстратом (сорбция, адгезия);
· изменение физико-химических свойств окисляемых субстратов и их транспорт в клеточную стенку;
· окисление субстратов в поверхностных структурах клеток;
· транспорт электронов и протонов; образование мембранного потенциала;
· синтез АТФ и образование воды на внутренней поверхности ЦПМ.
Кучное и подземное выщелачивание меди.Бактериально-химическое выщелачивание цветных металлов проводят из отвалов бедной руды (кучное) и из рудного тела в месте залегания (подземное). Более распространено кучное выщелачивание меди. Технологические схемы приведены на рис.11.2.
Орошение дробленой руды в отвале или в рудном теле осуществляется водными растворами H2SO4, содержащими Fe 3+ , O2 и бактерии. При нормальной и пониженной температуре процессы окисления сульфидных минералов при рН 1,0 – 2,0 катализируют хемолитотрофные бактерии A. ferrooxidans, A. thiooxidans, L. ferrooxidans и F. acidiphilum.
Рис.11.2 Процесс кучного выщелачивания:
1 – куча; 2 – поверхность почвы; 3 – прудок для сбора продуктивных растворов; 4– насос; 5 – желоба для цементации; 6 – прудок для отработанного раствора; 7– насос; 8 – система орошения отвала; 9 – металл
В зонах разогрева руды в результате экзотремических окислительных процессов при температуре 55 °С широко распространены умеренно-термофильные бактерии p. Sulfobacillus и A. caldus. При температуре выше 50 °С в окислительных процессах участвуют термофильные бактерии p. Acidianus и Metallosphaera.
Растворы подаются через скважины при подземном выщелачивании металлов или путем разбрызгивания, или создания прудков на поверхности отвалов при кучном выщелачивании металлов. В руде в присутствии окислителей (бактерии, О2, Fe 3+ ) и при оптимальных условиях орошения руды сульфидные минералы окисляются, а цветные металлы в кислой среде переходят в растворимое состояние.
Металлы из растворов извлекают:
· цементацией. Цементацияв цветной металлургии, гидрометаллургический процесс, основанный на вытеснении более электроположительных металлов из растворов их соединений менее электроположительными металлами, находящимися в твёрдом состоянии. Разность потенциалов позволяет осуществлять реакцию, например:
Чем больше разность потенциалов, тем меньше остаточное содержание в растворе осаждаемого металла
· концентрируют методом экстракции и затем извлекают электролизом.
После извлечения ценных элементов растворы опять поступают на орошение руды (схема замкнутая).
Переработка сложных руд и концентратов в реакторах (чановое выщелачивание).Процесс извлечения металлов из концентратов с использованием бактерий и осуществляемый в специальных аппаратах называется чановым. Он проводится в аппаратах, обеспечивающих перемешивание, аэрацию и регуляцию температурного режима в пульпе и предназначен для использования в комбинированных технологических схемах, включающих операции – гравитацию или флотацию, бактериальное окисление сульфидных минералов и переработку твердых остатков и растворов.
Бактериально-химическое окисление концентратов проводят в непрерывных условиях в серии последовательно соединенных реакторов с перемешиванием и аэрацией при 30 °С для мезофилов, от 45 – 40 °С для умеренных термофилов и 60 – 70 °С для облигатных термофилов.
Концентрат измельчают до размеров частиц 40 – 70 мкм, помещают в контактный чан и создают плотность пульпы от 20 до 40 % твердого вещества. После постепенного заполнения всех реакторов система работает в непрерывном проточном режиме. Схема переработки концентратов может быть замкнутой. Оборотные растворы после частичной или полной регенерации используют для выщелачивания или сбрасываются в хранилище.
Влияние технологических условий на процесс выщелачивания металлов. Размеры частиц и плотность пульпы. Размеры частиц руды или концентрата определяют площадь их поверхности, от которой зависит адгезия бактерий и скорость окислительных процессов. Наибольшая скорость окисления сульфидов в пульпе A. ferrooxidans при чановом выщелачивании наблюдается при размерах частиц от 2 – 3 до 40 мкм, однако в промышленных условиях обычно используются частицы флотационного концентрата размером 74 мкм. Частицы меньше 0,2 мкм повреждают структуру клетки, и FeS2 не окислялся.
При кучном и подземном выщелачивании металлов тонкое измельчение руды невозможно, так как с крупностью материала в тесной связи находится водопроницаемость и аэрация руды.
Плотность пульпы (соотношение твердого вещества к жидкому) при чановом выщелачивании зависит от типа концентрата или промпродукта. Переработку цинксодержащих продуктов мезофильными бактериями можно проводить при плотности пульпы 16 – 40 %, медных концентратов – до 30 %. Вскрытие золота в золото-мышьяковых концентратах эффективно проводится при плотности пульпы до 20 %.
Влияние химических элементов.Токсичность металлов для бактерий зависит от физиологического состояния бактерий, химического состояния металлов и степени их взаимодействия в среде. К наиболее токсичным катионам относят Cd, Ag, Hg и U. Анионы Se, Те, As и Mo более токсичны, чем большинство катионов металлов. Калий снижал токсичность серебра. Токсичность металлов снижается в присутствии комплексующих агентов. Например, добавление цистеина предотвращает ингибирование A. ferrooxidans Ag + . В целом A. ferrooxidans высокоустойчив к отдельным металлам: Сu – 50 г/л; Zn – 70 мг/л; Со – 30 г/л; As – 6–10 г/л; Мо – 200 мг/л; А1 – 20 г/л; Ni – 72 г/л; Ag – 1,0–10 мг/л; Cd – 120 мг/л; U3Og – 12 г/л. Резистентность других хемолитотрофов к металлам изучена недостаточно.
Источники питания.Важнейшими элементами для жизнедеятельности хемолитотрофных бактерий в биогидрометаллургии являются азот и фосфор. Как при чановом, так и при кучном и подземном выщелачивании металлов другие необходимые для бактерий элементы поступают из руды или концентратов. Азот и фосфор обычно либо отсутствуют, либо присутствуют в низких количествах, причем они постоянно выводятся из среды, вступая в реакции с другими элементами с образованием фосфатов железа и т.д., и поэтому требуется их постоянное добавление. С солями азота и фосфора поступает и калий. При замене в традиционных средах солей азота, фосфора и калия на аммофос снижается их стоимость в 10 раз без изменения.
Влияние микробиологических факторов.Штамм А. ferrooxidans является устойчивым в технологических условиях, который адаптирован к комплексу факторов (рН, ионы металлов, тип минерала и т. д.), а не к какому-либо одному из них. Этот тезис оказался справедливым и для других хемолитотрофов. В рудах и концентратах обычно присутствуют сообщества хемолитотрофных и некоторых ацидофильных гетеротрофных бактерий. В технологических условиях в окислении Fe 2+ , S 2- /S° и сульфидных минералов принимает участие сообщество бактерий. Хотя, как уже отмечалось выше, в зависимости от условий существует лидер или несколько штаммов-лидеров.
Влияние температуры.При снижении температуры до 15 о С средняя удельная скорость роста различных штаммов A. ferrooxidans уменьшалась в 2,8 – 4 раза, а средняя скорость окисления Fe 2+ – в 2,3 – 3 раза. При снижении температуры до 8 °С эти величины уменьшались в 6,1 – 13,3 и 4,5 – 8,0 раз соответственно. Роль термофильных бактерий в биогидрометаллургии изучена еще слабо. В отвалах руд, богатых сульфидными минералами, при их окислении происходит разогрев вплоть до самовозгорания. Из этих руд выделяются умеренно- и экстремально-термофильные бактерии.
При спонтанном разогреве руд в отвалах можно ожидать положительного эффекта от деятельности термофильных бактерий.
Экологические аспекты выщелачивания металлов. При рассмотрении экологических проблем биогидрометаллургии следует прежде всего иметь в виду технологические особенности этого способа добычи металлов. Все технологические схемы замкнутые, поэтому в значительной мере исключают выброс растворов в биосферу. Исключаются выбросы вредных газов в атмосферу. Подземное выщелачивание исключает необходимость отвода больших участков земли под горные предприятия, при этом сохраняется ландшафт. В кучном выщелачивании утилизируют металлы старых отвалов и вновь отсыпаемых, тем не менее каждый тип выщелачивания имеет свои отходы, опасные для окружающей среды. Общим для всех гидрометаллургических предприятий отходом являются растворы, содержащие тяжелые металлы. Обычно растворы, которые выводятся из оборота, нейтрализуются и сбрасываются в специальные прудки, а затем, после естественной доочистки, в реки. При такой операции они в значительной мере очищаются от металлов. Однако и эти воды нуждаются в полной очистке от металлов. Микробиологические способы сорбции и осаждения металлов, по-видимому, являются наиболее перспективными для решения этой проблемы. Некоторые из них испытаны в промышленных условиях.
Не менее актуальна также проблема обезвреживания твердых отходов биогидрометаллургических производств, например соединений мышьяка (арсенат железа или кальция), цианидов, роданидов и т. д., однако она окончательно еще не решена.
ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ:
1. Что такое биогеотехнология металлов.
2. Характеристика микроорганизмов, важных для биогеотехнологии металлов.
3. Физико-химические основы выщелачивания металлов из руд. .
4. Химические реакции, происходящие в процессе бактериального окисления:
5. Механизм бактериального окисления Fe2+, S2- /S° и сульфидных минералов.
6. Стадии бактериального окисления субстратов?
7. Кучное и подземное выщелачивание меди.
8. Что такое цементация в цветной металлургии.
9. Влияние технологических условий на процесс выщелачивания металлов.
10. Экологические аспекты выщелачивания металлов.
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
1. Беккер, М.Е.Введение в биотехнологию/М.Е. Беккер. – М.: Пищевая промышленность, 1978. – 231 с.
2. Березин, И.В. Инженерная энзимология/ И.В. Березин, А.А.Клесов, В.К.Швядас. – М.: Высшая школа, 1987. – 144 с.
3. Березин, И.В. Иммобилизованные ферменты/И.В. Березин, Н.Л.Клячко, А.В.Левашев и др. – М.: Высшая школа, 1987. – 160 с.
4. Богданова, О.Ю. Основные питательные среды для культивирования микроорганизмов. Приготовление питательных сред/О.Ю. Богданова, Е.В. Макаревич// Методические указания к выполнению лабораторной работы. – Мурманск МГТУ, 2002. – 38 с.
5. Быков, В.А. Микробиологическое производство биологически активных веществ и препаратов/В.А. Быков, И.А. Крылов, М.Н. Манаков. – М.: Высшая школа, 1987. – 142 с.
6. Быков, В.А. Производство белковых веществ/В.А. Быков, М.Н. Манаков, В.И. Панфилов. – М.: Высшая школа, 1987. – 142 с.
7. Вербина, Н.М. Микробиология пищевых производств /Н.М. Вербина, Ю.В. Каптерова. – М.: Агропромиздат, 1988. – 288 с.
8. Голубовская, Э.К. Биологические основы очистки воды/Э.К. Голубовская. – М.: Высшая школа, 1978. – 270 с.
9. Гусев, М.В. Микробиология: Учебник для студ. биол.специальностей. /М.В. Гусев, Л.А. Минеева. – 4-е изд., стре. – М.: Изд. центр «Академия», 2003. – 464 с.
10. Жвирблянская, А.Ю. Микробиология в пищевой промышленности/А.Ю. Жвирблянская, О.А. Бакушинская. – М.: Пищевая промышленность, 1975. – 501 с.
11. Егоров, Н.С. Основы учения об антибиотиках/Н.С. Егоров. – М.: Высшая школа, 1986. – 448 с.
12. Егорова, Т. А. Основы биотехнологии/ Т. А. Егорова, С.М. Клунова, Е.А. Живухина// Учебное пособие. – М.: Академия, 2003. – 208 с.
13. Елдышев, Ю.Н. Современная биотехнология/Ю.Н. Елдышев. – М:Тайдекс Ко, 2004.
14. Литвинова, М.Ю. Ведение в биотехнологию/ М.Ю. Литвинова// Методические указания к лабораторным работам по дисциплине «Введение в биотехнологию». – Мурманск МГТУ, 2006.
15. Макаревич, Е.В. Микроорганизмы заквасок кисломолочных продуктов/Е.В. Макаревич, М.Ю. Литвинова// Методические указания. – Мурманск МГТУ, 2008.
16. Макаревич, Е.В.Гидромикробиологический анализ сточных вод/Е.В. Макаревич, М.Ю. Литвинова//Методические указания. – Мурманск МГТУ, 2008. – 32 с.
17. Макаревич, Е.В. Микробиологическая деструкция ксенобиотиков/Е.В. Макаревич// Методические указания. – Мурманск МГТУ, 2008.
18. Мюнх, Г.Д. Микробиология продуктов животного происхождения/Г.Д. Мюнх, Х.Заупе, М. Шрайтер. – М.: Агропромиздат, 1985. – 592 с.
19. Нетрусов, А.И. Экология микроорганизмов/А.И. Нетрусов. – М.: Академия, 2004. –267 с.
20. Определитель бактерий Берджи /Под ред. Дж. Хоулта, Н. Крига, П. Смита и др.//В 2 т.: Пер. с англ. – М.: Мир,1997.
21. Промышленная микробиология/Под ред. Егорова Н.С. – М.: Высшая школа, 1989.
22. Хиггинс, И. Биотехнология. Принципы и применение /И. Хиггинс, Д. Бест, Дж. Джонс. – М.: Мир, 1988. – 480 с.
- Микробиологические методы получения металлов уравнения
- Добыча металлов микробиологическими методами
- Микробиологические методы получения металлов уравнения
- Таблица Менделеева
- Универсальная таблица растворимости
- Коллекция таблиц к урокам по химии
- Общая характеристика и способы получения металлов
- Пирометаллургия
- Гидрометаллургия
- Электрометаллургия
- 📺 Видео
Видео:Получение металлов. 9 класс.Скачать

Микробиологические методы получения металлов уравнения
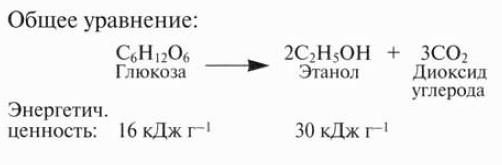
В Бразилии с 1975 г. успешно производят этанол, который используется в качестве горючего. Исходным материалом является сахарный тростник. После сбора урожая тростник измельчают и получают сок. Из сока экстрагируют сахарозу, которая является коммерческим продуктом, однако при этом остается сироп (меласса), содержащий глюкозу и фруктозу. Мелассу можно использовать как исходный материал для ферментации с помощью дрожжей Saccharomy-ces cerevisiae. Этанол перегоняют, чтобы очистить от других продуктов ферментации. В качестве горючего при перегонке используют сухой волокнистый материал, который остается после измельчения сахарного тростника.
Некоторые бразильские автомобили могут работать на чистом спирте, однако обычно к этанолу подмешивают небольшое количество бензина, чтобы исключить его употребление людьми. В 1985 г. было произведено более 11 млрд. дм3 этанола. Производство с целью сохранения бразильской валюты было начато в 1983 г., когда выросли цены на нефть. С тех пор потребление бензина снизилось на 20%. Некоторые автомобили в Бразилии и США могут работать на смеси спирта и бензина, которая называется газохол (рис. 12.24). В США в качестве исходной биомассы для получения этанола используют крахмал из кукурузы. В середине 1980-х гг. его производилось более 2280 млн. дм3 ежегодно.
Несмотря на то что бразильская схема, казалось бы, была удачной, не все идет гладко. Продолжаются дебаты о наиболее экономически выгодном использовании мелассы и о том, не могут ли другие сельскохозяйственные культуры быть более подходящим источником углеводородов. Например, мелассу можно было бы использовать вместо нефти в качестве сырого материала при производстве пластмасс.
Добыча металлов микробиологическими методами
Необходимые человеку металлы, такие как медь, железо, уран, золото, свинец, никель и кобальт, в природе встречаются в виде минералов, которые называют также рудами. В местах, где эти руды сконцентрированы в большом количестве, их добывают, а затем извлекают из них металлы. Только недавно в процессе очистки металлов стал использоваться огромный потенциал микроорганизмов. В качестве примера, иллюстрирующего основные принципы, рассмотрим добычу меди.
Медь — один из первых металлов, использованных человеком. Бронза, представляющая собой сплав меди и олова, была впервые получена более 5000 лет назад; ее широкое применение, когда она ценилась за прочность, режущие свойства, а также за декоративность, послужило основанием для присвоения тому времени названия «бронзовый век». В природе медь обычно встречается в виде сульфидов меди. К примеру, более 50% мировой добычи приходится на пирит CuFeS2, который содержит также железо и серу. Добывать медь из руды очень сложно. Однако давно известно, что медь можно извлечь из воды, которая просачивается через горные породы, содержащие медные руды. Сейчас известно, что этот процесс выщелачивания металлов происходит под действием бактерий. Бактерии превращают нерастворимые металлические соединения в растворимые, например в сульфат меди, из которого гораздо легче экстрагировать медь.
Бактерия, которая играет главную роль в процессе выщелачивания металлов, была идентифицирована в 1947 г. как Thiobacillus ferrooxi-dans. Другие важные бактерии — Т. thiooxidans и Leptospirillum ferrooxidans — растут в кислой среде и способны работать при высоких температурах. Они получают энергию, окисляя неорганические субстраты. Например, Т. ferrooxidans получает энергию за счет окисления содержащегося в руде Fe2+ до Fe3+ и восстановленных форм серы, таких как сульфиды, до серной кислоты. Т. ferrooxidans является автотрофом и по классификации относится к хемоавтотрофам, или хе-мосинтетическим бактериям (табл. 2.3).
Бактериальное выщелачивание сейчас используют во всем мире как дополнительный метод выделения металлов из руд, главным образом медных и урановых (рис. 12.25). В выщелачивании участвуют несколько видов бактерий, каждый из которых вносит свой уникальный вклад. Более 10% меди, выделенной в США в 1983 г., стоимостью более 300 млн. долл. было получено с использованием этого метода. Преимущества бактериального выщелачивания заключаются в следующем:
1. Можно использовать руды низкого качества. При обычных методах выделения металлов, которые очень дорогостоящи, целесообразно использовать только очень богатые металлом руды. Поэтому после использования обычных методов в районе разработок оставалось много потенциального продукта.
2. Если получать металл методом бактериального выщелачивания, можно обойтись без глубоких разработок. Горную породу сначала дробят с помощью взрывных зарядов, а затем закачивают в нее выщелачивающий раствор. По окончании выщелачивания раствор, содержащий растворимые соли металлов, выкачивают из скважин, пробуренных внутри горной породы. Такой метод требует меньше затрат; при его использовании существенно не нарушается окружающая среда, как при глубоких разработках, когда на поверхность выносят большие количества горной породы и образуются горы отходов.
3. Традиционные методы экстракции меди из руды требуют высоких температур. Эти методы дорогостоящи, потребляют ископаемое топливо и, следовательно, загрязняют воздух, вызывая, например, кислотные дожди. (Возможно, бактериальное выщелачивание можно будет в будущем использовать для очистки ископаемого топлива путем выщелачивания соединений серы.)
4. Неконтролируемое выщелачивание из отходов горных разработок привело к загрязнению близлежащих водоемов тяжелыми металлами. Этого можно избежать контролируемым выщелачиванием и извлечением металлов. Подсчитано, что в отвалах горных разработок только на западе США содержится более 33 млн. т меди. Обычно отвалы размещают в долинах, и поэтому металлы могут разноситься речными водами на большие расстояния. Воду, содержащую растворимые выщелоченные металлы, можно собирать у плотины ниже по течению и закачивать на фабрику, которая занимается добычей металлов. Если требуется, то очищенную воду можно повторно возвращать в отвал.
Видео:Химия 11 класс (Урок№10 - Общая характеристика и способы получения металлов.)Скачать

Микробиологические методы получения металлов уравнения
ХИМИЯ – это область чудес, в ней скрыто счастье человечества,
величайшие завоевания разума будут сделаны
именно в этой области.(М. ГОРЬКИЙ)
Таблица
Менделеева
Универсальная таблица растворимости
Коллекция таблиц к урокам по химии
Видео:способы получения металловСкачать

Общая характеристика и способы получения металлов
Значительная химическая активность металлов (взаимодействие с кислородом воздуха, другими неметаллами, водой, растворами солей, кислотами) приводит к тому, что в земной коре они встречаются главным образом в виде соединений: оксидов, сульфидов, сульфатов, хлоридов, карбонатов и т. д. В свободном виде встречаются металлы, расположенные в ряду напряжений правее водорода (Аg, Нg, Рt,Аu, Сu), хотя гораздо чаще медь и ртуть в природе можно встретить в виде соединений.
Минералы и черные породы, содержащие металлы и их соединения, из которых выделение чистых металлов технически возможно и экономически целесообразно, называют рудами.
Получение металлов из руд — задача металлургии.
Металлургия — это и наука о промышленных способах получения металлов из руд, и отрасль промышленности.
Любой металлургический процесс — это процесс восстановления ионов металла с помощью различных восстановителей. Суть его можно выразить так:
Чтобы реализовать этот процесс, надо учесть активность металла, подобрать восстановитель, рассмотреть технологическую целесообразность, экономические и экологические факторы.
В соответствии с этим существуют следующие способы получения металлов:
Видео:Химия 9 класс : Получение металловСкачать

Пирометаллургия
Пирометаллургия — восстановление металлов из руд при высоких температурах с помощью углерода, оксида углерода (II), водорода, металлов — алюминия, магния.
Например, олово восстанавливают из касситерита SnО2, а медь — из куприта Cu2O
прокаливанием с углем (коксом):
SnО2+ 2С = Sn + 2СО ↑; Cu2O + С = 2Cu+ СО ↑
Сульфидные руды предварительно подвергают обжигу при доступе воздуха, а затем полученный оксид восстанавливают углем:
2ZnS + 302 = 2ZnО + 2SO2 ↑; ZnО + С = Zn + СО ↑
сфалерит (цинковая обманка)
Из карбонатных руд металлы выделяют также путем прокаливания с углем, т. к. карбонаты при нагревании разлагаются, превращаясь в оксиды, а последние восстанавливаются углем:
FeСO3 = FеО + СO2 ↑ ; FеО + С = Fе + СО ↑
сидерит (шпатовый железняк)
Восстановлением углем можно получить Fе, Сu, Zn, Сd, Ge, Sn, Рb и другие металлы, не образующие прочных карбидов (соединений с углеродом).
В качестве восстановителя можно применять водород или активные металлы:
К достоинствам этого метода относится получение очень чистого металла.
2) TiO2+ 2Мg = Тi + 2МgO (магнийтермия)
Чаще всего в металлотермии используют алюминий, теплота образования оксида
которого очень велика (2А1 + 1,5 O2 = Аl2O3 + 1676 кДж/моль). Электрохимический ряд напряжений металлов нельзя использовать для определения возможности протекания реакций восстановления металлов из их оксидов. Приближенно установить возможность этого процесса можно на основании расчета теплового эффекта реакции (Q), зная значения теплот образования оксидов:
где Q1— теплота образования продукта, Q2 -теплота образования исходного вещества.
Доменный процесс (производство чугуна):
C + O2 = CO2, CO2 + C ↔ 2CO
3Fe2O3 + CO = 2(Fe 2 Fe 3 2)O4+ CO2
(Fe 2 Fe 3 2)O4+ CO= 3FeO + CO2
FeO + CO= Fe + CO2
(чугун содержит до 6,67% углерода в виде зерен графита и цементита Fe3C);
Выплавка стали (0,2-2,06% углерода) проводится в специальных печах (конвертерных, мартеновских, электрических), отличающихся способом обогрева. Продувание воздуха, обогащенного кислородом, приводит к выгоранию из чугуна избыточного углерода, а также серы, фосфора и кремния в виде оксидов. При этом оксиды либо улавливаются в виде отходящих газов (CO2, SO2), либо связываются в легко отделяемый шлак – смесь Ca3(PO4)2 и CaSiO3. Для получения специальных сталей в печь вводят легирующие добавки других металлов.
Видео:Галилео. Металлургия (часть 1)Скачать

Гидрометаллургия
Гидрометаллургия — это восстановление металлов из их солей в растворе.
Процесс проходит в два этапа: 1) природное соединение растворяют в подходящем реагенте для получения раствора соли этого металла; 2) из полученного раствора данный металл вытесняют более активным или восстанавливают электролизом. Например, чтобы получить медь из руды, содержащей оксид меди СuО, ее обрабатывают разбавленной серной кислотой:
Затем медь либо извлекают из раствора соли электролизом, либо вытесняют из сульфата железом:
Таким образом, получают серебро, цинк, молибден, золото, уран.
Видео:Бактериологический метод МИКРОБИОЛОГИЯ: культуральный метод, посев на питательные среды микраСкачать

Электрометаллургия
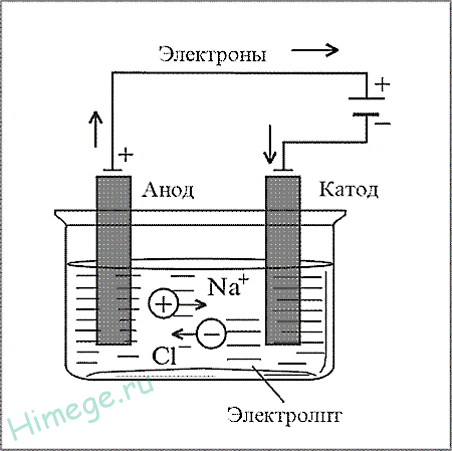
Электрометаллургия — восстановление металлов в процессе электролиза растворов или расплавов их соединений.
Этим методом получают алюминий, щелочные металлы, щелочноземельные металлы. При этом подвергают электролизу расплавы оксидов, гидроксидов или хлоридов.
а) NaCl (электролиз расплава) → 2Na + Cl2
📺 Видео
Коррозия металла. Химия – ПростоСкачать

Химические свойства металлов. 9 класс.Скачать

§12, 9 кл. Получение металловСкачать

5. Первый этап бактериологического методаСкачать

Химия 11 класс (Урок№13 - Сплавы металлов.)Скачать

Способы получения металлов (пирометаллургия, гидрометаллургия, электролиз)Скачать

Общая характеристика металлов. 9 класс.Скачать

Химия. 9 класс. Получение металлов /04.12.2020/Скачать

Методы микробиологической диагностикиСкачать

Математика это не ИсламСкачать

Микробиология за 7 минутСкачать

Метод иммуноблоттинга (ИБ) | Микробиология/БиохимияСкачать