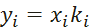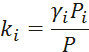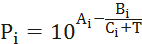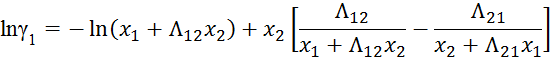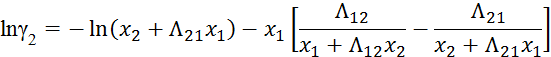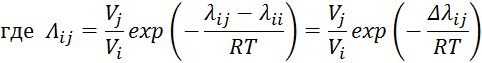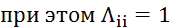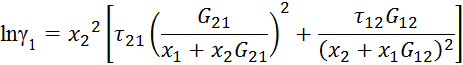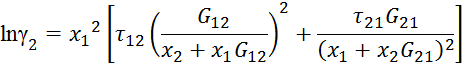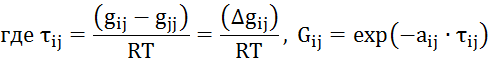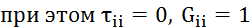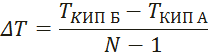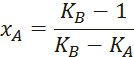Давлением насыщенного пар (Рн) – называют величину давления при котором пар находится в термодинамическом равновесии с жидкостью того же состава. То есть давление пара над зеркалом жидкости, при котором не происходит испарение жидкости, а так же не происходит конденсация пара.
Величина Pн является необходимым параметром для расчета интенсивности испарения жидкости и используется для определения массы облака горючего, которое может образоваться при возникновении аварийной ситуации.
Давление насыщенного пара зависит от температуры окружающего воздуха. Одним из возможных способов определения давления насыщенного пара является расчет с помощью уравнения Антуана, приведенного в Пособии к НПБ 105-95 «Определение категорий помещений, зданий и наружных установок по взрывопожарной и пожарной опасности» и имеющего вид:
Pн — давление насыщенного пара кПа;
tp — расчетная температура o C;
A, B, CA — константы Антуана.
На данной странице вы можете рассчитать величину Pн с помощью констант Антуана, для различных значений температуры, для основных горючих веществ. Так же приведены основные показатели пожарной опасности горючих веществ, а именно: молярная масса, температура вспышки, теплота сгорания и др.
- Инструкция
- ХИМИЯ НЕФТИ
- ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА
- Определение давления насыщенных паров
- Статический метод
- Динамический метод
- Метод насыщения движущегося газа
- Метод изучения изотерм
- Метод эффузии Кнудсена
- Метод эффузии Кнудсена
- Пересчет давления насыщенных паров
- Расчет величины давления насыщенных паров посредством решения корреляционного уравнения Антуана
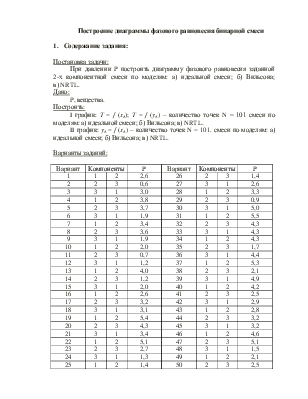
- Построение диаграммы фазового равновесия бинарной смеси. Стехиометрическое соотношение. Коэффициенты активности. Коэффициент уравнения Антуана
- Страницы работы
- Содержание работы
- 📸 Видео
Видео:Парциальное давление, пример | Газы.Молекулярно-кинетическая теория | ХимияСкачать

Инструкция
1) Выберите вещество из предложенного списка.
2) Задайте расчетную температуру, при которой определяется давление насыщенного пара.
Важно! Расчетная температура должна быть в интервале значений констант уравнения Антуана, иначе величина давления насыщенного пара вещества не будет рассчитана.
3) Для расчета величины давления насыщенного пара, а так же получения значений констант уравнения Антуана и показателей пожарной опасности выбранного вещества нажмите кнопку «Расчет».
Важно! Для веществ для которых значения констант уравнения Антуана не определены (const=0), расчет давления не проводится.
Видео:Введение в парциальное давление | Газы.Молекулярно-кинетическая теория | ХимияСкачать

ХИМИЯ НЕФТИ
Видео:Парциальное давлениеСкачать

ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА
| Плотность | Молекулярная масса | ДНП | Критические параметры | Вязкость | Поверхностное натяжение |
| Фактор сжимаемости | Летучесть (фугитивность) | Оптические свойства | Электрические свойства |
Определение давления насыщенных паров
Нефть и нефтепродукты характеризуются определенным давлением насыщенных паров, или упругостью нефтяных паров. Давление насыщенных паров является нормируемым показателем для авиационных и автомобильных бензинов, косвенно характеризующим испаряемость топлива, его пусковые качества, склонность к образованию паровых пробок в системе питания двигателя.
Для жидкостей неоднородного состава, таких, как бензины, давление насыщенных паров при данной температуре является сложной функцией состава бензина и зависит от объема пространства, в котором находится паровая фаза. Поэтому для получения сравнимых результатов практические определения необходимо проводить при стандартной температуре и постоянном соотношении паровой и жидкой фаз. С учетом изложенного выше топлив называют давление паровой фазы топлива, находящейся в динамическом равновесии с жидкой фазой, измеренное при стандартной температуре и определенном соотношении объемов паровой и жидкой фаз. Температура, при которой давление насыщенных паров становится равным давлению в системе, называется температурой кипения вещества. Давление насыщенных паров резко увеличивается с повышением температуры. При одной и той же температуре большим давлением насыщенных паров характеризуются более легкие нефтепродукты.
В настоящее время существует несколько способов определения ДНП веществ, которые можно разделить на следующие группы:
- Статический метод.
- Динамический метод.
- Метод насыщения движущегося газа.
- Метод изучения изотерм.
- Метод эффузии Кнудсена.
- Хроматографический метод.
Статический метод
На основе прямого статического метода создан ряд эксперименальных установок для исследования ДНП нефтепродуктов.
В нефтепереработке вследствие своей простоты широкое применение получил стандартный метод с использованием бомбы Рейда (ГОСТ 1756-2000). Бомба состоит из двух камер: топливной 1 и воздушной 2 с соотношением объемов соответственно 1:4, соединенных с помощью резьбы. Давление, создаваемое парами испытуемого топлива, фиксируется манометром 3, прикрепленным к верхней части воздушной камеры. Испытание проводят при температуре 38,8°С и давлении 0,1 МПа, обеспечиваемой специальной термостатированной баней.
Давление насыщенных паров испытуемой жидкости определяют по формуле:
Определение давления паров в бомбе Рейда дает приближенные результаты, служащие только для сравнительной оценки качества моторных топлив.
К достоинствам прибора относится простота конструкции и экспериментирования, к недостаткам — постоянное соотношение жидкой и паровой фаз и грубость метода (погрешность определения ДНП бензинов достигает 15-20%).
Расхождения между дайными, полученными с помощью бомбы Рейда и методом НАТИ, составляют 10-20 %.
Динамический метод
Метод насыщения движущегося газа
Метод изучения изотерм
Метод изучения изотерм даёт наиболее точные, по сравнению с другими способами, результаты, особенно при высоких температурах. Этот способ заключается в исследовании зависимости между давлением и объёмом насыщенного пара при постоянной температуре. В точке насыщения изотерма должна иметь излом, превращаясь в прямую. Считается, что этот метод пригоден для измерения ДНП чистых веществ и непригоден для многокомпонентных, у которых температура кипения — величина неопределённая. Поэтому он не получил распространения при измерении ДНП нефтепродуктов.
Метод эффузии Кнудсена
Метод эффузии Кнудсена применим в основном для измерения очень низких давлений (до 100 Па). Этот метод даёт возможность находить скорость эффузии пара по количеству конденсата при условии полной конденсации эффундирующего вещества. Установки, основанные на этом методе, имеют следующие недостатки: они являются установками однократного измерения и требуют разгерметизации после каждого измерения, что при наличии легкоокисляющихся и нестойких веществ нередко приводит к химическому превращению исследуемого вещества и искажению результатов измерений. Создана экспериментальная установка, лишенная указанных недостатков, но сложность конструкции позволяет применить её только в специально оснащенных лабораториях. Этот метод применяется в основном для измерения ДНП твёрдых веществ.
Метод эффузии Кнудсена
Однако, при анализе таких сложных смесей углеводородов, как нефтепродукты, возникают трудности не только при разделении углеводородов, относящихся к различным классам, но и при идентификации отдельных компонентов этих смесей.
Пересчет давления насыщенных паров
В технологических расчетах часто приходится производить пересчет температур с одного давления на другое или давления при изменении температуры. Для этого имеется множество формул. Наибольшее применение получила формула Ашворта:
Уточненная В. П. Антонченковым формула Ашворта имеет вид:
Для пересчета температуры и давления удобно также пользоваться графическими методами.
Наиболее распространенным графиком является график Кокса, который построен следующим образом. Ось абсцисс представляет собой логарифмическую шкалу, на которой отложены величины логарифма давления (lgP), однако для удобства пользования на шкалу нанесены соответствующие им значения Р. На оси ординат отложены значения температуры. Под углом 30° к оси абсцисс проведена прямая, обозначенная индексом «Н20», которая характеризует зависимость давления насыщенных паров воды от температуры. При построении графика из ряда точек на оси абсцисс восстанавливают перпендикуляры до пересечения с прямой Н20 и полученные точки переносят на ось ординат. На оси ординат получается шкала, построенная по температурам кипения воды, соответствующим различным давлениям ее насыщенных паров. Затем для нескольких хорошо изученных углеводородов берут ряд точек с заранее известными температурами кипения и соответствующими им значениями давления насыщенных паров.
Оказалось, что для алканов нормального строения графики, построенные по этим координатам, представляют собой прямые линии, которые все сходятся в одной точке (полюсе). В дальнейшем достаточно взять любую точку с координатами температура — давление насыщенных паров углеводорода и соединить с полюсом, чтобы получить зависимость давления насыщенных паров от температуры для этого углеводорода.
Несмотря на то что график построен для индивидуальных алканов нормального строения, им широко пользуются в технологических расчетах применительно к узким нефтяным фракциям, откладывая на оси ординат среднюю температуру кипения этой фракции.
Кроме графика Кокса для пересчета давления насыщенных паров углеводородов и их смесей в зависимости от температуры используется также график Максвелла.
Для пересчета температур кипения нефтепродуктов с глубокого вакуума на атмосферное давление используется номограмма UOP, по которой, соединив две известные величины на соответствующих шкалах графика прямой линией, получают на пересечении с третьей шкалой искомую величину Р или t. Номограммой UOP в основном пользуются в лабораторной практике.
Давление насыщенных паров смесей и растворов в отличие от индивидуальных углеводородов зависит не только от температуры, но и от состава жидкой и паровой фаз. Для растворов и смесей, подчиняющихся законам Рауля и Дальтона, общее давление насыщенных паров смеси может быть вычислено по формулам:
В области высоких давлений, как известно, реальные газы не подчиняются законам Рауля и Дальтона. В таких случаях найденное расчетными или графическими методами давление насыщенных паров уточняется с помощью критических параметров, фактора сжимаемости и фугитивности.
Видео:Гидростатическое давлениеСкачать

Расчет величины давления насыщенных паров посредством решения корреляционного уравнения Антуана
Задайте значения констант уравнения Антуана:
| AA = | BA = | CA = |
Отметьте вид уравнения (см. пояснения ниже), на который ориентированы указанные значения AA , BA , CA :
| |||||||||||||
Задайте значение расчетной температуры tp , ºC =
| Рассчитать | P нп, кПа = и получите величину давления насыщенного пара Константы AA , BA и CA , фигурирующие в формуле уравнения Антуана, получаются путем регрессии эксперементальных данных для определенного температурного интервала, соответствующего, как правило, диапазону давлений от 10 до 1500 мм рт. ст. (1,333 ÷ 199,984 кПА). Численные значения констант при этом могут быть расчитаны так, что зависимость давления от температуры выражается либо через десятичный, как в формуле (1), либо натуральный — (2), логарифм. Кроме того, на значения констант влияет и то, какие единицы измерения в формулах принимают давление и температура. Сравните:
Учитывая, что уравнене Антуана вида (1) применяется при проведении расчетов по определению пожарных категорий помещений, оценки пожарной опасности технологических процессов [1], а соответствующие ему значения констант преобладают в отечественной справочной литературе [3], но также принимая во внимание и факт наличия для значительного количества веществ данных [2], ориентированных на уравнение (2), в представленном на этой странице калькуляторе дается возможность провести вычисления и с одним, и с другим видом констант. При этом в любом случае величина расчетной температуры tp задается в привычных ºС, а давление Pнп получаем в кПа.
Видео:2.1. Метод характеристик. Задача Коши для гиперболического уравнения на плоскости.Скачать  Построение диаграммы фазового равновесия бинарной смеси. Стехиометрическое соотношение. Коэффициенты активности. Коэффициент уравнения АнтуанаСтраницы работыСодержание работыПостроение диаграммы фазового равновесия бинарной смеси При давлении P построить диаграмму фазового равновесия заданной 2-х компонентной смеси по моделям: а) идеальной смеси; б) Вильсона; в) NRTL. I график: T = f (xA); T = f (yA) – количество точек N = 101 смеси по моделям: а) идеальной смеси; б) Вильсона; в) NRTL. II график: yA = f (xA) – количество точек N = 101. смеси по моделям: а) идеальной смеси; б) Вильсона; в) NRTL. A – легколетучий компонент; B – труднолетучий компонент; xi – содержание i-го компонента в жидкой фазе,(мол.%); yi – содержание i-го компонента в паровой фазе,(мол.%); i – индекс компонента; ki – константа фазового равновесия i-го компонента; P – давление в системе, ата; Pi – давление пара над чистым растворителем, ата; T – температура системы, °С Tкип i – температура кипения i-го компонента, °С γ – коэффициент активности Константа фазового равновесия: Давление насыщенных паров компонента i-го компонента: а) идеальная смесь Примечание: верхний индекс – это квадрат. Коэффициента уравнения Антуана Параметры энергетического взаимодействия молекул компонентов 1, 2, 3 для моделей Вильсона и NRLT: Алгоритм расчета по модели идеальной смеси: 1. Выписать коэффициенты Аi, Bi, Ci уравнения Антуана для заданной пары веществ. 2. Найти температуры кипения веществ согласно «алгоритму поиска температуры кипения Tкип при заданном давлении системы P» и определить из пары веществ легколетучее вещество А и тяжелолетучее вещество B. 3. Находим шаг по температуре 9. Строим графики. Алгоритм расчета по моделям Вильсона и NRLT: п. 1-7 те же, что в «алгоритме расчета по модели идеальной смеси» 8. Для x1 = xA и x2 = 1 – xA находим натуральные логарифмы коэффициентов активности lnγ1 и lnγ2 по модели Вильсона или NRLT. 9. Находим коэффициенты активности γ1 и γ2 по модели Вильсона или NRLT. 13. Строим графики. Алгоритм поиска температуры кипения Tкип при давлении системы P: 1. Задать произвольную температуру T. 2. Найти Pi данного вещества при заданной температуре T по уравнению Антуана. Чтобы распечатать файл, скачайте его (в формате Word). 📸 ВидеоОсновное уравнение гидростатики (задачи)Скачать  Урок 43 (осн). Методы увеличения и уменьшения давленияСкачать  Метод конечных элементов (FEM) vs метод контрольного объёма (FVM). В чём разница?Скачать  Методы разделения смесей. Перегонка. Закон Коновалова | Физическая и коллоидная химияСкачать  Решить задачу Коши для дифференциального уравнения с помощью формулы ДюамеляСкачать  Метод контурных токов - Теория и задачаСкачать  Принцип измерения артериального давления | Олимпиадная биологияСкачать  Уравнения математической физики 11 Формула Пуассона для уравнения теплопроводностиСкачать  Урок 47 (осн). Расчет давления жидкости на дно и стенки сосудаСкачать  Механические примеси. Метод определения механических примесейСкачать  Дифференциальное уравнение Эйлера. Основное уравнение гидростатикиСкачать  Расчёт давления жидкости на дно и стенки сосуда | Физика 7 класс #30 | ИнфоурокСкачать  Использование уравнения Аррениуса для решения задач (1/2). Химия для поступающих.Скачать  Гидростатическое давление 1Скачать  | ||||||||||||||||||||||||||||