Методы кислотно – основного титрования (нейтрализации)
1) Сущьность метода.
2) Индикаторы метода кислотно-основного титрования.
3) Кривые титрования.
4) Расчеты при титровании.
В основе метода кислотно-основного титрования положена реакция взаимодействия ионов водорода или гидроксония с гидроксид-ионами, сопровождаются образованием слабодисоциируемых молекул воды (растворителя).
H++ OH-→ H2O H3O+ + OH-→ 2H2O
Этот метод применяется для количественного определения кислот (H2 SO4 , HNO3 , HCl, H3 PO4 , CH3 COOH, H2C2O4 ) гидроксидов (KOH, NaOH, Ba(OH)2 ) солей, способных гидролизироваться в водных растворах (Na2 CO3 , K2CO3), а также их смесей (смесь NH4Cl, и NaOH).
Кислотно-основное титрования имеет два основных метода: ацидиметрия — определение оснований и алкалиметрия – определение кислот. В качестве рабочих растворов используют чаще всего растворы кислот – HCl и H2 SO4, растворы KOH, NaOH. Поскольку эти кислоты и гидроксиды не могут быть использованы как исходные в-ва для приготовления титрованных растворов, то сначала готовят растворы примерной концентрации, а точный титр и нормальность (м. к.э.) их устанавливают по исходным веществам. чаще всего применяют 0,1 – 0,5 н р-ры.
В качестве исходных в-ва для установления титра растворов кислот используют чаще тетраборат натрия Na2B4O4 и Na2CO3 а для установления титра р-ров щелочей – щавеливую кислоту H2C2O4 * 2H2O или янтарную H2C4H4O4 . Все эти в-ва весьма удобны для работы и дают хорошие результаты при титровании. Для выяснения сущьности процессов происходит при кислотно-основном титровании, изучим реакцию среды в эквивалентном точке при различных случаях титрования. При данном методе точка эквивалентности может лежать в нейтральной (pH =7) щелочной (pH > 7) и кислой среде (pH 7
В р-ре избыток OH-. Следовательно при титровании слабых кислот сильными основаниями точка эквивалентности не совпадает с точкой нейтральности и будет находиться в щелочной среде.
3) Титрование слабого основания сильной кислотой.
NH4OH + HCl → NH4Cl + H2O
NH4OH + H+ → NH4+ + H2O
NH4Cl + HOH → NH4OH + HCl
NH4+ + HOH → NH4OH + H+ pH 10-9 (pH 10-9 (pH>9) ионизируемой форме малиново-красного цвета (образование коллоидной формы). Изменения цвета индикатора происходит не сразу, скачком, а в некотором интервале с изменением pH, который называют интервалом перехода индикатора. Каждый индикатор имеет свой интервал перехода, который зависит от особенности структуры индикатора. Кроме интервала перехода индикаторы характеризуются показателем титрования pT, который равен pH середины перехода, когда 50% молекул индикатора перешло из одной формы в другую и концентрации обеих форм уравнялись:[Ind-]=[HInd]. В этом случае константа равновесия системы HInd/ Ind — также равна pH среды
pK= pH +lg [HInd] /[Ind-] =pH +lg1 =pH ; pK =pK1=pT
Например м/о изменяет окраску от красной до желтой в интервале pH 3,1-4,4 и имеет показатель титрования pT =4,0 т. к. при pH=4 половина его молекул находиться в не ионизируемой, половина в ионизируемой форме.
Задача 1. Вычислить для 0,1135 н HCl титрования раствора и титрования его по CaO.
THCl/CaO -? THCl = CHCl * MЭHCl /1000 = 0,1135*36,5/1000= 0,004138 г/мл
Титр по определяемому в-ву можно вычеслить по формуле:
THCl/CaO = CHCl * MЭCaO /1000 = 0,1135*28,0397/1000= 0,003182 г/мл
Задача 2. Чему равен титр р-ра H2SO4 если для получения 3л этого р-ра взято 25мл H2SO4 ρ=1,515 (61,54%)
V( H2SO4)=3л m(H2SO4)=V* ρ* ω=25*1,515*0,6154=23,3 г
ω(H2SO4)=61,54% T (H2SO4 )= m/V=23,3/3000=0,007769 г/мл
Задача 3. Какому объему точно 0,1 н. р-ра HCl соответствует 21мл 0,1н р-ра. NaOH Поправочный коэффициент равен отношению практически взятой навески и теоретически вычисляемой. K=0,950
Cэ1 =0,1 моль/л Cэ = K Cэ1 =0,95*0,1=0,095 моль/л
V2 =21 мл C1 /C2 =V1 /V2 V1= C1 *C2/V2 =0,095 *21/0,1= 18,95мл (HCl)
Видео:Введение в титрование (видео 1)| Титриметрический анализ | ХимияСкачать

Урок 18. Кислотно-основное титрование
В уроке 18 «Кислотно-основное титрование» из курса «Химия для чайников» дадим определение процессу титрования; выясним что такое точка эквивалентности; выполним разбор задач на титрование. Для понимания материала данного урока Вам следует внимательно изучить уроку 16 «Кислоты и основания» и урок 17 «Реакция нейтрализации».
Видео:Кислотно-основное титрование. 11 класс.Скачать

Титрование это
Титрование является очень популярной процедурой определения относительных концентраций химических эквивалентов в кислотных или основных растворах. И если Вам не приходилось выполнять лабораторные работы по титрованию в школе, то в университете или колледже титровать Вы будете не раз! Итак, переходим к определению:
Титрование — это способ определения концентрации кислоты или основания в растворе, путем измерения объема титранта (основания или кислоты с заданной концентрацией) необходимого для полной нейтрализации имеющегося реагента.
Видео:Кислотно-основное титрованиеСкачать

Точка эквивалентности
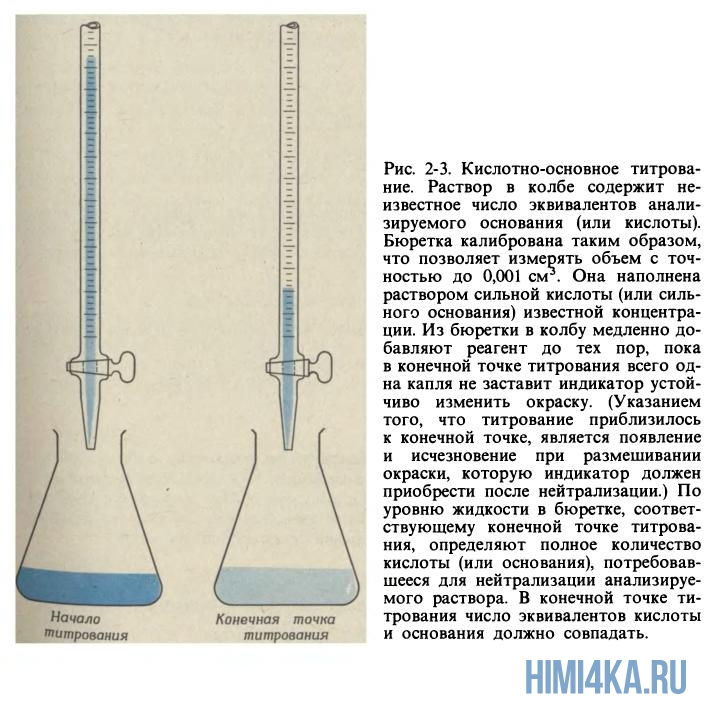
Поговорим о сущности процесса кислотно-основного титрования. Из необходимого оборудования, грубо говоря, вам понадобится лишь бюретка (стеклянная трубка с краником) и колба. Бывают два случая:
- Когда нужно определить концентрацию основания в колбе путем добавления из бюретки кислоты известной концентрации.
- Наоборот, когда необходимо определить концентрацию кислоты в колбе путем добавления основания известной концентрации.
Рассмотрим титрование в первом случае, когда титруемый раствор — основание, а титрант — кислота. Начинаем к анализируемому образцу основания постепенно добавлять раствор кислоты с заранее определенной концентраций до тех пор, пока число эквивалентов кислоты не будет равно числу эквивалентов основания. Продолжая титровать, в конце концов мы достигнем конечной точки титрования, или, как ее еще называют, точки эквивалентности — момент титрования, когда число эквивалентов титранта и титруемого раствора будут точно равны.
Чтобы понять, достигнута точки эквивалентности или еще нет, обычно используют различные кислотно-основные индикаторы. Для этого перед непосредственным титрованием в колбу с анализируемым раствором добавляют пару капель необходимого индикатора, и в момент достижения точки эквивалентности раствор начинает менять свой цвет.
Зная использованный объем титранта и его концентрацию, можно вычислить число эквивалентов основания в анализируемом образце. Если NA и NB — нормальности растворов кислоты и основания, а VA и VB — их объемы в момент нейтрализации, то:
С теорией покончено, переходим к решению задач на титрование.
Видео:Определение концентрации вещества в растворе методом титриметрииСкачать

Задачи на титрование
Пример 1. Допустим, химичка потребовала, чтобы вы нейтрализовали 25,00 мл раствора кислоты H3PO4. На титрование у вас ушло 30,25 мл раствора NaOH. Вычислите отношение нормальных и молярных концентраций обоих растворов.
Нормальная концентрация NaOH совпадает с молярной, а у H3PO4 нормальность в три раза больше молярной концентрации, поэтому:
Пример 2. Вы израсходовали 10,81 мл 0,1 н раствора HCl на титрование 25,00 мл раствора Ca(OH)2. Какую нормальность и молярность имеет анализируемый раствор? Сколько граммов Ca(OH)2 содержится в растворе?
Первым делом вычислим нормальную концентрацию анализируемого раствора Ca(OH)2:
Молярная концентрация Ca(OH)2 вдвое меньше его нормальной концентрации, так как химический эквивалент Ca(OH)2 равен 2. Поэтому анализируемый раствор имеет молярность 0,0216 М Ca(OH)2. Чтобы ответить на вопрос, сколько граммов Ca(OH)2 содержится в растворе, необходимо найти его количество вещества в растворе, для этого следует множить молярность на объем:
- 0,0216 моль/л × 0,025 л = 0,000514 моля
По таблице Менделеева определяем, что молекулярная масса Ca(OH)2 равна 74,1 г/моль, а значит в растворе содержится:
- 0,000541 моля × 74,1 г/моль = 0,0401 г Ca(OH)2
Пример 3. Химик-органик синтезирует новую кислоту. Он растворяет 0,5 г этой кислоты в определенном объеме воды и устанавливает, что для нейтрализации полученного раствора требуется 15,73 мл 0,437 н. раствора NaOH. Чему равен грамм-эквивалент синтезированной им кислоты? Если известно, что эта кислота содержит три ионизуемые группы –COOH, чему равна ее молекулярная масса?
Число эквивалентов основания, понадобившееся для нейтрализации, равно:
- 0,01573 л × 0,437 экв/л = 0,00687 экв
Грамм-эквивалент кислоты определяется из соотношения:
- 0,500 г / 0,00687 экв. = 72,8 г/экв
Так как грамм-эквивалент кислоты равен 72,8 г, а каждый ее моль высвобождает 3 эквивалента ионов водорода H + , молекулярная масса кислоты должна быть равна 3·72,8 г = 218 г.
Надеюсь урок 18 «Кислотно-основное титрование» был познавательным и понятным. Если у вас возникли вопросы, пишите их в комментарии.
Видео:Кислотно-основное титрование сильных и слабых кислот.Скачать

Тема лекции: Метод кислотно-основного титрования
1. Теоретические основы метода кислотно-основного титрования. рН.
2. Титранты метода. Индикаторы метода.
3. Кривые титрования.
4. Значение метода в технохимическом контроле продукции пищевых производств и общественного питания.
5. Гидролиз солей.
Метод кислотно-основного титрования (нейтрализации) – метод химического анализа, основанный на применении реакции взаимодействия ионов Н + и ОН — .
Характеристика метода нейтрализации.
| Уравнение реакции | Рабочий раствор (титрант) | Применение метода | Фиксирование точки эквивалентности | Недостатки метода |
| Взаимодействие кислот с основаниями: Н + + ОН — → Н2О | Раствор кислоты или щелочи | Для количественного определения кислот или щелочей (жесткость воды, концентрацию солей слабых кислот – щелочная среда) | Индикаторы (по природе – органические кислоты или основания) | Большая трудность определения точки эквивалентности. |
В зависимости от титранта различают методы:
Ø ацидиметрии (acidum – кислота): в качестве титранта используют 0,01 – 0,1 н. растворы сильных кислот (серная кислота, соляная кислота). Применяют для определения сильных и слабых оснований и некоторых солей слабых кислот (NaOH, NH4OH, Na2CO3, NaHCO3 и т.д.)
Ø алкалиметрии (alkalis – щелочь): в качестве титранта используют 0,01 – 0,1 н. растворы щелочей (NaOH, KOH, Ва(ОН)2). Применяют для определения сильных и слабых кислот и некоторых солей слабых оснований (HCl, H3BO3, CH3COOH и т.д.)
Понятие «водородный показатель» было введено датским химиком Серенсоном в 1909 г. Буква «р» — начальная буква датского слова «потенц» — степень, буква «Н» — символ водорода.
Концентрации ионов Н + и ОН — в воде и любом водном растворе взаимосвязаны. Увеличение концентрации ионов Н + (например, при добавлении кислоты) вызывает уменьшение концентрации ионов ОН — , и наоборот.
Растворы, в которых концентрация ионов водорода равна концентрации гидроксид-ионов, называют нейтральными. Если концентрация ионов водорода больше, то среда в растворе кислотная, если меньше — раствор щелочной, так как концентрация гидроксид-ионов будет больше.
Кислотность растворов обычно выражают через концентрацию ионов водорода Н + . Однако выражать такими числами, как 10 -8 моль/дм 3 или 10 -4 моль/дм 3 , концентрацию ионов водорода неудобно, и в химии применяют водородный показатель рН, который численно равен показателю степени молярной концентрации, взятому с обратным знаком. Например, при молярной концентрации ионов Н + , равной 10 -5 моль/дм 3 , рН равен 5, а при концентрации ионов Н + , равной 10 -8 моль/дм 3 , рН равен 8. Водородный показатель характеризует кислотность или щелочность раствора.
Чем рН меньше 7, тем больше кислотность раствора. Чем рН больше 7, тем больше щелочность раствора. При рН 7 среда раствора нейтральная. Это означает, что молярные концентрации ионов водорода Н + и гидроксид-ионов ОН — равны.
Увеличение кислотности Увеличение щелочности
 |  |
рН 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14
Величина рН играет большую роль в промышленности, химических и биологических процессах. Большинство из них может протекать только при определенной кислотности среды. На молочных комбинатах свежесть молока определяется по величине рН. В человеческом организме различные жидкости имеют различную величину рН: желудочный сок – рН 1,7 (сильнокислая среда), кровь – рН 7,4 (слабощелочная среда). Величина рН – показатель состояния здоровья человека.
Выбор титранта для кислотно-основного титрования.
Предпочтительно использовать либо сильные кислоты, либо сильные основания. В качестве индикаторов в методе нейтрализации используют слабые органические кислоты или основания.
Характеристика индикаторов метода нейтрализации:
Ø меняют окраску в зависимости от концентрации водородных ионов в растворе
Ø имеют интервал перехода окраски (значения рН раствора, в пределах которого индикатор меняет свою окраску)
Ø характерен показатель титрования (концентрация ионов водорода, при которой наиболее резко меняется окраска индикатора) – рТ.
Показатель титрования основных индикаторов
 индикатор рТ индикатор рТ | Метиловый оранжевый | Метиловый красный | Лакмус | фенолфталеин |
| рТ |
Требования к индикаторам в методе нейтрализации:
1. резкое отличие в окраске двух форм индикатора в небольшом интервале рН, при добавлении малого количества гидроксид-ионов или протонов Н + ;
2. изменение окраски должно быть обратимо; видимая окраска индикатора наблюдается лишь внутри интервала перехода окраски.
Часто используемые индикаторы.
· Столбец «х» — характер индикатора: к—кислота, о—основание.
| Индикатор | х | Цвет более кислой формы | Интервал перехода pH | Цвет более щелочной формы |
| фенолфталеин | к | бесцветный | 8,2 – 10,0 | Малиново-красный |
| Лакмус (азолитмин) | красный | 5,0 – 8,0 | синий | |
| Метиловый красный | о | красный | 4,2 – 6,2 | Желтый |
| Метиловый оранжевый | о | красный | 3,1 – 4,4 | Оранжево-желтый |
Интервал перехода индикатора не является вполне точной характеристикой. Он зависит от различной интенсивности окраски обоих растворов и от различной восприимчивости глаза к разным цветам. Тем не менее, при выборе индикатора для титрования необходимо знать интервал перехода различных индикаторов. При каждом титровании следует применять определенный индикатор, который позволит свести ошибку титрования к минимуму. Информация о применении основных индикаторов в методе нейтрализации приведена в таблице.
Выбор индикаторов в методе нейтрализации
| Условия титрования | рН в момент эквивалентности | Индикатор |
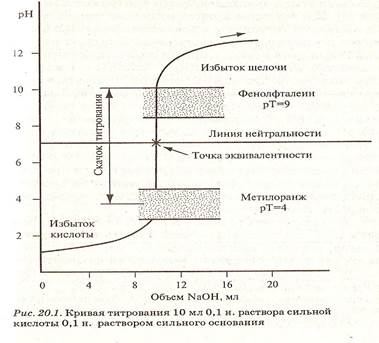
| сильную кислоту титруют сильным основанием | метиловый оранжевый, метиловый красный, фенолфталеин | |
| сильное основание титруют сильной кислотой | То же | |
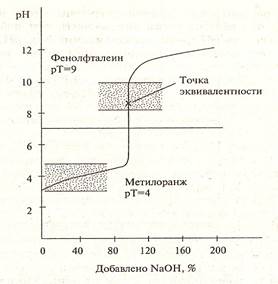
| слабую кислоту титруют сильным основанием | больше 7 (слабощелочная) | фенолфталеин |
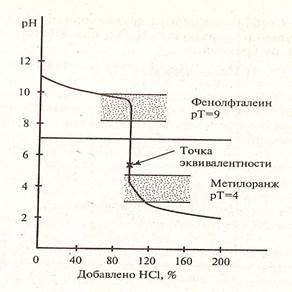
| Слабое основание титруют сильной кислотой | меньше 7 (слабокислая) | метиловый оранжевый, метиловый красный |
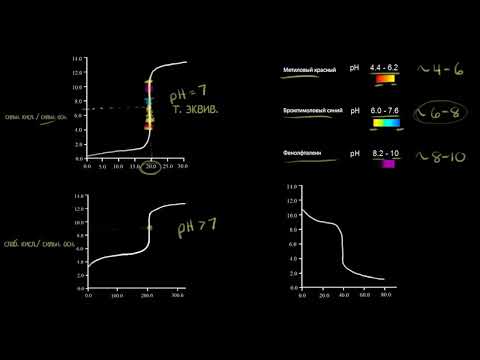
Для правильного выбора индикатора в методе нейтрализации строят кривые титрования.
В методе нейтрализации титрования выражают зависимость изменения рН среды от объема добавленного в процессе титрования титранта.
Кривые титрования — кривые, показывающие изменение концентраций веществ в процессе прохождения химических и электрохимических реакций титрования.
• дают возможность обнаружить, в какой мере та или иная реакция проходит количественно, т.е. можно ли ее использовать для титрования (оценка целесообразности титрования);
• дают возможность установить, за изменениями какой величины лучше всего следить в ходе титрования, как эта величина изменяется и как можно обнаружить конец титрования;
• дают возможность найти точку эквивалентности;
• дают возможность подобрать подходящий индикатор.
На рисунках 1,2,3 представлены примеры различных случаев титрования с характерными кривыми титрования.
Рисунок 1. Кривая титрования раствора сильной кислоты раствором сильного основания
Рисунок 2. Кривая титрования слабой кислоты сильным основанием
Рисунок 3. Кривая титрования слабого основания сильной кислотой
Гидролиз – взаимодействие ионов соли с ионами воды, в результате которого образуется слабый электролит.
Результат гидролиза: изменение среды раствора
1. Соль, образованная сильным основанием и сильной кислотой: не гидролизуется
2. Соль, образованная слабым основанием и сильной кислотой: MgSO4, CuCl2 и т.д.
MgSO4 ↔ Mg 2+ + SO4 2- — гидролиз по катиону (анион сильной кислоты не реагирует с водой)
Mg 2+ + НОН ↔ MgОН + + Н + — кислая среда (рН меньше 7)
MgОН + + НОН ↔ Mg(ОН)2 + Н + — протекает при жестких условиях
3. Соль, образованная сильным основанием и слабой кислотой: Na2CO3, K2SO3 и т.д.
Na2CO3 ↔ 2Na + + CO3 2- — гидролиз по аниону (катион не реагирует)
CO3 2- + НОН ↔ НCO3 — + ОН — — щелочная среда (рН больше 7)
4. Соль, образованная слабым основанием и слабой кислотой: СН3СООNН4, Al2S3 и т.д.
СН3СООNН4 ↔ СН3СОО — + NН4 + — гидролиз по катиону и аниону
СН3СОО — + NН4 + + НОН ↔ СН3СООН + NН4ОН – среда нейтральная (рН = 7)
1. Панкратова Г.В., Жванко Ю.Н., Мамедова З.И. Аналитическая химия и технохимический контроль в общественном питании. – М.: Высшая школа, 1980. – с. 95 – 104/
2. Шапиро С.А., Шапиро М.А. Аналитическая химия. – М.: Высшая школа, 1979. – с. 228 – 241.
📽️ Видео
Задача на кислотно-основное титрование (видео 16) | Титриметрический анализ | ХимияСкачать

Кислотно-щелочное титрованиеСкачать

Кислотно-основное титрование. Алкалиметрия. Ацидиметрия.Скачать

Шеховцова Т.Н. - Аналитическая химия - Кислотно-основное титрованиеСкачать

Буферные растворы. 1 часть. 11 класс.Скачать

Полный гайд по титрованию с Игнатом Тарабриным | AllesСкачать

Титрование 👌🏼Скачать

Кислотно основное титрованиеСкачать

Кислотно-основное титрование многоосновных кислот и их солей. Часть 1.Скачать

Кислотно- основное титрование. Ацидиметрия и алкалиметрия. Индикаторы. 1 курс. ТФП.Скачать

Математика без Ху!ни. Как вычислить определитель.Скачать
Двоичная система счисления — самое простое объяснениеСкачать

Кислотно-основное титрование в неводных средах.Скачать

Кривые титрования и кислотно-основные индикаторы (видео 14) | Титриметрический анализ | ХимияСкачать
Кислотно-основное титрование. Практическая часть. 11 класс.Скачать