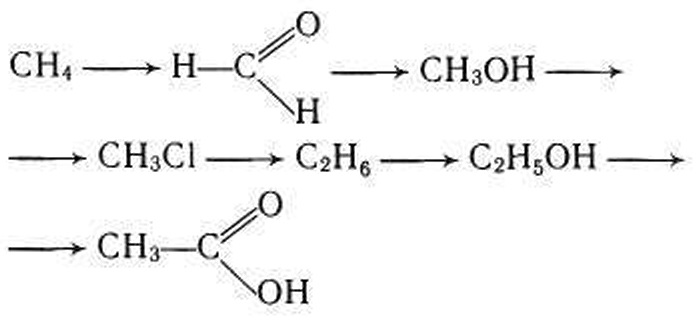
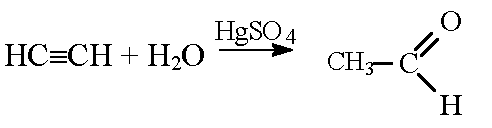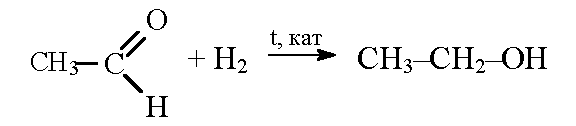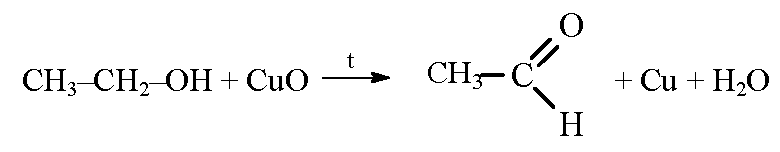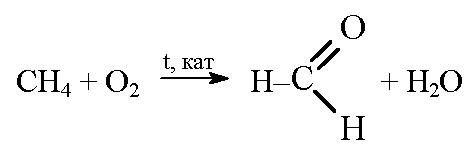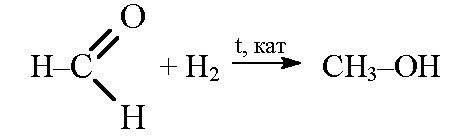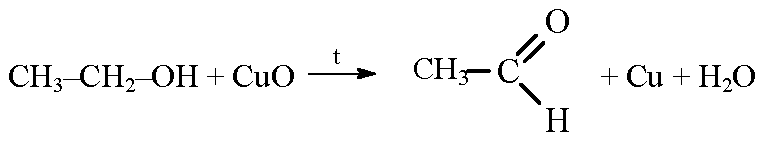Метанол CH3OH, метиловый спирт – это органическое вещество, предельный одноатомный спирт .
Общая формула предельных нециклических одноатомных спиртов: CnH2n+2O.
- Строение метанола
- Водородные связи и физические свойства метанола
- Изомерия метанола
- Химические свойства метанола
- 1.1. Взаимодействие с раствором щелочей
- 1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
- 2. Реакции замещения группы ОН
- 2.1. Взаимодействие с галогеноводородами
- 2.2. Взаимодействие с аммиаком
- 2.3. Этерификация (образование сложных эфиров)
- 2.4. Взаимодействие с кислотами-гидроксидами
- 3. Реакции замещения группы ОН
- 3.2. Межмолекулярная дегидратация
- 4. Окисление метанола
- 4.1. Окисление оксидом меди (II)
- 4.2. Окисление кислородом в присутствии катализатора
- 4.3. Жесткое окисление
- 4.4. Горение метанола
- 5. Дегидрирование спиртов
- Получение метанола
- 1. Щелочной гидролиз галогеналканов
- 2. Гидратация алкенов
- 3. Гидрирование карбонильных соединений
- 4. Промышленное получение метанола из «синтез-газа»
- Метиловый спирт этилен уравнение реакции
- Два способа получения этанола из этана. Как получить из этана этиловый спирт
- 42. Спирты как производные углеводородов. Промышленный синтез метанола
- Инструкция
- Acetyl
- 🌟 Видео
Видео:Можно ли отличить опасный для здоровья метанол от этилового спиртаСкачать

Строение метанола
В молекулах спиртов, помимо связей С–С и С–Н, присутствуют ковалентные полярные химические связи О–Н и С–О.
| Электроотрицательность кислорода (ЭО = 3,5) больше электроотрицательности водорода (ЭО = 2,1) и углерода (ЭО = 2,4). |
Электронная плотность обеих связей смещена к более электроотрицательному атому кислорода:
| Атом кислорода в спиртах находится в состоянии sp 3 -гибридизации. |
В образовании химических связей с атомами C и H участвуют две 2sp 3 -гибридные орбитали, а еще две 2sp 3 -гибридные орбитали заняты неподеленными электронными парами атома кислорода.
Поэтому валентный угол C–О–H близок к тетраэдрическому и составляет почти 108 о .
Водородные связи и физические свойства метанола
Спирты образуют межмолекулярные водородные связи. Водородные связи вызывают притяжение и ассоциацию молекул спиртов:
Поэтому метанол – жидкость с относительно высокой температурой кипения (температура кипения метанола +64,5 о С).
Водородные связи образуются не только между молекулами метанола, но и между молекулами метанола и воды. Поэтому метанол очень хорошо растворимы в воде. Молекулы метанола в воде гидратируются:
| Чем больше углеводородный радикал, тем меньше растворимость спирта в воде. Чем больше ОН-групп в спирте, тем больше растворимость в воде. |
Метанол смешивается с водой в любых соотношениях.
Видео:Как отличить метиловый спирт от этилового? 3 проверенных метода.Скачать

Изомерия метанола
Для метанола не характерно наличие структурных изомеров – ни изомеров углеродного скелета, ни изомеров положения гидроксильной группы, ни межклассовых изомеров.
Видео:Как определить опасный ли алкоголь? (Jack Daniel's) Реакция марганцовки на метиловый спирт.Скачать

Химические свойства метанола
Метанол – органическое вещество, молекула которого содержит, помимо углеводородной цепи, одну группу ОН.
1. Кислотные свойства метанола
| Метанол – неэлектролит, в водном растворе не диссоциирует на ионы; кислотные свойства у него выражены слабее, чем у воды. |
1.1. Взаимодействие с раствором щелочей
Метанол с растворами щелочей практически не реагирует, т. к. образующиеся алкоголяты почти полностью гидролизуются водой.
Равновесие в этой реакции так сильно сдвинуто влево, что прямая реакция не идет. Поэтому метанол не взаимодействуют с растворами щелочей.
1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Метанол взаимодействуют с активными металлами (щелочными и щелочноземельными). При этом образуются алкоголяты. При взаимодействии с металлами спирты ведут себя, как кислоты.
| Например, метанол взаимодействует с калием с образованием метилата калия и водорода . |
Метилаты под действием воды полностью гидролизуются с выделением спирта и гидроксида металла.
| Например, метилат калия разлагается водой: |
CH3OK + H2O → CH3-OH + KOH
Видео:В чём различие этилового и метилового спирта?Скачать

2. Реакции замещения группы ОН
2.1. Взаимодействие с галогеноводородами
При взаимодействии метанола с галогеноводородами группа ОН замещается на галоген и образуется галогеналкан.
| Например, метанол реагирует с бромоводородом. |
2.2. Взаимодействие с аммиаком
Гидроксогруппу спиртов можно заместить на аминогруппу при нагревании спирта с аммиаком на катализаторе.
| Например, при взаимодействии метанола с аммиаком образуется метиламин. |
2.3. Этерификация (образование сложных эфиров)
Метанол вступает в реакции с карбоновыми кислотами, образуя сложные эфиры.
| Например, метанол реагирует с уксусной кислотой с образованием метилацетата (метилового эфира уксусной кислоты): |
2.4. Взаимодействие с кислотами-гидроксидами
Спирты взаимодействуют и с неорганическими кислотами, например, азотной или серной.
| Например, метанол взаимодействует с азотной кислотой : |
Видео:Получение этилена из этилового спиртаСкачать

3. Реакции замещения группы ОН
В присутствии концентрированной серной кислоты от метанола отщепляется вода. Процесс дегидратации протекает по двум возможным направлениям: внутримолекулярная дегидратация и межмолекулярная дегидратация.
3.2. Межмолекулярная дегидратация
При низкой температуре (меньше 140 о С) происходит межмолекулярная дегидратация по механизму нуклеофильного замещения: ОН-группа в одной молекуле спирта замещается на группу OR другой молекулы. Продуктом реакции является простой эфир.
| Например, при дегидратации метанола при температуре до 140 о С образуется диметиловый эфир: |
Видео:Несколько лайфхаков со спиртом. Химия – просто.Скачать

4. Окисление метанола
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.
| Метанол окисляется сначала в формальдегид, затем в углекислый газ: Метанол → формальдегид → углекислый газ |
Типичные окислители — оксид меди (II), перманганат калия KMnO4, K2Cr2O7, кислород в присутствии катализатора.
Легкость окисления спиртов уменьшается в ряду:
метанол
4.1. Окисление оксидом меди (II)
Метанол можно окислить оксидом меди (II) при нагревании. При этом медь восстанавливается до простого вещества. Метанол окисляется до метаналя.
| Например, метанол окисляется оксидом меди до муравьиного альдегида |
4.2. Окисление кислородом в присутствии катализатора
Метанол можно окислить кислородом в присутствии катализатора (медь, оксид хрома (III) и др.). Метанол окисляется до метаналя.
4.3. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) метанол окисляется до углекислого газа.
| Спирт/ Окислитель | KMnO4, кислая среда | KMnO4, H2O, t |
| Метанол СН3-ОН | CO2 | K2CO3 |
| Например, при взаимодействии метанола с перманганатом калия в серной кислоте образуется углекислый газ |
4.4. Горение метанола
При сгорании спиртов образуются углекислый газ и вода и выделяется большое количество теплоты.
| Например, уравнение сгорания метанола: |
Видео:Как отличить этиловый спирт от метиловогоСкачать

5. Дегидрирование спиртов
При нагревании спиртов в присутствии медного катализатора протекает реакция дегидрирования. При дегидрировании метанола образуется альдегид.
Видео:ЧТО БУДЕТ если ВЫПИТЬ МЕТАНОЛСкачать

Получение метанола
Видео:Чем отличается метиловый спирт от этиловогоСкачать

1. Щелочной гидролиз галогеналканов
При взаимодействии галогеналканов с водным раствором щелочей образуются спирты. Атом галогена в галогеналкане замещается на гидроксогруппу.
| Например, при нагревании хлорметана с водным раствором гидроксида натрия образуется метанол |
Видео:Как отличить этиловый спирт от метилового? Или марганцовка вам не гарант!!!!Скачать

2. Гидратация алкенов
Гидратация (присоединение воды) алкенов протекает в присутствии минеральных кислот. При присоединении воды к алкенам образуются спирты.
Однако получить метанол гидратацией алкенов нельзя.
Видео:Как решать ОРГАНИЧЕСКИЕ ЦЕПОЧКИ? Основные типы химических реакцийСкачать

3. Гидрирование карбонильных соединений
Присоединение водорода к альдегидам и кетонам протекает при нагревании в присутствии катализатора. При гидрировании альдегидов образуются первичные спирты, при гидрировании кетонов — вторичные спирты, а из формальдегида образуется метанол.
| Например, при гидрировании формальдегида образуется метанол |
CH2=O + H2 → CH3-OH
Видео:Химия | Тепловой эффект химической реакции (энтальпия)Скачать

4. Промышленное получение метанола из «синтез-газа»
Каталитический синтез метанола из монооксида углерода и водорода при 300-400°С и давления 500 атм в присутствии смеси оксидов цинка, хрома и др.
Сырьем для синтеза метанола служит «синтез-газ» (смесь CO и H2), обогащенный водородом:
Видео:Горение спиртовСкачать

Метиловый спирт этилен уравнение реакции
Опубликовано в категории Химия, 22.06.2018 >>
Если твой вопрос не раскрыт полностью, то попробуй воспользоваться поиском на сайте и найти другие ответы по предмету Химия.
Видео:ОТЛИЧИЕ СПИРТА ЭТИЛОВОГО ОТ МЕТИЛОВОГОСкачать

Два способа получения этанола из этана. Как получить из этана этиловый спирт
Метиловый спирт, или метанол, его особенности:
1) структурная формула – СН 3 ОН;
2) это бесцветная жидкость с температурой кипения 64,5 °C;
3) ядовит (может вызывать слепоту, смерть);
4) в больших количествах метиловый спирт получается синтезом из оксида углерода (II) и водорода при высоком давлении (20–30 МПа) и высокой температуре (400 °C) в присутствии катализатора (около 90 % ZnО и 10 % Сr 2 O 3): СО + 2Н 2 → СН 3 ОН;
5) метиловый спирт образуется и при сухой перегонке дерева, поэтому его называют также древесным спиртом. Применяется он в качестве растворителя, а также для получения других органических веществ.
Этиловый (винный) спирт, или этанол, его особенности:
1) структурная формула – СН 3 СН 2 ОН;
2) температура кипения 78,4 °C;
3) этанол – это одно из важнейших исходных веществ в современной промышленности органического синтеза.
Способы получения этанола:
1) для получения используются различные сахаристые вещества (виноградный сахар, глюкоза, которая путем «брожения» превращается в этиловый спирт). Реакция протекает по схеме:
C 6 H 12 O 6 (глюкоза) → 2C 2 H 5 OH + 2CO 2 .
2) глюкоза в свободном виде содержится, например, в виноградном соке, при брожении которого получается виноградное вино с содержанием спирта от 8 до 16 %;
3) исходным продуктом для получения спирта может служить полисахарид крахмал, который содержится, например, в клубнях картофеля, зернах ржи, пшеницы, кукурузы;
4) для превращения в сахаристые вещества (глюкозу) крахмал предварительно подвергают гидролизу.
Для этого мука или измельченный картофель заваривается горячей водой и по охлаждении в него добавляется солод.
Солод – это проросшие, а затем подсушенные и растертые с водой зерна ячменя.
В солоде содержится диастаз, который действует на процесс осахаривания крахмала каталитически.
Диастаз – это сложная смесь ферментов;
5) по окончании осахаривания к полученной жидкости прибавляются дрожжи, под действием ферментов которых (зимазы) образуется спирт;
6) его отгоняют и затем очищают повторной перегонкой.
В настоящее время осахариванию подвергается также полисахарид – целлюлоза (клетчатка), которая образует главную массу древесины.
Для этого целлюлоза подвергается гидролизу в присутствии кислот (например, древесные опилки при 150–170 °C обрабатываются 0,1–5 %-ной серной кислотой под давлением 0,7–1,5 МПа).
Видео:Как получить этиловый спирт?Скачать

42. Спирты как производные углеводородов. Промышленный синтез метанола
Генетическая связь между спиртами и углеводородами:
1) спирты могут рассматриваться как гидроксильные производные углеводородов;
2) их можно отнести также к частично окисленным углеводородам, так как, кроме углерода и водорода, они содержат еще кислород;
3) довольно трудно непосредственно заменить атом водорода на гидроксильную группу или внедрить атом кислорода в молекулу углеводорода;
4) это можно осуществить через галогено-производные.
Например, чтобы получить этиловый спирт из этана, нужно сначала получить бромэтан:
С 2 Н 6 + Вr → С 2 Н 5 Вr + НВr.
А затем бромэтан превратить в спирт нагреванием с водной щелочью:
С 2 Н 5 Вr + Н ОН → С 2 Н 5 ОН + НВr;
5) щелочь нужна, чтобы нейтрализовать бромоводород и устранить возможность реакции его со спиртом;
6) таким же образом метиловый спирт можно получить из метана: СН 4 → СН 3 Вr → СН 3 ОН;
7) спирты связаны генетически и с непредельными углеводородами.
Например, этанол получается при гидратации этилена:
СН 2 =СН 2 → Н 2 О=СН 3 -СН 2 -ОН.
Реакция идет при температуре 280–300 °C и с давлением 7–8 МПа в присутствии ортофосфорной кислоты в качестве катализатора.
Промышленный синтез метанола, его особенности.
1. Метиловый спирт нельзя получить гидратацией непредельного углеводорода.
2. Его получают из синтез-газа, который представляет собой смесь оксида углерода (II) с водородом.
Метиловый спирт из синтез-газа получается по реакции:
СО + 2Н 2 → СН 3 ОН + Q.
Характерные особенности реакции.
1. Реакция идет в сторону уменьшения объема смеси, при этом смещению равновесия в сторону образования нужного продукта будет способствовать повышение давления.
2. Чтобы реакция шла с достаточной скоростью, необходимы катализатор и повышенная температура.
3. Реакция обратимая, исходные вещества при прохождении через реактор реагируют не полностью.
4. В целях экономного их использования спирт, который образуется, необходимо выделять из продуктов реакции, а непрореагировавшие газы снова направлять в реактор, т. е. осуществить циркуляционный процесс.
5. В целях экономии энергетических затрат отходящие продукты экзотермической реакции необходимо использовать для нагревания газов, которые идут на синтез.
а) из метана при нагревании можно получить ацетилен:
ацетилен в присутствии сульфата ртути (ii) присоединяет воду, образуется уксусный альдегид (реакция кучерова):
уксусный альдегид можно восстановить до этилового спирта:
при действии на этиловый спирт бромоводорода в присутствии серной кислоты образуется бромэтан (этилбромид):
при действии на этилбромид спиртового раствора щелочи при нагревании отщепляется бромоводород и образуется этилен:
при присоединении к этилену воды в присутствии кислот образуется этиловый спирт:
б) при окислении метана в присутствии катализатора образуется мета-наль:
метаналь при гидрировании превращается в метанол:
при действии на метанол хлороводорода в присутствии серной кислоты образуется хлорметан (метилхлорид):
при взаимодействии хлорметана с натрием образуется этан (реакция вюрца):
из этана в две стадии можно получить этанол. при хлорировании этана образуется хлорэтан:
при действии на хлорэтан водного раствора щелочи происходит замещение атома хлора на гидроксильную группу и образуется этанол.
этанол окисляется оксидом меди при нагревании в уксусный альдегид:
Этан — С2Н6 — газ без запаха и цвета, класса алканов. В природе находится в составе нефти, природного газа, других углеводородов, поэтому относится к органическим соединениям. Из этана можно получить этиловый . Правда, этот процесс достаточно трудоемкий, поэтому спирт обычно иным путем.
Видео:7.4. Спирты: Химические свойства. ЕГЭ по химииСкачать

Инструкция
Этиловый спирт получают преимущественно как результат брожения сахаросодержащих продуктов, зерна, фруктов, ягод, овощей. Для этого используют ректификационные аппараты, нагревание, перегонку.
Получить этиловый спирт из этана простой реакцией можно в процессе каталитического окисления при нагревании до 2000 градусов в присутствии катализатора.
Другой способ получения этилового спирт а из этана заключается в проведении следующих реакций:1. галогенирование при температуре 1000°С и в присутствии ультрафиолетового света:С2Н6 + Cl2 = C2H5Cl2. далее проведите реакцию с щелочью:С2H5Cl +NaOH = C2H5OH + NaCl
Этиловый спирт из этана можно получить и еще одним способом. Проведите дегидрирование этана при 400-5000°С в присутствии катализаторов платины Pt, никеля Ni, Al2O3:С2Н6 = С2Н4 + Н2
Этан горюч, почти нерастворим в воде, в смеси с воздухом взрывоопасен, нетоксичен. При нагревании этана до температуры 575-10000°С он распадается на ацетилен и водород, дальнейшее нагревание приводит к обугливанию и появлению ароматических углеводородов.
В промышленности этан применяется для производства этилена — бесцветного газа, имеющего ту же химическую формулу, что и этан. В прошлом веке в сочетании с кислородом этилен применялся для наркоза. Сегодня этилен является сырьем для получения полиэтилена, винилацетата, окиси этилена, уксусной кислоты и многого другого. Этилен также является фитогормоном, влияющим на здоровье и рост многих живых организмов.
Внимание, только СЕГОДНЯ!
Химическая формула этилового спирта (этанола) – С2Н5ОН. А вещество хлорэтан, применяемое в качестве хладагента и для наркоза в медицинских целях, имеет формулу С2Н5Сl. Эти вещества близки по составу, только в первом случае к этильному радикалу С2Н5…
Этан и пропан – газы, простейшие представители ряда предельных углеводородов — алканов. Их химические формулы С2Н6 и С3Н8 соответственно. Этан служит сырьем для производства этилена. Пропан же используется в качестве топлива, как в чистом виде, так…
Бутан – органическое соединение алканового ряда. Это бесцветный газ, который образуется в процессе переработки (крекинге) нефти. При высоких концентрациях бутан ядовит, также этот углеводород горюч и взрывоопасен. Получают его в лаборатории и в…
Этанол, или этиловый спирт, как и этилен относятся к органическим соединениям. Этанол – это одноатомный спирт, а этилен – непредельный углеводород класса алкенов. Однако между ними существует генетическая связь, согласно которой из одного вещества…
Ацетилен относится к непредельным углеводородам. Его химические свойства определяются тройной связью. Он способен вступать в реакции окисления, замещения, присоединения и полимеризации. Этан – предельный углеводород, для которого характеры реакции…
Цепочка химических превращений — это последовательность химических реакций, в результате которых одни вещества превращаются в другие. Чтобы осуществить такую цепочку, нужно прежде всего уметь правильно записывать уравнения реакций и знать, при каких…
Этанол – бесцветное органическое вещество, обладающее резким специфическим запахом. Его используют промышленности, в лабораториях — как лучший органический растворитель, в медицине – как прекрасный антисептик. Этиловый спирт также применяют для…
Уксусный альдегид (другие названия – этаналь, ацетальдегид) имеет химическую формулу CH3COH. Внешний вид – прозрачная бесцветная жидкость, с резким «обжигающим» запахом. Кипит при комнатной температуре. Легко растворяется в воде, и…
Этан – бесцветный газ, представитель класса алканов, имеющий химическую формулу С2Н6. Этилен – также бесцветный газ, но, в отличие от этана, в природе почти не представлен. Это вещество — простейший представитель родственного алканам класса алкенов,…
Метан представляет собой простейший предельный углеводород, из которого путем последующих реакций могут быть получены другие органические вещества, в том числе и этилен. Он, как и метан, является простейшим веществом, но, в отличие от него,…
Этан — один из часто встречающихся в природе газов. Это органическое вещество, которое наравне с метаном входит в состав нефти и природного газа. Из него получают этилен, который, в свою очередь, является сырьем для получения уксусной кислоты,…
Хлорэтан (другие названия – хлористый этил, этилхлорид) представляет собою бесцветный газ, имеет химическую формулу C2Н5Cl. Смешивается с этиловым спиртом и диэтиловым эфиром, почти не смешивается с водой. Каким образом можно получить это вещество? …
Существует 2 основных способа получения этанола — микробиологический (спиртовое брожение) и синтетический (гидратация этилена). Если именно из этана надо, то как-то так:
Условия проведения реакции к сожалению подсказать не могу 🙁 . зато получается почти текила — спирт с солью :)))
Видео:Способы получения предельных одноатомных спиртовСкачать

Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. 🌟 ВидеоКак расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать  Reaction of Sodium metal with methanol or methyl alcohol and ethanol or ethyl alcoholСкачать  🐳Дистилляция и ректификация. 10 класс. Химия. Промышленное получение этилового спирта.Скачать  |