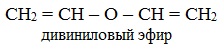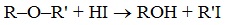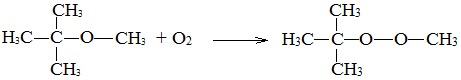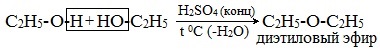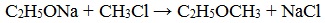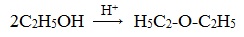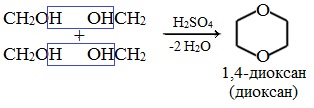Простыми эфирами называют органические вещества, в которых два углеводородных радикала связаны атомом кислорода: R’–O–R», где R’ и R» — различные или одинаковые радикалы.
Простые эфиры могут быть предельными, непредельными, циклическими, ароматическими.
предельные
непредельные
ароматические
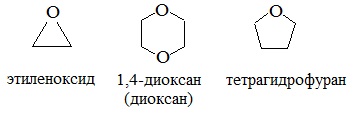
циклические
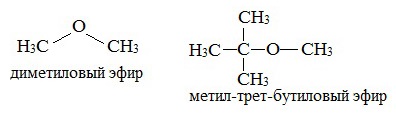
Простые эфиры рассматриваются как производные спиртов. Названия этих соединений строятся из названий радикалов (в порядке возрастания молекулярной массы) и слова «эфир». Например, CH3-O-CH3 — диметиловый эфир; C2H5-O-CH3 — метилэтиловый эфир.
Физические свойства
Два первых простейших представителя – диметиловый и метилэтиловый эфиры – при обычных условиях газы, все остальные – жидкости.
Диэтиловый эфир (C2H5-O-C2H5)– бесцветная легкокипящая прозрачная жидкость (t кип. 35,5 °С), малорастворимая в воде. С этиловым спиртом смешивается в любых отношениях. Температура воспламенения – 9,4°С, образует с воздухом взрывоопасную смесь. Вызывает набухание резин. Широко применяется в качестве растворителя, в медицине (ингаляционный наркоз), вызывает привыкание человека, ядовит.
Диоксан (т. кип. 101°С) — хороший растворитель, смешивается как с водой, так и с углеводородами. За эти качества его назвали «органической водой». Достаточно токсичен. Значительно более опасны галогенсодержащие дибензопроизводные диоксана: диоксин (2,3,7,8-тетрахлордибензо-п-диоксин).
Простые эфиры имеют более низкие температуры кипения и плавления, чем изомерные им спирты. Эфиры практически не смешиваются с водой. Это объясняется тем, что простые эфиры не образуют водородных связей, т.к. в их молекулах отсутствуют полярные связи О-Н.
Простые эфиры хорошо растворяют многие органические вещества и поэтому часто используются как растворители.
Эфиры имеют приятный запах.
Химические свойства
Простые эфиры — малоактивные соединения, они значительно менее реакционноспособны, чем спирты.
1.Расщепление простых эфиров HJ и HBr
Простые эфиры разлагаются под действием концентрированных иодоводородной или бромоводородной кислот:
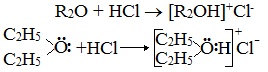
2. Образование комплексных соединений
Образование нестойких солей оксония (подобных солям аммония) в результате взаимодействия с сильными кислотами:
3. Окисление эфиров, образование перекисей
Несмотря на относительную химическую инертность, эфиры легко образуют при хранении на воздухе перекиси:
Перекиси являются причиной взрывов в конце перегонки эфиров, поэтому эфиры тщательно очищают от перекисей перед перегонкой и применением.
Получение
1. Межмолекулярная дегидратация спиртов
Симметричные простые эфиры R–O–R получают при межмолекулярной дегидратации спиртов:
При этом в одной молекуле спирта разрывается связь О-Н, а в другой — связь С-О. Реакцию можно рассматривать как нуклеофильное замещение группы HО – (в одной молекуле спирта) на группу RO – (от другой молекулы):
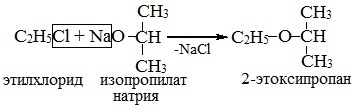
2. Взаимодействие галогенпроизводных с алкоголятами (реакция Вильямсона)
Эфиры несимметричного строения R–O–R’ образуются при взаимодействии алкоголята и галогенуглеводорода. Например, метилэтиловый эфир можно получить из этилата натрия и хлорметана:
В этой реакции происходит нуклеофильное замещение галогена (Cl – ) на алкоксигруппу (CH3O – ):
3. Дегидратация спиртов в присутствии ионов водорода как катализаторов
4. Получение гетероцикических кислородсодержащих соединений (циклические простые эфиры) этиленоксид (эпоксид) 
Применение
Вследствие относительной химической инертности, эфиры часто применяются в качестве органических растворителей (диэтиловый эфир, тетрагидрофуран, диоксан).
Эфиры с разветвленными алкильными радикалами (например, метил-трет-бутиловый эфир) используются в последнее время в качестве антидетонационных добавок в моторные топлива (бензины), заменяя чрезвычайно вредный тетраэтилсвинец (ТЭС) — Pb (CH3CH2)4.
Простые эфиры фенолов и нафтолов имеют своеобразные запахи и применяются в парфюмерии.
Видео:Разбор всех типов 26-28 задач из сборника Добротина 2023 | Екатерина СтрогановаСкачать

Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Видео:Опыты по химии. Получение сложного эфираСкачать  Получение простых эфировВы будете перенаправлены на Автор24 Видео:Где взять диэтиловый эфир?Скачать  Общие методы получения простых эфировК общим методам получения простых эфиров относятся:
Синтез А. Вильямсона заключается в обработке алкогалятов калия или натрия галоидными соединениями, алкилсульфатами или алкилсульфонатами и имеет вид: Из двух радикалов один $R$ переходит в эфир из молекулы спирта, а второй $R’$ переходит из молекулы галогеналкана. Наилучший выход эфира можно получить, если $R’$ является первичным радикалом. В этом случае реакция идет по механизму бимолекулярного нуклеофильного замещения $S_N2$, например: Например, получение метилэтилового эфира из этилята натрия: Синтез А. Вильямсона пригоден только для первичных $RX$, так как трет-алкоголят-ионы очень объемистые. Межмолекулярной дегидратацией первичных спиртов в присутствии кислых катализаторов можно получить симметричные простые эфиры, например, получение диметилового эфира из метанола: Готовые работы на аналогичную темуДля других спиртов с дегидратацией конкурирует образование алкенов. Но при определенных условиях можно получить простой эфир: Межмолекулярная дегидратация спиртов не применяется для получения эфиров фенолов, так как гидроксил в этих соединениях прочно связан. Спирты с реакционноспособным гидроксилом, например, бензгидрол $(C_6H_5)_2CHOH$ или бензиловый спирт $C_6H_5CH_2OH$, очень легко этерифицируются. В зависимости от строения спирта, дегидратация протекает по $S_N1$- или $S_N2$-механизму замещения. Реакция межмолекулярной дегидратации является хорошим методом получения смешанных спиртов, если группа $R$-первичная, а $R’$- третичная. Специфическим катализатором при получении простых эфиров из аллиловых спиртов является платинохлористоводородная кислота. Межмолекулярная дегидратация имеет практическое значение для получения эфиров низших спиртов, особенно этилового эфира. Реакцию этерификации можно осуществить в условиях гетерогенного катализа, пропуская пары спирта над $Al_2O_3$, $ThO_2$, $TiO_2$, $W_2O_5$ или над квасцами при температуре 135-140$^circ$С. В этой реакции применяют те же реактивы, что и для получения этилена. Однако будет иным соотношение исходных веществ и более низкая температура. Алкоксимеркурирование алкенов начинается с атаки двойной связи олефина катионом $^+HgOCOCH_3$, в результате образуется интермедиат в виде меркуриониевого катиона, в последствии раскрывающегося в результате нуклеофильной атаки спирта по наиболее замещенному углеродному атому: При синтезе эфиров, имеющих вторичный или третичный алкил, применяют трифторацетат ртути (I), реакция протекает в спирте: Простые эфиры можно получить метилированием спиртов с помощью диазометана. Эта реакция дает особенно хорошие результаты в случае незатрудненных первичных и вторичных спиртов. Реакция протекает в присутствии кислого катализатора $HBF_4$ или $BF_3$ (кислоты с нуклеофильными анионами не применяют). Реакция протекает с образованием промежуточного иона метил-диазония $^+$. Видео:Синтез диэтилового эфира (synthesis of diethyl ether)Скачать  Примеры использования метода А. ВильямсонаВ основном синтез А. Вильямсона применяют для получения эфиров фенола. Например: получение анизола (метилового эфира фенола) из фенолята натрия и йодистого метила: Подобным образом можно получить фенетол $C_6H_5OC_2H_5$ — этиловый эфир фенола. Йодистые алкилы можно заменить соответствующими сульфатами, которые обладают подобной реакционной способностью. Методом А. Вильямсона можно получить ароматические эфиры, но реакция при этом будет протекать тяжелее в результате пониженной реакционной способности галоидного атома, связанного с ароматическим ядром. Окись дифенила — дифениловый эфир можно получить при нагревании сухого фенолята натрия с бромбензолом до 210$^circ$С в присутствии катализатора порошка меди Видео:Получение этилена из этилового спиртаСкачать  Получение замещенных эфировНапример, необходимо получить дивиниловый эфир $CH_2=CH-O-CH=CH_2$. Для образования дивинилового эфира нужно получить двойную углерод-углеродную и эфирную связь. Лучшим методом получения ненасыщенного эфира является дегидрогалогенирование галогенэфира. Пути получения эфира с двумя хлорэтильными группами ($ClCH_2CH_2-$): Хлорирование эфира. Однако хлорирование диэтилового эфира не дает нужного продукта, а полихлорирование эфира ведет к накоплению атомов хлора в одной этильной группе. Превращение хлорсоединения в эфир. Хлорэтиловый эфир можно синтезировать дегидратацией хлорэтилового спирта Несимметричный эфир можно получить по реакции Вильямсона, например, получение фенил-n-нитробензилового эфира Эфир получают в результате взаимодействия фенолята натрия с n-нитробензилхлоридом. Фенолят натрия образуется при действии раствора гидроксида натрия на фенол. n-Нитробензилхлорид получают свободнорадикальным хлорированием n-нитротолуола, который образуется при нитровании толуола. Получи деньги за свои студенческие работы Курсовые, рефераты или другие работы Автор этой статьи Дата последнего обновления статьи: 17 04 2021 💥 ВидеоРазбор Варианта №1 из Сборника Добротина 2023 | Екатерина СтрогановаСкачать  Как понять что вещество выпадает в осадок или образуется газСкачать  47. Простые и сложные эфиры (часть 1)Скачать  Простые эфиры #shortsСкачать  Разбор Варианта №13 из Сборника Добротина 2023 | Екатерина СтрогановаСкачать  100 БАЛЛОВ ЗА 50 МИНУТ | Вариант №27 от Добротина | Катя СтрогановаСкачать  Эфиры. Номенклатура, способы получения, свойства и применениеСкачать  День 4. Все типы расчетных задач 26, 27, 28 | Интенсив ХИМФАК mini | ЕГЭ по химии 2022Скачать  Разбор Варианта №17 из Сборника Добротина 2023 | Екатерина СтрогановаСкачать  Разбор демоверсии ЕГЭ по химии 2023! Что будет на ЕГЭ?Скачать  Химия. 11 класс. Классификация, строение, номенклатура простых эфировСкачать  Очистка ДИЭТИЛОВОГО ЭФИРАСкачать  Как получить этиловый спирт?Скачать  ЕГЭ по химии: трудные вопросы органической химии. Часть 5Скачать  Разбор Варианта №15 из Сборника Добротина 2023 | Екатерина СтрогановаСкачать  |