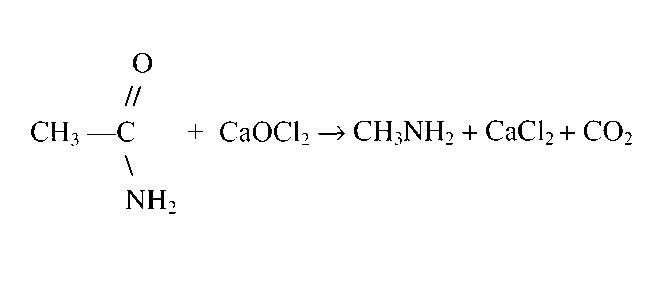Формула метиламина в химии считается почти примитивной. Однако для простых смертных одно название данного соединения является устрашающим, не говоря о том, что о структуре или формуле и вовсе ничего не известно. Многим неизвестно о специфичном запахе данного соединения или о его удивительно широких возможностях применения в различных производствах. Это вполне очевидно, ведь всего знать невозможно, и это факт. Но разве не интересно открывать для себя что-то ранее неизвестное?
- Что такое метиламин?
- Способы синтеза метиламина
- Химические свойства метиламина
- Применение метиламина и условия хранения
- Метиламин: строение, свойства, производство, применение.
- Содержание:
- Состав
- Свойства
- Внешность
- Запах
- Молярная масса
- Температура плавления
- Точка кипения
- Плотность
- Давление газа
- Дипольный момент
- Растворимость воды
- Основность
- точка возгорания
- температура самовоспламенения
- Поверхностное натяжение
- Разложение
- Производство
- Промышленное
- Лаборатория
- Приложения
- Ссылки
- Acetyl
Видео:Муравьиная кислота. РеакцииСкачать

Что такое метиламин?
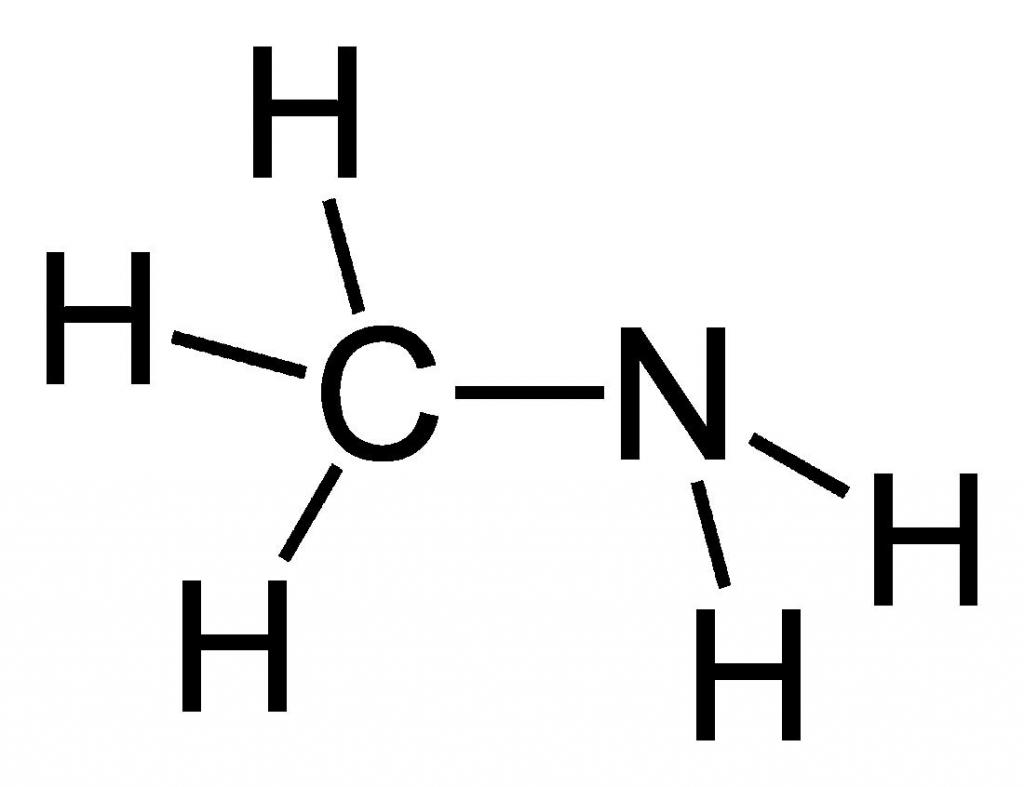
Метиламин — органическое соединение с формулой CH3NH2. Он является одним из производных аммиака, принадлежит к алифатическим органическим веществам. Его относят к крайне огнеопасным соединениям, так как этот газ легко смешивается с воздухом, образуя при этом взрывчатые смеси. Структура данного вещества представлена на рисунке ниже.
Из названия очевидно, что данное вещество относится к такому классу органических соединений, как амины (а именно — первичные амины), и оно является простейшим его представителем.
При нормальных условиях метиламин — это газ (как и упоминалось ранее), без цвета, но с ярко выраженным запахом аммиака.
Ингаляция данным веществом чревата сильным раздражением кожи, глаз, верхних дыхательных путей. Способен оказывать негативное влияние на почки и печень организма. А вдыхание его ведет к возбуждению и последующему угнетению центральной нервной системы. Возможно наступление смерти из-за остановки дыхания.
Видео:Особые свойства муравьиной кислоты | ХимияСкачать

Способы синтеза метиламина
Один из промышленных способов получения метиламина опирается на реакцию метанола с аммиаком. Условиями проведения данного химического взаимодействия является высокая температура (370-430 °С), а также давление 20-30 бар.
Реакция осуществляется в газовой фазе, но на гетерогенном катализаторе, основанном на цеолите.
В смеси с метиламином образуются побочные вещества, такие как диметиламин и триметиламин. Поэтому данный способ получения нуждается в очистке метиламина (например, путем неоднократной перегонки).
Иной способ получения метиламина заключается в проведении реакции формалина с хлоридом аммония при нагревании. Но и это не последний возможный вариант синтеза данного амина!
Также известен способ получения метиламина посредством перегруппировки ацетамида по Гофману. На рисунке ниже представлено уравнение данной реакции.
Видео:Муравьиная кислота | Химия 10 класс | УмскулСкачать

Химические свойства метиламина
Как правильно знакомиться с новым химическим соединением? Для начала нужно узнать, каково его название, особенности структуры. Затем важно понять, как его можно получить, поэтому сначала было рассказано о методах получения метиламина. А теперь нужно изучить его химические свойства.
Данному органическому соединению присущи все типичные свойства первичных аминов, так как оно является стандартным представителем данного класса.
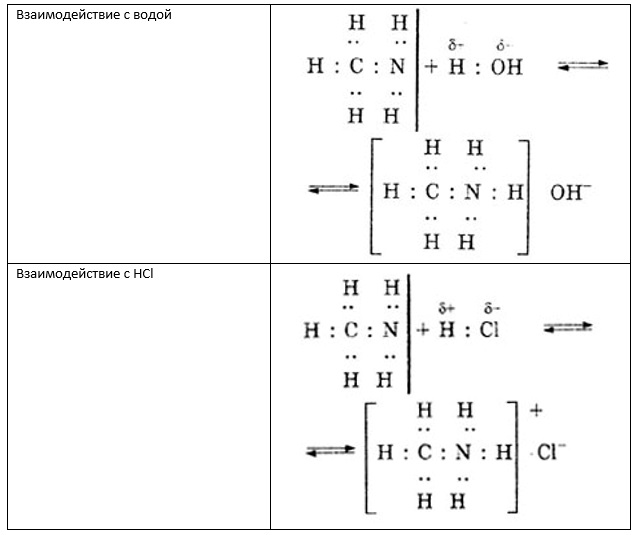
Если в качестве вещества, вступающего в реакцию с метиламином, выступает вода или минеральная кислота, то происходит образование, соответственно, гидроксида метиламмония или кристаллической соли.
Данные реакции представлены на рисунке ниже.
Если проводить сравнение метиламина с анилином или аммиаком, то можно прийти к выводу, что метиламин проявляет более сильные основные свойства. Это объясняется тем, что атом азота в составе молекул метиламина более электроотрицателен.
Если в качестве вещества, вступающего в реакцию с метиламином, выступает NaOCl, то происходит хлорирование — замещение атома водорода в аминогруппе на атом хлора. Так же как и другие первичные амины, метиламин образует спирт при взаимодействии с азотистой кислотой (HNO2).
Видео:Тесты по химии. Амины. А31 ЦТ 2004 по химииСкачать

Применение метиламина и условия хранения
CH3NH2 имеет очень широкую область применения. Он используется для синтеза красителей, фармацевтических препаратов (например, неофиллина, теофиллина, промедола), пестицидов, гербицидов, инсектицидов (севин, шрадан), фунгицидов, стерилизаторов земли в сельской промышленности, а также применяется в ветеринарной медицине.
Используется метиламин и при изготовлении сильных взрывоопасных веществ (таких как, например, тетрил), различных материалов для фото (метол), растворителей (например, ДМФА, диметилацетамид), ускорителей вулканизации, ингибиторов коррозии, дубильных веществ, ракетных топлив (N,N-диметилгидразин).
Также встречается метиламин в природе как второстепенный экскрет у костных рыб.
Чаще всего используют данное соединение в виде 40-процентного раствора в воде, метаноле, этаноле или тетрагидрофуране.
Чтобы применять метиламин в производстве или в процессе изготовления чего-либо, необходимо правильно его хранить.
Оптимальные условия хранения: в сжиженном виде в объеме 10-250 м 3 , в цилиндрических резервуарах, расположенных горизонтально, при комнатной температуре, но вдали от солнечных лучей, в местах, недоступных для детей и животных.
Разумеется, при работе с метиламином, как и с любым другим химическим веществом, необходимо использовать специальную одежду, перчатки и очки для индивидуальной защиты. Особое внимание нужно уделить защите слизистых оболочек и органов дыхания.
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Метиламин: строение, свойства, производство, применение.
Метиламин: строение, свойства, производство, применение. — Наука
Видео:Почему муравьиная кислота такая странная??Скачать

Содержание:
В метиламин представляет собой органическое соединение, сжатая формула которого CH3NH2. В частности, это простейший первичный алкиламин из всех, поскольку он содержит только один алкильный заместитель, что равносильно утверждению, что существует только одна ковалентная связь C-N.
В нормальных условиях это газообразный аммиак, который пахнет рыбой, но его относительно легко конденсировать и транспортировать в герметичных резервуарах. Кроме того, он может заметно растворяться в воде, в результате чего получаются желтоватые растворы. С другой стороны, он также может транспортироваться в твердом виде в форме его гидрохлоридной соли CH3NH2· HCl.
Метиламин промышленно производится из аммиака и метанола, хотя существует множество других методов производства в лабораторных масштабах. Его газ очень взрывоопасен, поэтому любой источник тепла рядом с ним может вызвать большой пожар.
Это соединение с высоким коммерческим спросом, но в то же время оно имеет строгие юридические ограничения, поскольку служит сырьем для наркотиков и психотропных веществ.
Видео:Все реакции с металлами за 1 урок | ЕГЭ по химии 2024 | Екатерина СтрогановаСкачать

Состав
На изображении выше показана молекулярная структура метиламина, представленная в виде шариковой ручки. Черная сфера соответствует атому углерода, синяя — атому азота, а белая — атомам водорода. Следовательно, это небольшая молекула, в которой метан, CH4, потеряем H для группы NH2, давая CH3NH2.
Метиламин — очень полярная молекула, потому что атом азота притягивает электронную плотность от атомов углерода и водорода. Он также обладает способностью образовывать водородные мостики между компендиумом своих межмолекулярных сил. Каждая молекула CH3NH2 может отдавать или принимать последовательную водородную связь (CH3HNH-NH2CH3).
Однако его молекулярная масса значительно мала, в дополнение к CH3 препятствуют таким водородным связям. В результате метиламин в нормальных условиях является газом, но может конденсироваться при температуре -6 ° C. Когда он кристаллизуется, он имеет орторомбическую структуру.
Видео:Опыты по химии. Взаимодействие муравьиной кислоты с цинкомСкачать

Свойства
Видео:Задание 14 ЕГЭ по химии: кислородсодержащие органические соединенияСкачать

Внешность
Бесцветный газ или жидкость, водные растворы которых могут иметь желтоватый оттенок.
Видео:Решаем все типы 21 задания ЕГЭ по химии 2024 с 0 за 30 минут! | Екатерина СтрогановаСкачать

Запах
Неприятный, похожий на смесь рыбы и нашатырного спирта.
Видео:Получение алканов. Реакция Вюрца (механизм + сложные случаи). ЕГЭ по химии.Скачать

Молярная масса
Видео:11.3. Карбоновые кислоты и их соли: Химические свойства. ЕГЭ по химииСкачать

Температура плавления
Видео:Окисление муравьиной кислоты раствором перманганата калияСкачать

Точка кипения
Около -6 ºC. Следовательно, это газ, который может конденсироваться при не слишком низких температурах.
Видео:Окисление метаналя HCHO + Cu(OH)2 → и муравьиной кислоты HCOOH + [Ag(NH3)2]OH → ХИМИЯ ЕГЭ 10 классСкачать
![Окисление метаналя HCHO + Cu(OH)2 → и муравьиной кислоты HCOOH + [Ag(NH3)2]OH → ХИМИЯ ЕГЭ 10 класс](https://i.ytimg.com/vi/JmXSmUSQZmU/0.jpg)
Плотность
656,2 кг / м 3 при 25 ° С. Его пары в 1,1 раза плотнее воздуха, а его жидкость или конденсат примерно в 0,89 раза плотнее воды.
Видео:Проверь свою готовность к ЕГЭ за 1 минуту!Скачать

Давление газа
При комнатной температуре давление его пара колеблется в пределах 3,5 атм.
Видео:Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Дипольный момент
Видео:Разложение муравьиной кислотыСкачать

Растворимость воды
1080 г / л при 20 ° С. Это газ, который очень хорошо растворяется в воде, потому что обе молекулы полярны и связаны друг с другом за счет образования водородных связей (CH3HNH-OH2).
Видео:Муравьиная кислота. Или альдегид? | Школьная химия | Даниил БазановСкачать

Основность
Метиламин имеет константу основности (pKб) из 3.36. Это значение указывает на то, что это очень основное вещество, даже в большей степени, чем сам аммиак, поэтому при растворении в воде он выделяет определенное количество ионов ОН. – при гидролизе:
Метиламин более основной, чем аммиак, потому что его атом азота имеет более высокую электронную плотность. Это потому, что CH3 отдает азоту больше электронов, чем три атома водорода в молекуле NH3. Даже в этом случае метиламин считается слабым основанием по сравнению с другими алкиламинами или аминами.
Видео:НШ | Химия. Особенности свойств муравьиной кислотыСкачать

точка возгорания
-10 ºC в закрытой емкости, что означает, что это легковоспламеняющийся и опасный газ.
Видео:Вопросы-Ответы. Кислоты\Основания, Индуктивный эффект, Резонанс. Beyond ChemistryСкачать

температура самовоспламенения
Поверхностное натяжение
19,15 мН / м при 25 ºC
Разложение
Когда он горит, он термически разлагается на оксиды углерода и азота, которые образуют токсичный дым.
Производство
Метиламин можно производить или синтезировать коммерческим или промышленным способом или лабораторными методами в меньшем масштабе.
Промышленное
Метиламин производят в промышленности в результате реакции, протекающей между аммиаком и метанолом на каталитической подложке из силикагеля. Химическое уравнение этой реакции выглядит следующим образом:
В процессе могут образовываться другие алкиламины; однако метиламин является кинетически предпочтительным продуктом.
Лаборатория
На лабораторном уровне существует несколько методов, позволяющих синтезировать метиламин в малых масштабах. Один из них — реакция в сильнощелочной среде КОН между ацетамидом и бромом, в ходе которой образуется метилизоцианат, СН3NCO, который, в свою очередь, гидролизуется с образованием метиламина.
Метиламин можно сохранить в твердом виде, если его нейтрализовать соляной кислотой, так что образуется гидрохлоридная соль:
Затем гидрохлорид метиламина, также представленный как [CH3NH3] Cl, его можно подщелачивать в безопасном месте для получения водного раствора с растворенным газом:
С другой стороны, метиламин также можно синтезировать, исходя из гексамина, (CH2)6N4, который гидролизуется непосредственно соляной кислотой:
Последовательно хлорид аммония реагирует с горячим формальдегидом с образованием паров метиламина и муравьиной кислоты, HCOOH.
Аналогичным образом, метиламин может быть получен восстановлением нитрометана, CH3Нет2 с металлическим цинком и соляной кислотой.
Приложения
Метиламин — это соединение, использование которого часто вызывает споры, поскольку это вещество, используемое при синтезе наркотиков, таких как метамфетамин. На самом деле, его популярность обусловлена желанием, чтобы главные герои телесериала Во все тяжкие должны были получить его любой ценой.
Это соединение также используется в качестве сырья для производства инсектицидов, лекарств, поверхностно-активных веществ, взрывчатых веществ, красителей, фунгицидов, добавок и т. Д., На которые он пользуется большим спросом во всем мире, в дополнение к многочисленным юридическим ограничениям на его приобретение.
Его огромная химическая универсальность обусловлена тем, что его молекула CH3NH2 это хороший нуклеофильный агент, связывающийся с субстратами с более высокой молекулярной массой или координирующий их в различных органических реакциях. Например, это основа для синтеза эфедрина, где CH3NH2 включается в молекулу с последующей потерей H.
Ссылки
- Моррисон Р. Т. и Бойд Р. Н. (1987). Органическая химия. 5-е издание. От редакции Addison-Wesley Interamericana.
- Кэри Ф. (2008). Органическая химия. (Издание шестое). Мак Гроу Хилл.
- Грэм Соломонс Т.В., Крейг Б. Фрайл. (2011). Органическая химия. (10-е изд.). Wiley Plus.
- Википедия. (2020). Метиламин. Получено с: en.wikipedia.org
- Национальный центр биотехнологической информации. (2020). Метиламин. База данных PubChem., CID = 6329. Получено с: pubchem.ncbi.nlm.nih.gov
- Дилан Мэтьюз. (15 августа 2013 г.). Вот что «Во все тяжкие» правильно и неправильно в метамфетамине. Получено с: washtonpost.com
- Prepchem. (2020). Приготовление метиламина гидрохлорида. Получено с: Prepchem.com
50 отличных фраз аниме (вдохновляющих и запоминающихся)
Русская революция 1905 года: причины, развитие, последствия
Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. |