Метанол CH3OH, метиловый спирт – это органическое вещество, предельный одноатомный спирт .
Общая формула предельных нециклических одноатомных спиртов: CnH2n+2O.
- Строение метанола
- Водородные связи и физические свойства метанола
- Изомерия метанола
- Химические свойства метанола
- 1.1. Взаимодействие с раствором щелочей
- 1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
- 2. Реакции замещения группы ОН
- 2.1. Взаимодействие с галогеноводородами
- 2.2. Взаимодействие с аммиаком
- 2.3. Этерификация (образование сложных эфиров)
- 2.4. Взаимодействие с кислотами-гидроксидами
- 3. Реакции замещения группы ОН
- 3.2. Межмолекулярная дегидратация
- 4. Окисление метанола
- 4.1. Окисление оксидом меди (II)
- 4.2. Окисление кислородом в присутствии катализатора
- 4.3. Жесткое окисление
- 4.4. Горение метанола
- 5. Дегидрирование спиртов
- Получение метанола
- 1. Щелочной гидролиз галогеналканов
- 2. Гидратация алкенов
- 3. Гидрирование карбонильных соединений
- 4. Промышленное получение метанола из «синтез-газа»
- Реакция взаимодействия метанола и оксида углерода(II)
- CH3OH + CO CH3COOH
- Производство уксусной кислоты из метанола и оксида углерода
- 🔥 Видео
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Строение метанола
В молекулах спиртов, помимо связей С–С и С–Н, присутствуют ковалентные полярные химические связи О–Н и С–О.
| Электроотрицательность кислорода (ЭО = 3,5) больше электроотрицательности водорода (ЭО = 2,1) и углерода (ЭО = 2,4). |
Электронная плотность обеих связей смещена к более электроотрицательному атому кислорода:
| Атом кислорода в спиртах находится в состоянии sp 3 -гибридизации. |
В образовании химических связей с атомами C и H участвуют две 2sp 3 -гибридные орбитали, а еще две 2sp 3 -гибридные орбитали заняты неподеленными электронными парами атома кислорода.
Поэтому валентный угол C–О–H близок к тетраэдрическому и составляет почти 108 о .
Водородные связи и физические свойства метанола
Спирты образуют межмолекулярные водородные связи. Водородные связи вызывают притяжение и ассоциацию молекул спиртов:
Поэтому метанол – жидкость с относительно высокой температурой кипения (температура кипения метанола +64,5 о С).
Водородные связи образуются не только между молекулами метанола, но и между молекулами метанола и воды. Поэтому метанол очень хорошо растворимы в воде. Молекулы метанола в воде гидратируются:
| Чем больше углеводородный радикал, тем меньше растворимость спирта в воде. Чем больше ОН-групп в спирте, тем больше растворимость в воде. |
Метанол смешивается с водой в любых соотношениях.
Видео:Химия 10 класс (Урок№6 - Одноатомные предельные спирты.)Скачать

Изомерия метанола
Для метанола не характерно наличие структурных изомеров – ни изомеров углеродного скелета, ни изомеров положения гидроксильной группы, ни межклассовых изомеров.
Видео:Химия 9 класс (Урок№18 - Угарный газ. Углекислый газ.)Скачать

Химические свойства метанола
Метанол – органическое вещество, молекула которого содержит, помимо углеводородной цепи, одну группу ОН.
1. Кислотные свойства метанола
| Метанол – неэлектролит, в водном растворе не диссоциирует на ионы; кислотные свойства у него выражены слабее, чем у воды. |
1.1. Взаимодействие с раствором щелочей
Метанол с растворами щелочей практически не реагирует, т. к. образующиеся алкоголяты почти полностью гидролизуются водой.
Равновесие в этой реакции так сильно сдвинуто влево, что прямая реакция не идет. Поэтому метанол не взаимодействуют с растворами щелочей.
1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Метанол взаимодействуют с активными металлами (щелочными и щелочноземельными). При этом образуются алкоголяты. При взаимодействии с металлами спирты ведут себя, как кислоты.
| Например, метанол взаимодействует с калием с образованием метилата калия и водорода . |
Метилаты под действием воды полностью гидролизуются с выделением спирта и гидроксида металла.
| Например, метилат калия разлагается водой: |
CH3OK + H2O → CH3-OH + KOH
Видео:Объемные отношения газов при химических реакциях. 8 класс.Скачать

2. Реакции замещения группы ОН
2.1. Взаимодействие с галогеноводородами
При взаимодействии метанола с галогеноводородами группа ОН замещается на галоген и образуется галогеналкан.
| Например, метанол реагирует с бромоводородом. |
2.2. Взаимодействие с аммиаком
Гидроксогруппу спиртов можно заместить на аминогруппу при нагревании спирта с аммиаком на катализаторе.
| Например, при взаимодействии метанола с аммиаком образуется метиламин. |
2.3. Этерификация (образование сложных эфиров)
Метанол вступает в реакции с карбоновыми кислотами, образуя сложные эфиры.
| Например, метанол реагирует с уксусной кислотой с образованием метилацетата (метилового эфира уксусной кислоты): |
2.4. Взаимодействие с кислотами-гидроксидами
Спирты взаимодействуют и с неорганическими кислотами, например, азотной или серной.
| Например, метанол взаимодействует с азотной кислотой : |
Видео:7.4. Спирты: Химические свойства. ЕГЭ по химииСкачать

3. Реакции замещения группы ОН
В присутствии концентрированной серной кислоты от метанола отщепляется вода. Процесс дегидратации протекает по двум возможным направлениям: внутримолекулярная дегидратация и межмолекулярная дегидратация.
3.2. Межмолекулярная дегидратация
При низкой температуре (меньше 140 о С) происходит межмолекулярная дегидратация по механизму нуклеофильного замещения: ОН-группа в одной молекуле спирта замещается на группу OR другой молекулы. Продуктом реакции является простой эфир.
| Например, при дегидратации метанола при температуре до 140 о С образуется диметиловый эфир: |
Видео:7.3. Спирты: Способы получения. ЕГЭ по химииСкачать

4. Окисление метанола
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.
| Метанол окисляется сначала в формальдегид, затем в углекислый газ: Метанол → формальдегид → углекислый газ |
Типичные окислители — оксид меди (II), перманганат калия KMnO4, K2Cr2O7, кислород в присутствии катализатора.
Легкость окисления спиртов уменьшается в ряду:
метанол
4.1. Окисление оксидом меди (II)
Метанол можно окислить оксидом меди (II) при нагревании. При этом медь восстанавливается до простого вещества. Метанол окисляется до метаналя.
| Например, метанол окисляется оксидом меди до муравьиного альдегида |
4.2. Окисление кислородом в присутствии катализатора
Метанол можно окислить кислородом в присутствии катализатора (медь, оксид хрома (III) и др.). Метанол окисляется до метаналя.
4.3. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) метанол окисляется до углекислого газа.
| Спирт/ Окислитель | KMnO4, кислая среда | KMnO4, H2O, t |
| Метанол СН3-ОН | CO2 | K2CO3 |
| Например, при взаимодействии метанола с перманганатом калия в серной кислоте образуется углекислый газ |
4.4. Горение метанола
При сгорании спиртов образуются углекислый газ и вода и выделяется большое количество теплоты.
| Например, уравнение сгорания метанола: |
Видео:Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

5. Дегидрирование спиртов
При нагревании спиртов в присутствии медного катализатора протекает реакция дегидрирования. При дегидрировании метанола образуется альдегид.
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Получение метанола
Видео:ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

1. Щелочной гидролиз галогеналканов
При взаимодействии галогеналканов с водным раствором щелочей образуются спирты. Атом галогена в галогеналкане замещается на гидроксогруппу.
| Например, при нагревании хлорметана с водным раствором гидроксида натрия образуется метанол |
Видео:Можно ли отличить опасный для здоровья метанол от этилового спиртаСкачать

2. Гидратация алкенов
Гидратация (присоединение воды) алкенов протекает в присутствии минеральных кислот. При присоединении воды к алкенам образуются спирты.
Однако получить метанол гидратацией алкенов нельзя.
Видео:Способы получения предельных одноатомных спиртовСкачать

3. Гидрирование карбонильных соединений
Присоединение водорода к альдегидам и кетонам протекает при нагревании в присутствии катализатора. При гидрировании альдегидов образуются первичные спирты, при гидрировании кетонов — вторичные спирты, а из формальдегида образуется метанол.
| Например, при гидрировании формальдегида образуется метанол |
CH2=O + H2 → CH3-OH
Видео:Химическая технология. Получение аммиака и метанола. Видеоурок 22. Химия 11 классСкачать

4. Промышленное получение метанола из «синтез-газа»
Каталитический синтез метанола из монооксида углерода и водорода при 300-400°С и давления 500 атм в присутствии смеси оксидов цинка, хрома и др.
Сырьем для синтеза метанола служит «синтез-газ» (смесь CO и H2), обогащенный водородом:
Видео:Тема: Выход продукта реакцииСкачать

Реакция взаимодействия метанола и оксида углерода(II)
Видео:Химия 11 класс (Урок№17 - Принципы химического производства. Промышленное получение металлов.)Скачать

CH3OH + CO  CH3COOH
CH3COOH
Реакция взаимодействия метанола и оксида углерода(II) с образованием уксусной кислоты. Реакция протекает при температуре около 185°C, в присутствии комплексных соединений родия.
Синтетический метод получения уксусной кислоты.
Видео:Спирты: химические свойства | Химия ЕГЭ для 10 класса | УмскулСкачать

Производство уксусной кислоты из метанола и оксида углерода
1.3.5 Производство уксусной кислоты из метанола и оксида углерода
Производство уксусной кислоты жидкофазным карбонилированием метанола осуществляется при 250°С и 63,7 МПа в присутствии в качестве катализатора карбонила и иодида кобальта:
Побочными продуктами являются пропионовая кислота и более высококипящие продукты, а также оксид и диоксид углерода. На 1 т уксусной кислоты расходуется 0,6 т метанола и 620 м 3 оксида углерода. Одновременно получается 20 кг пропионовой кислоты и 20 кг высококипящих продуктов.
Синтез уксусной кислоты из метанола впервые был разработан и осуществлен в промышленном масштабе фирмой ВАSF.
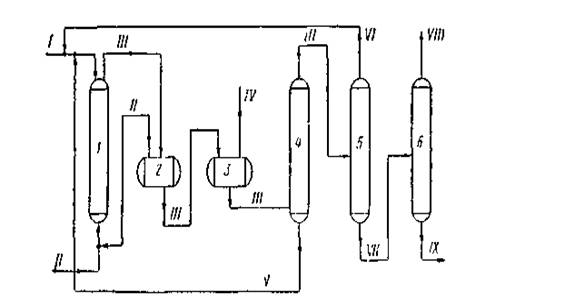
1 — колонна синтеза;2 — сепаратор высокого давления;3 — сепаратор низкого давления;4, 5 и 6—ректификационные колонны;
I — метанол + катализатор; II — окись углерода;II — продукты синтеза;IV — отработанный газ; V — раствор катализатора;VI — метанол;VII — кислота-сырец;VIII — товарная уксусная кислота;IX — кубовый остаток на сжигание.
Рисунок 1.5 Технологическая схема синтеза уксусной кислоты карбонилированием метанола
На рисунке 5 приведена технологическая схема синтеза уксусной кислоты из метанола, освоенная в промышленном масштабе фирмой ВАSF в Людвигс-хафене. Процесс проводят с применением каталитической системы кобальт + иод. Раствор катализатора в метаноле поступает в верх колонны синтеза 1, а снизу подается окись углерода.
Синтез осуществляется при 250 °С и 70—75 МПа. Реакционная смесь из колонны синтеза поступает вначале в сепаратор высокого давления 2, а затем — в сепаратор низкого давления 3. Непрореагировавшая окись углерода из сепаратора 3 снова возвращается в процесс. Жидкие продукты далее отделяются на колонне 4 от катализатора и подаются на ректификационную колонну 5. Раствор катализатора возвращается в колонну синтеза. С верха колонны 5 отбирается непрореагировавший метанол, а кислота-сырец подастся в колонну б, где выделяется товарная уксусная кислота. Кубовый остаток колонны 6 периодически отводится на сжигание.
Выход уксусной кислоты составляет 90% в расчете на метанол
2. ТЕХНОЛОГИЧЕСКАЯ ЧАСТЬ
2.1 Химизм процесса
Синтез уксусной кислоты из метанола впервые был разработан и осуществлен в промышленном масштабе фирмой ВАSF. Предполагается, что при синтезе кислот из спиртов первоначально происходит расщепление связи углерод — кислород с образованием галогеналкила:
Галогеналкил далее взаимодействует с гпдрокарбоннлом металла с образованием алкилкарбонилов, ацилкарбоннлов и кислот
RCН2Х+НМе (СО)4 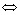
Гидрокарбонил металла получается по уравнению:
По-видимому, промотирующес влияние галогеноводородных кислот объясняется образованием в их присутствии галогензамещенных гидрокарбоннлов металла
НХ + Ме(СО)4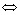
которые обладают большей кислотностью п каталитической активностью по сравнению с незамещенными гидрокарбониламн.
Реакцию карбонилирования спиртов могут катализировать как кислые (фосфорная и серная кислоты, смесь трехфтористого бора с водой), так и щелочные (алкоголяты щелочных металлов) агенты.
Однако наиболее эффективными катализаторами являются соединения никеля, кобальта, железа, родия, рутения и палладия. Эти элементы вводятся в реакционную зону в виде карбонилов, галогенидов или комплексных солей.
В качестве промоторов используются иод, йодистый метил, иодистоводородная кислота.
Особенно эффективны катализаторы на основе родия, промотированного иодом. В их присутствии синтез уксусной кислоты из метанола успешно протекает при сравнительно низких давлениях (3 МПа и ниже), причем достигается практически количественный выход уксусной кислоты (
99%). Катализатор может быть использован многократно.
2.2 Описание технологической схемы
Процесс получения уксусной кислоты включает следующие основные стадии: синтез уксусной кислоты; улавливание легких фракций; очистку уксусной кислоты; приготовление и регенерацию катализатора. Схема потоков стадий синтеза и отгонки легких фракций приведена на рисунке 2.2.
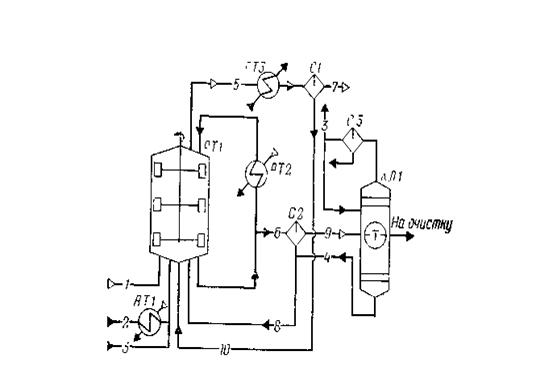
1 — оксид углерода; 2 — метанол; 3 — дистиллят;4 — кубовые остатки;5, 7, 9 — отдувочные газы;6, 8, 10 — жидкая фаза;
РТ1 — реактор; АТ1, АТ2 — подогреватели; АТ3 — холодильник конденсатор; С1, С2, СЗ — сепараторы; КЛ1 — колонна отгонки легких фракций
Рисунок 2.1 Схема потоков стадия синтеза уксусной кислоты
В реактор синтеза барботажного типа РТ1, снабженный перемешивающим устройством, насосом из сборника подают метанол, который предварительно нагревают водяным паром от 40 до 140—180°С в подогревателе АТ1. Оксид углерода поступает в реактор через барботажиое кольцо, в результате чего образуется дисперсная фаза, способствующая быстрому растворению газа в реакционной смеси. Время пребывания веществ в реакционной зоне (0,25—0,30 ч) регулируют уровнем жидкости в реакторе (75—80% от его вместимости), а полноту процесса синтеза при давлении 2,8 МПа и температуре 185°С — тщательным перемешиванием всех потоков, поступающих в реактор, с помощью мешалки.
Реакционная жидкость (уксусная кислота и раствор катализатора с промотором) из реактора РТ1 поступает в сепаратор С2, где за счет снижения давления до 62 кПа происходит частичное испарение жидкости и снижение температуры до 116°С. Здесь же происходит отделение пара от жидкости. Жидкость, содержащую катализатор, из нижней части сепаратора С2 возвращают в реактор РТ1, а пары, выходящие из верхней части сепаратора, поступают в колонку отгонки легких фракций КЛ1. Эти пары содержат уксусную кислоту, метилиодид, иодоводород, воду и незначительные количества метанола, метилацетата, несконденсировавшихся газов.
Из верхней части колонны КЛ1 отбирают метилиодид с парами воды и уксусной кислоты, конденсируют в холодильнике-конденсаторе и разделяют в сепараторе СЗ на две фазы: тяжелую и легкую. Тяжелую фазу, содержащую в основном метилиодид, возвращают в реактор РТ1; часть легкой фазы используют в качестве флегмы для орошения колонны КЛ1, а часть возвращают в реактор синтеза.
Из куба колонны КЛ1 выводят тяжелую фазу, состоящую из метилиодида и уксусной кислоты; этот поток самотеком поступает в сепаратор С2 и таким образом иодоводород и родий возвращают в цикл.
Сырую уксусную кислоту отбирают из средней части колонны легких фракций КЛ1 и направляют на стадию очистки.
Из верхней части реактора синтеза РТ1 выводят отдувочные газы, содержащие пары метилиодида, уксусной кислоты и воды. После охлаждения в холодильнике-конденсаторе АТЗ газовую фазу отделяют от жидкой в сепараторе С1, после чего жидкость возвращают в реактор синтеза, а газ направляют на очистку.
🔥 Видео
Составление уравнений реакций для генетических цепочек по кислородсодержащим. часть 2Скачать

СЕРНАЯ КИСЛОТА, АММИАК, МЕТАНОЛ. 26 задание ХИМИЯСкачать

Химия. 9 класс. Кислородсодержащие органические соединения. Спирты /30.04.2021/Скачать

Задание 23 из ЕГЭ по химииСкачать

Как выучить Химию с нуля за 10 минут? Принцип Ле-ШательеСкачать














 CH3COOH
CH3COOH