Метанол CH3OH, метиловый спирт – это органическое вещество, предельный одноатомный спирт .
Общая формула предельных нециклических одноатомных спиртов: CnH2n+2O.
- Строение метанола
- Водородные связи и физические свойства метанола
- Изомерия метанола
- Химические свойства метанола
- 1.1. Взаимодействие с раствором щелочей
- 1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
- 2. Реакции замещения группы ОН
- 2.1. Взаимодействие с галогеноводородами
- 2.2. Взаимодействие с аммиаком
- 2.3. Этерификация (образование сложных эфиров)
- 2.4. Взаимодействие с кислотами-гидроксидами
- 3. Реакции замещения группы ОН
- 3.2. Межмолекулярная дегидратация
- 4. Окисление метанола
- 4.1. Окисление оксидом меди (II)
- 4.2. Окисление кислородом в присутствии катализатора
- 4.3. Жесткое окисление
- 4.4. Горение метанола
- 5. Дегидрирование спиртов
- Получение метанола
- 1. Щелочной гидролиз галогеналканов
- 2. Гидратация алкенов
- 3. Гидрирование карбонильных соединений
- 4. Промышленное получение метанола из «синтез-газа»
- Как из Метанола получить Диметиловый эфир?
- Осуществить превращения : а)ацетат натрия — метан — хлорметан — метанол — диметиловый эфир?
- Составьте уравнения реакций, с помощью которых можно осуществить следущие превращения : метан→метаналь→метанол→диметиловый эфир→углекислый газ?
- С какой парой веществ реагирует пропановая кислота а) метанол и магний ; б) диметиловый эфир и медь ; в) гидроксид натрия и азот ; г) соляная кислота и магний?
- Изомерами являются бензол и толуол ; пропанол и пропановая кислота ; этанол и диметиловый эфир ; этанол и фенол?
- Написать цепочку превращений метан — ацетилен — этаналь — этилен — этанол — диметиловый эфир спасибо заранее?
- Составьте уравнения реакций, с помощью которых из метанола можно получить : а)диметиловый эфир б)натрий — метилат в)метиловый эфир уксусной кислоты Пожалуйсто?
- Как получить из метилового эфира уксусной кислоты метанол?
- Почему диметиловый эфир и этиловый спирт, имеющие одинаковую формулу C2H60 обладают различными свойствами?
- Из 48 граммов метилового спирта было получено 27, 6 граммов диметилового эфира?
- Определите массу уксусно — метилового эфира который получится при взаимодействии 60Г уксусной кислоты и 64Г метанола?
- Способ получения диметилового эфира из метанола
Видео:Простые эфиры. Химические свойства. Все 3 реакции ЕГЭ.Скачать

Строение метанола
В молекулах спиртов, помимо связей С–С и С–Н, присутствуют ковалентные полярные химические связи О–Н и С–О.
| Электроотрицательность кислорода (ЭО = 3,5) больше электроотрицательности водорода (ЭО = 2,1) и углерода (ЭО = 2,4). |
Электронная плотность обеих связей смещена к более электроотрицательному атому кислорода:
| Атом кислорода в спиртах находится в состоянии sp 3 -гибридизации. |
В образовании химических связей с атомами C и H участвуют две 2sp 3 -гибридные орбитали, а еще две 2sp 3 -гибридные орбитали заняты неподеленными электронными парами атома кислорода.
Поэтому валентный угол C–О–H близок к тетраэдрическому и составляет почти 108 о .
Водородные связи и физические свойства метанола
Спирты образуют межмолекулярные водородные связи. Водородные связи вызывают притяжение и ассоциацию молекул спиртов:
Поэтому метанол – жидкость с относительно высокой температурой кипения (температура кипения метанола +64,5 о С).
Водородные связи образуются не только между молекулами метанола, но и между молекулами метанола и воды. Поэтому метанол очень хорошо растворимы в воде. Молекулы метанола в воде гидратируются:
| Чем больше углеводородный радикал, тем меньше растворимость спирта в воде. Чем больше ОН-групп в спирте, тем больше растворимость в воде. |
Метанол смешивается с водой в любых соотношениях.
Видео:Химия 10 класс (Урок№6 - Одноатомные предельные спирты.)Скачать

Изомерия метанола
Для метанола не характерно наличие структурных изомеров – ни изомеров углеродного скелета, ни изомеров положения гидроксильной группы, ни межклассовых изомеров.
Видео:Диэтиловый эфир С2Н5 О С2Н5 Невероятно летучая и легковоспламеняющаяся жидкостьСкачать

Химические свойства метанола
Метанол – органическое вещество, молекула которого содержит, помимо углеводородной цепи, одну группу ОН.
1. Кислотные свойства метанола
| Метанол – неэлектролит, в водном растворе не диссоциирует на ионы; кислотные свойства у него выражены слабее, чем у воды. |
1.1. Взаимодействие с раствором щелочей
Метанол с растворами щелочей практически не реагирует, т. к. образующиеся алкоголяты почти полностью гидролизуются водой.
Равновесие в этой реакции так сильно сдвинуто влево, что прямая реакция не идет. Поэтому метанол не взаимодействуют с растворами щелочей.
1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Метанол взаимодействуют с активными металлами (щелочными и щелочноземельными). При этом образуются алкоголяты. При взаимодействии с металлами спирты ведут себя, как кислоты.
| Например, метанол взаимодействует с калием с образованием метилата калия и водорода . |
Метилаты под действием воды полностью гидролизуются с выделением спирта и гидроксида металла.
| Например, метилат калия разлагается водой: |
CH3OK + H2O → CH3-OH + KOH
Видео:Синтез диэтилового эфираСкачать

2. Реакции замещения группы ОН
2.1. Взаимодействие с галогеноводородами
При взаимодействии метанола с галогеноводородами группа ОН замещается на галоген и образуется галогеналкан.
| Например, метанол реагирует с бромоводородом. |
2.2. Взаимодействие с аммиаком
Гидроксогруппу спиртов можно заместить на аминогруппу при нагревании спирта с аммиаком на катализаторе.
| Например, при взаимодействии метанола с аммиаком образуется метиламин. |
2.3. Этерификация (образование сложных эфиров)
Метанол вступает в реакции с карбоновыми кислотами, образуя сложные эфиры.
| Например, метанол реагирует с уксусной кислотой с образованием метилацетата (метилового эфира уксусной кислоты): |
2.4. Взаимодействие с кислотами-гидроксидами
Спирты взаимодействуют и с неорганическими кислотами, например, азотной или серной.
| Например, метанол взаимодействует с азотной кислотой : |
Видео:Где взять диэтиловый эфир?Скачать

3. Реакции замещения группы ОН
В присутствии концентрированной серной кислоты от метанола отщепляется вода. Процесс дегидратации протекает по двум возможным направлениям: внутримолекулярная дегидратация и межмолекулярная дегидратация.
3.2. Межмолекулярная дегидратация
При низкой температуре (меньше 140 о С) происходит межмолекулярная дегидратация по механизму нуклеофильного замещения: ОН-группа в одной молекуле спирта замещается на группу OR другой молекулы. Продуктом реакции является простой эфир.
| Например, при дегидратации метанола при температуре до 140 о С образуется диметиловый эфир: |
Видео:7.1. Спирты: Номенклатура, классификация, изомерия. ЕГЭ по химииСкачать

4. Окисление метанола
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.
| Метанол окисляется сначала в формальдегид, затем в углекислый газ: Метанол → формальдегид → углекислый газ |
Типичные окислители — оксид меди (II), перманганат калия KMnO4, K2Cr2O7, кислород в присутствии катализатора.
Легкость окисления спиртов уменьшается в ряду:
метанол
4.1. Окисление оксидом меди (II)
Метанол можно окислить оксидом меди (II) при нагревании. При этом медь восстанавливается до простого вещества. Метанол окисляется до метаналя.
| Например, метанол окисляется оксидом меди до муравьиного альдегида |
4.2. Окисление кислородом в присутствии катализатора
Метанол можно окислить кислородом в присутствии катализатора (медь, оксид хрома (III) и др.). Метанол окисляется до метаналя.
4.3. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) метанол окисляется до углекислого газа.
| Спирт/ Окислитель | KMnO4, кислая среда | KMnO4, H2O, t |
| Метанол СН3-ОН | CO2 | K2CO3 |
| Например, при взаимодействии метанола с перманганатом калия в серной кислоте образуется углекислый газ |
4.4. Горение метанола
При сгорании спиртов образуются углекислый газ и вода и выделяется большое количество теплоты.
| Например, уравнение сгорания метанола: |
Видео:7.4. Спирты: Химические свойства. ЕГЭ по химииСкачать

5. Дегидрирование спиртов
При нагревании спиртов в присутствии медного катализатора протекает реакция дегидрирования. При дегидрировании метанола образуется альдегид.
Видео:Простые эфиры. Получение. Все 4 реакции ЕГЭ.Скачать

Получение метанола
Видео:НХС лекция 14Скачать

1. Щелочной гидролиз галогеналканов
При взаимодействии галогеналканов с водным раствором щелочей образуются спирты. Атом галогена в галогеналкане замещается на гидроксогруппу.
| Например, при нагревании хлорметана с водным раствором гидроксида натрия образуется метанол |
Видео:Получение МЕТАНОЛАСкачать

2. Гидратация алкенов
Гидратация (присоединение воды) алкенов протекает в присутствии минеральных кислот. При присоединении воды к алкенам образуются спирты.
Однако получить метанол гидратацией алкенов нельзя.
Видео:Метанол - Мировая революция (Док. фильм) / RUSСкачать

3. Гидрирование карбонильных соединений
Присоединение водорода к альдегидам и кетонам протекает при нагревании в присутствии катализатора. При гидрировании альдегидов образуются первичные спирты, при гидрировании кетонов — вторичные спирты, а из формальдегида образуется метанол.
| Например, при гидрировании формальдегида образуется метанол |
CH2=O + H2 → CH3-OH
Видео:Синтез диэтилового эфира (synthesis of diethyl ether)Скачать

4. Промышленное получение метанола из «синтез-газа»
Каталитический синтез метанола из монооксида углерода и водорода при 300-400°С и давления 500 атм в присутствии смеси оксидов цинка, хрома и др.
Сырьем для синтеза метанола служит «синтез-газ» (смесь CO и H2), обогащенный водородом:
Видео:Получение простого эфира. Химический опытСкачать

Как из Метанола получить Диметиловый эфир?
Химия | 10 — 11 классы
Как из Метанола получить Диметиловый эфир.
Нагревание метанола в присутствии серной кислоты при температуре 120 — 140 градусов ведет к межмолекулярной дегидратации с образованием диметилового эфира.
Видео:Органическая химия с нуля | Химия ЕГЭ 2023 | УмскулСкачать

Осуществить превращения : а)ацетат натрия — метан — хлорметан — метанол — диметиловый эфир?
Осуществить превращения : а)ацетат натрия — метан — хлорметан — метанол — диметиловый эфир.
Б)этилен — этанол — этаналь — этановая кислота — ацетат натрия.
В)крахмал — — этанол — — этилен — — 1, 2 — дихлорэтан — — этиленгликоль.
Видео:Trinidad, Methanol and dimethyl etherСкачать

Составьте уравнения реакций, с помощью которых можно осуществить следущие превращения : метан→метаналь→метанол→диметиловый эфир→углекислый газ?
Составьте уравнения реакций, с помощью которых можно осуществить следущие превращения : метан→метаналь→метанол→диметиловый эфир→углекислый газ.
Видео:2CH3OH + 3O2 → 2CO2 + 4H2O | Реакция горения метанолаСкачать

С какой парой веществ реагирует пропановая кислота а) метанол и магний ; б) диметиловый эфир и медь ; в) гидроксид натрия и азот ; г) соляная кислота и магний?
С какой парой веществ реагирует пропановая кислота а) метанол и магний ; б) диметиловый эфир и медь ; в) гидроксид натрия и азот ; г) соляная кислота и магний.
Видео:Можно ли отличить опасный для здоровья метанол от этилового спиртаСкачать

Изомерами являются бензол и толуол ; пропанол и пропановая кислота ; этанол и диметиловый эфир ; этанол и фенол?
Изомерами являются бензол и толуол ; пропанол и пропановая кислота ; этанол и диметиловый эфир ; этанол и фенол.
Видео:Получение диэтилового эфираСкачать

Написать цепочку превращений метан — ацетилен — этаналь — этилен — этанол — диметиловый эфир спасибо заранее?
Написать цепочку превращений метан — ацетилен — этаналь — этилен — этанол — диметиловый эфир спасибо заранее.
Видео:Моделирование установки получения диметилового эфира в AspenHysysV10Скачать
Составьте уравнения реакций, с помощью которых из метанола можно получить : а)диметиловый эфир б)натрий — метилат в)метиловый эфир уксусной кислоты Пожалуйсто?
Составьте уравнения реакций, с помощью которых из метанола можно получить : а)диметиловый эфир б)натрий — метилат в)метиловый эфир уксусной кислоты Пожалуйсто.
Видео:Как определить наличие метанола в домашних условиях?Скачать

Как получить из метилового эфира уксусной кислоты метанол?
Как получить из метилового эфира уксусной кислоты метанол.
Почему диметиловый эфир и этиловый спирт, имеющие одинаковую формулу C2H60 обладают различными свойствами?
Почему диметиловый эфир и этиловый спирт, имеющие одинаковую формулу C2H60 обладают различными свойствами?
Из 48 граммов метилового спирта было получено 27, 6 граммов диметилового эфира?
Из 48 граммов метилового спирта было получено 27, 6 граммов диметилового эфира.
Сколько это составляет по сравнению с теоретически возможным?
Определите массу уксусно — метилового эфира который получится при взаимодействии 60Г уксусной кислоты и 64Г метанола?
Определите массу уксусно — метилового эфира который получится при взаимодействии 60Г уксусной кислоты и 64Г метанола.
Вы открыли страницу вопроса Как из Метанола получить Диметиловый эфир?. Он относится к категории Химия. Уровень сложности вопроса – для учащихся 10 — 11 классов. Удобный и простой интерфейс сайта поможет найти максимально исчерпывающие ответы по интересующей теме. Чтобы получить наиболее развернутый ответ, можно просмотреть другие, похожие вопросы в категории Химия, воспользовавшись поисковой системой, или ознакомиться с ответами других пользователей. Для расширения границ поиска создайте новый вопрос, используя ключевые слова. Введите его в строку, нажав кнопку вверху.
Способ получения диметилового эфира из метанола
Владельцы патента RU 2564420:
Настоящее изобретение относится к способу получения диметилового эфира, применяемого в качестве хладагента и газа вытеснителя аэрозольных упаковок, из метанола. Способ заключается в контактировании метанола с дегидратирующим катализатором в реакционной зоне и разделении компонентов реакционной смеси с помощью ректификации с возвращением непрореагировавшего метанола в реакционную зону, при котором дегидратацию метанола и образование эфира проводят в присутствии катализатора при повышенной температуре. При этом в качестве катализатора применяют молекулярные сита цеолитного типа с крупными порами, выбранные из группы, состоящей из цеолитов структуры FAU, являющихся цеолитами типа X и их модификациями, дегидратацию осуществляют в газообразном состоянии при температуре в реакционной зоне 280÷330°C и давлении 17÷22 атм, в первой ректификационной колонне отгоняют от воды фракцию, состоящую из метанола и диметилового эфира, во второй ректификационной колонне отгоняют от непрореагировавшего метанола диметиловый эфир и возвращают метанол в реакционную зону. Способ позволяет получить диметиловый эфир с высокими выходом и чистотой. 1 ил., 1 табл., 4 пр.
Данное изобретение относится к химической промышленности, конкретно к области получения диметилового эфира (ДМЭ), применяемого в качестве хладагента и газа вытеснителя аэрозольных упаковок.
Качество очистки газа вытеснителя определяет его использование в тех отраслях, где очень высоки требования к газу по содержанию меркаптанов и влаги (парфюмерно-косметическая продукция, медицинские аэрозоли, производство автокосметики, монтажной пены, лакокрасочной продукции).
Известно достаточно много процессов, в которых ДМЭ получают дегидратацией метанола с использованием различных катализаторов.
Согласно патенту [1] [патент RU 2459799, С2, дата публикации 27.08.2012 г.] в качестве катализаторов могут использоваться молекулярные сита цеолитного и/или нецеолитного типов. В качестве молекулярных сит используются одно или несколько сит, с FAU структурой, выбранных из группы, состоящей из цеолитов Y-типа, которые имеют большие поры. Молекулярное сито нецеолитного типа может быть силикоалюмофосфатным.
К недостаткам указанного способа следует отнести высокую склонность к косообразованию катализаторов при температуре реакции.
В патенте [2] [патент RU 2282613, С2, дата публикации 27.08.2006 г.] дегидратацию метанола проводят в присутствии сульфоионитного катализатора при повышенной температуре и давлении в совмещенном реакционно-ректификационном аппарате.
Наиболее близким по своей технической сущности и достигаемому техническому результату является изобретение «Способ получения диметилового эфира» [3], [патент RU №2256645, С2, дата публикации 20.07.2005 г.]. Согласно данному изобретению метанолсодержащий поток контактирует с дегидратирующим катализатором в одной или нескольких реакционных зонах. Компоненты реакционной смеси с помощью дистилляции и/или ректификации разделяют с возвращением непрореагировавшего метанола в реакционную зону. Дегидратацию метанола и образование эфира проводят в жидком и/или парожидкостном состоянии в присутствии кислого катионита при температуре 100-460°C и поддерживают концентрацию воды в возвращаемом реакционную зону метанольном потоке менее 12% масс, предпочтительно менее 5% масс.
Основными недостатками прототипа являются:
— применение двухреакторной схемы для дегидратации;
— применение водной отмывки выделенного потока диметилового эфира от метанола и подача воднометанольной смеси в зону ректификации от воды;
— применение реакционно-ректификационного аппарата приведет к усложнению технологической схемы.
Задача предлагаемого способа заключается в создании экологически чистой технологии получения ДМЭ дегидратацией метанола на молекулярном сите цеолитного типа, которая позволит получить продукцию необходимого качества для использования ее в качестве газа вытеснителя аэрозольных упаковок и значительно снизить эксплуатационные и капитальные затраты на реализацию и проведение процесса.
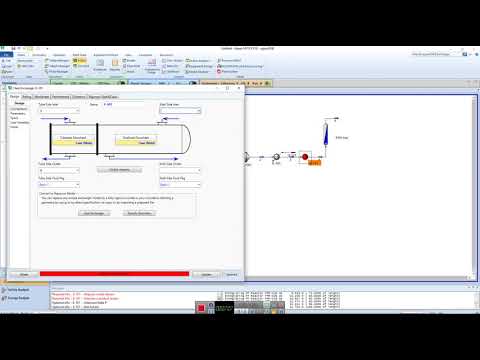
Поставленная задача достигается тем, что в способе получения диметилового эфира из метанола, путем его контактирования с дегидратирующим катализатором в реакционной зоне и разделении компонентов реакционной смеси с помощью ректификации с возвращением непрореагировавшего метанола в реакционную зону, при котором дегидратацию метанола проводят в присутствии катализатора при повышенной температуре, в отличие от прототипа, в качестве катализатора применяют молекулярные сита цеолитного типа с крупными порами, выбранные из группы, состоящей из цеолитов структуры FAU, являющихся цеолитами типа X и их модификациями, дегидратацию осуществляют в газообразном состоянии при температуре в реакционной зоне 280÷380°C и давлении 17÷22 атм, в первой ректификационной колонне отгоняют от воды фракцию, состоящую из метанола и диметилового эфира, во второй ректификационной колонне отгоняют от непрореагировавшего метанола диметиловый эфир и возвращают метанол в реакционную зону. Предлагаемый способ получения диметилового эфира осуществляется на установке, которая представлена на чертеже, где приведена принципиальная схема установки.
Установка работает следующим образом.
Для получения ДМЭ используют метанол концентрации не менее 99,5%, массовая доля серы не более 0,0001%, массовая доля воды не более 0,05%, массовая доля альдегидов и кетонов не более 0,003%.
Согласно схемы установки на чертеже метанол поступает по линии 1. Его смешивают с рециркулируемым метанольным потоком 11, поступающим из куба колонны 14, подогревают в теплообменнике до температуры 300-350°C и по лини 2 направляют в реакционную зону реактора 12, содержащую цеолит типа X. Из реакционной зоны реактора 12 по линии 3 выводят реакционную смесь, которую подают в отгонную зону колонны 13 по линии 3. Отгонная зона колонны 13 представляет собой ректификационную колонну.
Сверху ректификационной колонны 13 по линии 5 выводят паровой поток, содержащий преимущественно ДМЭ и метанол. Далее поток охлаждается в конденсаторе дефлегматоре и поступает в колонну 14 по линии 7. Часть сконденсированного потока по линии 6 возвращают в колонну 13 в виде флегмы. Снизу колонны 13 по линии 4 выводят поток, содержащий преимущественно воду. Ректификационная колонна 14 предназначена для разделения ДМЭ от метанола. Сверху ректификационной колонны 14 по линии 8 выводят паровой поток, содержащий ДМЭ. Далее поток охлаждается в конденсаторе дефлегматоре и поступает по линии 10 на склад. Часть сконденсированного потока по линии 9 возвращают в колонну 14 в виде флегмы. Снизу колонны 14 по линии 11 выводят поток, содержащий преимущественно метанол.
Примеры 1-4 показывают реализацию настоящего изобретения по способу получения диметилового эфира, путем контактирования его с дегидратирующими катализаторами с использованием различных вариантов загрузки в реакционную зону молекулярных сит цеолитного типа с крупными порами, выбранных из группы, состоящей из цеолитов структуры FAU, являющихся цеолитами типа X.
Пример 1. Данный пример иллюстрирует реализацию по способу получения диметилового эфира с применением в качестве катализатора молекулярного сита цеолитного типа с крупными порами, выбранного из группы, состоящей из цеолитов структуры FAU, являющееся цеолитом NaX.
Способ получения ДМЭ реализован на установке см.чертеж.
Согласно схемы установки на чертеже метанол в количестве 463,3 кг/ч поступает по линии 1. Его смешивают с рециркулируемым метанольным потоком 11, поступающим из куба колонны 14, подогревают в теплообменнике преимущественно до температуры 310°C и по лини 2 направляют в реакционную зону реактора 12, содержащую цеолит типа NaX, размер гранул 1,8÷2,2 мм, в количестве 0,5 м 3 . Реактор представляет собой аппарат адиабатического типа. Реакция дегидратации осуществляется при температуре 300°C и давлении 2,0 МПа. Конверсия метанола за проход 90%. Из реакционной зоны по линии 3 выводят реакционную смесь. Реакционную смесь из реактора 12 в количестве 1000 кг/ч подают в ректификационную колонну 13 по линии 3. Поток 3 содержит 32,31% ДМЭ; 53,67% метанола и 14,02% воды. Процесс ректификации осуществляют при абсолютном давлении в кубе колонны 13 равном 0,37 МПа, верха колонны 13 равном 0,32 МПа. Температуры: куба — 140°C; тарелки питания — 55°C; верха — 40°C.
Сверху ректификационной колонны 13 по линии 5 выводят паровой поток, содержащий ДМЭ и метанол. Далее поток охлаждается в конденсаторе дефлегматоре и поступает в колонну 14, по линии 7 выводится 859,8 кг/ч продукта, содержащего 37,60% ДМЭ и 62,40% метанола. Часть сконденсированного потока по линии 6 возвращают в колонну 13 в виде флегмы. Снизу колонны 13 по линии 4 выводится поток, содержащий преимущественно воду в количестве 140,2 кг/ч. Ректификационная колонна 14 предназначена для разделения ДМЭ от метанола. Сверху ректификационной колонны 14 по линии 8 выводится паровой поток, содержащий ДМЭ. Далее поток охлаждается в конденсаторе дефлегматоре и поступает по линии 10 на склад в количестве 323,1 кг/ч. Часть сконденсированного потока по линии 9 возвращается в колонну 14 в виде флегмы. Снизу колонну 14 по линии 11 выводится поток, содержащий преимущественно метанол в количестве 536,7 кг/ч.
Пример 2. Данный пример иллюстрирует реализацию по способу получения диметилового эфира аналогично примеру 1, отличающемуся тем, что в качестве катализатора применяют молекулярное сито цеолитного типа с крупными порами, выбранное из группы, состоящей из цеолитов структуры FAU, являющееся цеолитом НХ.
Пример 3. Данный пример иллюстрирует реализацию по способу получения диметилового эфира аналогично примеру 1, отличающийся тем, что в качестве катализатора применяют молекулярное сито цеолитного типа с крупными порами, выбранное из группы, состоящей из цеолитов структуры FAU, являющихся цеолитом LiX.
Пример 4. Данный пример иллюстрирует реализацию по способу получения диметилового эфира аналогично примеру 1, отличающемуся тем, что в качестве катализатора применяют молекулярное сито цеолитного типа с крупными порами, выбранное из группы, состоящей из цеолитов структуры FAU, являющихся цеолитом HLiX.
Показатели качества полученных диметиловых эфиров приведены в таблице 1.
Достигаемый технический результат
Преимуществом заявляемой установки перед прототипом являются:
— получение ДМЭ высокой концентрации 99,99% и выше без постороннего запаха, что позволит его использовать в качестве газа вытеснителя аэрозольных упаковок;
— получение ДМЭ высокого качества с низким содержанием воды до 0,0001%;
— получение ДМЭ с низким содержанием сернистых соединений до 0,0001%;
— предложен катализатор дегидратации метанола в виде молекулярных сит цеолитного типа с крупными порами, выбранных из группы, состоящей из цеолитов структуры FAU, являющихся цеолитами типа X и их модификациями, который позволил увеличить конверсию ДМЭ до 90% и выше.
Способ получения диметилового эфира из метанола, путем его контактирования с дегидратирующим катализатором в реакционной зоне и разделении компонентов реакционной смеси с помощью ректификации с возвращением непрореагировавшего метанола в реакционную зону, при котором дегидратацию метанола и образование эфира проводят в присутствии катализатора при повышенной температуре, отличающийся тем, что в качестве катализатора применяют молекулярные сита цеолитного типа с крупными порами, выбранные из группы, состоящей из цеолитов структуры FAU, являющихся цеолитами типа X и их модификациями, дегидратацию осуществляют в газообразном состоянии при температуре в реакционной зоне 280÷330°C и давлении 17÷22 атм, в первой ректификационной колонне отгоняют от воды фракцию, состоящую из метанола и диметилового эфира, во второй ректификационной колонне отгоняют от непрореагировавшего метанола диметиловый эфир и возвращают метанол в реакционную зону.






















