Честь открытия в 1856 г. и первого практического применения металлотермии принадлежит Николаю Николаевичу Бекетову — выдающемуся русскому физико-химику и металлургу.
Металлотермия — это металлургический процесс, в основе которого лежит реакция восстановления металла из его кислородного или иного соединения другим более активным металлом.
В методах металлотермии в качестве восстановителей используют Al, Na, Ca, Mg, B, Si и др.
Примеры металлотермических реакций:
Методы металлотермии в настоящее время широко используются в металлургии:
Ø для получения металлотермических ферросплавов и лигатур, например, феррованадия, феррохрома и др.
Ø в термической сварке,
Ø для легирования стали.
Среди металлотермических процессов ведущее место занимает алюмотермия — алюмотермическое восстановление оксидов металлов по реакции:
Алюмотермические процессы используются для восстановления оксидов редких тугоплавких металлов (титана, ванадия, ниобия, циркония, вольфрама, молибдена, тантала), а также оксидов хрома, марганца, бария, кальция, железа, никеля.
Широкое применение алюмотермии обусловлено рядом преимуществ:
ü высокой восстановительной способностью алюминия;
ü возможностью получения более чистых сплавов, чем с кремнием и углеродом;
ü простотой производства алюминиевого порошка;
ü высокой величиной теплового эффекта реакции;
ü высокой температурой кипения, уменьшающей испарение алюминия.
Факторы, определяющие выход металла при алюмотермическом процессе
Величина максимально возможного извлечения металла при алюмотермии характеризуется отношением M : MnOm в состоянии равновесия. Зависимость константы равновесия реакции алюмотермического восстановления оксидов от температуры определяется выражением:
Повышение температуры в соответствии с принципом Ле-Шателье приводит к уменьшению абсолютной величины изменения энергии Гиббса и к снижению восстановления оксидов.
В точках плавления наклон кривой зависимости изменения энергии Гиббса от температуры изменяется, что определяется величиной изменения энтропии плавления:
При плавлении DS > 0, при этом для реагентов наклон кривой возрастает, для продуктов — уменьшается, в соответствии с уравнением 
Кривые часто апроксимируются прямыми. Так, для реакций:
2) 2/3 MoO3 + 4/3 Al ® 2/3 Mo + 2/3 Al2O3

 |
 |
Характерной особенностью реакции алюмотермического восстановления оксидов является малая величина коэффициента при температуре. Это означает, что энтальпийный фактор DН значительно превышает энтропийный фактор T×DS. Это приводит к незначительному влиянию температуры на равновесные концентрации металла и его оксида.
Термодинамический анализ показывает, что восстановление таких оксидов, как NiO, MoO3, Fe2O3, WO3 должно протекать практически полностью. Это подтверждается экспериментально.
Рассмотрим термодинамические условия протекания реакций восстановления на примере Cr2O3.
Так как мольная доля Cr2O3 в шлаке не превышает 0,07 %, а Cr2O3 и Al2O3 близки по строению и обладают неограниченной растворимостью можно активности заменить концентрацией (или мольной долей).

Система (1) является трехкомпонентной (Cr, O, Al) и состоит из двух фаз — металла и шлака. В соответствии с правилом фаз её состояние равновесия при постоянном давлении определяется двумя независимыми переменными — температурой и концентрацией одного из компонентов.
Концентрация остальных веществ определяется из уравнений связи:
При подстановке уравнений связи, уравнение (2) приобретает вид:
Полагая, что
- 4.2.1. Понятие о металлургии: общие способы получения металлов.
- Металлотермия получение металлов уравнения реакций
- Таблица Менделеева
- Универсальная таблица растворимости
- Коллекция таблиц к урокам по химии
- Общая характеристика и способы получения металлов
- Пирометаллургия
- Гидрометаллургия
- Электрометаллургия
- 💥 Видео
Видео:Получение металлов. 9 класс.Скачать

4.2.1. Понятие о металлургии: общие способы получения металлов.
Металлургия — это комплексная отрасль промышленности, которая занимается производством металлов.
Поскольку большинство металлов в природе существует в виде различных соединений, то химическая суть металлургических процессов заключается в восстановлении металлов:
В зависимости от того, какой используется восстановитель и каковы условия, при которых проводят процессы восстановления различают пиро-, гидро-, электро- и биометаллургию.
Пирометаллургия (от греч. огонь и металлургия) представляет собой все химические способы восстановления металлов из руд, осуществляемые с применением высоких температур.
В качестве восстановителей в пирометаллургии используют уголь (кокс), оксид углерода (II), водород, активные металлы, кремний.
Оксидные руды чаще всего восстанавливают коксом или оксидом углерода (II) — этот процесс носит название карботермия:
Для извлечения металлов пирометаллургическим способом из сульфидных руд их сначала подвергают предварительному отжигу:
А затем, полученный оксид восстанавливают коксом:
Тугоплавкие металлы, например, молибден и вольфрам, восстанавливают водородом:
Если восстановителями химически активные металлы, то этот пирометаллургический способ называют металлотермия. В зависимости от природы металла-восстановителя различают алюминотермию, или алюмотермию, — восстановление алюминием и магнийтермию — восстановление магнием. Способ металлотермии позволяет восстанавливать металлы не только из оксидов, но и с галогенидов:
Известен способ восстановления металлов кремнием, называемый силикотермией:
Гидрометаллургия представляет собой метод получения металлов, заклющийся в преобразовании природных соединений металлов в растворимую форму с последующим восстановлением металла из раствора. О возможности применения гидрометаллургических процессов для извлечения металлов еще в 1763 г.. Говорил М. В. Ломоносов. Гидрометаллургического способами добывают благородные (золото, серебро, платину), цветные (медь, никель, цинк, кобальт), редкие (цирконий, гафний, тантал) и другие металлы:
К преимуществам данного способа относится возможность его использования для получения металлов при их малом содержании в руде, которую невозможно перерабатывать обычными способами; снижение во многих случаях загрязнения окружающей среды, например, при обжиге сульфидных руд.
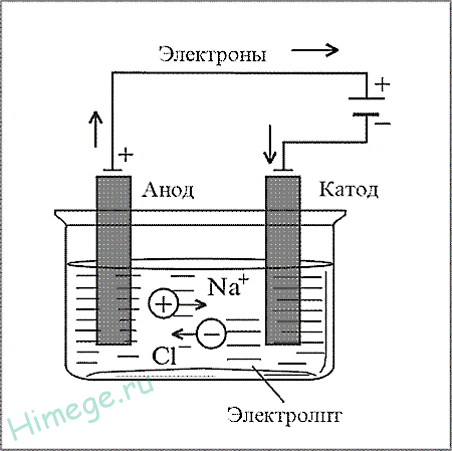
Электрометаллургия — это способ получения металлов с применением электрического тока — электролиза. Электролизом расплавов получают самые активные металлы (от лития до марганца в ряду активности), электролизом водных растворов — менее активные (Zn, Cu, Ni, Cr и т.д.).
Биометалургия основана на биохимических процессах, протекающих при использовании микроорганизмов. Известно, что микроорганизмы типа литотрофы (с лат. – «поедающие камни») могут преобразовывать нерастворимые сульфиды металлов в растворимые сульфаты. Сейчас с применением микроорганизмов добывают медь (в США данный метод достигает 10% от общего ее производства), уран, рений, серебро, никель, свинец, а также некоторые редкие металлы.
Видео:способы получения металловСкачать

Металлотермия получение металлов уравнения реакций
ХИМИЯ – это область чудес, в ней скрыто счастье человечества,
величайшие завоевания разума будут сделаны
именно в этой области.(М. ГОРЬКИЙ)
Таблица
Менделеева
Универсальная таблица растворимости
Коллекция таблиц к урокам по химии
Видео:Химия 9 класс : Получение металловСкачать

Общая характеристика и способы получения металлов
Значительная химическая активность металлов (взаимодействие с кислородом воздуха, другими неметаллами, водой, растворами солей, кислотами) приводит к тому, что в земной коре они встречаются главным образом в виде соединений: оксидов, сульфидов, сульфатов, хлоридов, карбонатов и т. д. В свободном виде встречаются металлы, расположенные в ряду напряжений правее водорода (Аg, Нg, Рt,Аu, Сu), хотя гораздо чаще медь и ртуть в природе можно встретить в виде соединений.
Минералы и черные породы, содержащие металлы и их соединения, из которых выделение чистых металлов технически возможно и экономически целесообразно, называют рудами.
Получение металлов из руд — задача металлургии.
Металлургия — это и наука о промышленных способах получения металлов из руд, и отрасль промышленности.
Любой металлургический процесс — это процесс восстановления ионов металла с помощью различных восстановителей. Суть его можно выразить так:
Чтобы реализовать этот процесс, надо учесть активность металла, подобрать восстановитель, рассмотреть технологическую целесообразность, экономические и экологические факторы.
В соответствии с этим существуют следующие способы получения металлов:
Видео:Взаимодействие металлов с кислотами. 8 класс.Скачать

Пирометаллургия
Пирометаллургия — восстановление металлов из руд при высоких температурах с помощью углерода, оксида углерода (II), водорода, металлов — алюминия, магния.
Например, олово восстанавливают из касситерита SnО2, а медь — из куприта Cu2O
прокаливанием с углем (коксом):
SnО2+ 2С = Sn + 2СО ↑; Cu2O + С = 2Cu+ СО ↑
Сульфидные руды предварительно подвергают обжигу при доступе воздуха, а затем полученный оксид восстанавливают углем:
2ZnS + 302 = 2ZnО + 2SO2 ↑; ZnО + С = Zn + СО ↑
сфалерит (цинковая обманка)
Из карбонатных руд металлы выделяют также путем прокаливания с углем, т. к. карбонаты при нагревании разлагаются, превращаясь в оксиды, а последние восстанавливаются углем:
FeСO3 = FеО + СO2 ↑ ; FеО + С = Fе + СО ↑
сидерит (шпатовый железняк)
Восстановлением углем можно получить Fе, Сu, Zn, Сd, Ge, Sn, Рb и другие металлы, не образующие прочных карбидов (соединений с углеродом).
В качестве восстановителя можно применять водород или активные металлы:
К достоинствам этого метода относится получение очень чистого металла.
2) TiO2+ 2Мg = Тi + 2МgO (магнийтермия)
Чаще всего в металлотермии используют алюминий, теплота образования оксида
которого очень велика (2А1 + 1,5 O2 = Аl2O3 + 1676 кДж/моль). Электрохимический ряд напряжений металлов нельзя использовать для определения возможности протекания реакций восстановления металлов из их оксидов. Приближенно установить возможность этого процесса можно на основании расчета теплового эффекта реакции (Q), зная значения теплот образования оксидов:
где Q1— теплота образования продукта, Q2 -теплота образования исходного вещества.
Доменный процесс (производство чугуна):
C + O2 = CO2, CO2 + C ↔ 2CO
3Fe2O3 + CO = 2(Fe 2 Fe 3 2)O4+ CO2
(Fe 2 Fe 3 2)O4+ CO= 3FeO + CO2
FeO + CO= Fe + CO2
(чугун содержит до 6,67% углерода в виде зерен графита и цементита Fe3C);
Выплавка стали (0,2-2,06% углерода) проводится в специальных печах (конвертерных, мартеновских, электрических), отличающихся способом обогрева. Продувание воздуха, обогащенного кислородом, приводит к выгоранию из чугуна избыточного углерода, а также серы, фосфора и кремния в виде оксидов. При этом оксиды либо улавливаются в виде отходящих газов (CO2, SO2), либо связываются в легко отделяемый шлак – смесь Ca3(PO4)2 и CaSiO3. Для получения специальных сталей в печь вводят легирующие добавки других металлов.
Видео:Химические свойства металлов. 9 класс.Скачать

Гидрометаллургия
Гидрометаллургия — это восстановление металлов из их солей в растворе.
Процесс проходит в два этапа: 1) природное соединение растворяют в подходящем реагенте для получения раствора соли этого металла; 2) из полученного раствора данный металл вытесняют более активным или восстанавливают электролизом. Например, чтобы получить медь из руды, содержащей оксид меди СuО, ее обрабатывают разбавленной серной кислотой:
Затем медь либо извлекают из раствора соли электролизом, либо вытесняют из сульфата железом:
Таким образом, получают серебро, цинк, молибден, золото, уран.
Видео:Реакции металлов с кислородом и водой. 8 класс.Скачать

Электрометаллургия
Электрометаллургия — восстановление металлов в процессе электролиза растворов или расплавов их соединений.
Этим методом получают алюминий, щелочные металлы, щелочноземельные металлы. При этом подвергают электролизу расплавы оксидов, гидроксидов или хлоридов.
а) NaCl (электролиз расплава) → 2Na + Cl2
💥 Видео
§12, 9 кл. Получение металловСкачать

Химия 11 класс (Урок№10 - Общая характеристика и способы получения металлов.)Скачать

Сплавы металлов. 9 класс.Скачать

Термит. Термитные составы. Металлотермия. 25+ реакций термитных (и не очень) смесей.Скачать

Нахождение металлов в природе. Способы получения металловСкачать

Все реакции с металлами за 1 урок | ЕГЭ по химии 2024 | Екатерина СтрогановаСкачать

Химия. 9 класс. Получение металлов /04.12.2020/Скачать

Взрывные реакции металлов. Интерметаллиды.Скачать

Химия 9 класс (Урок№22 -Положение металлов в периодической системе химических элементов Менделеева.)Скачать

подготовка к кр металлыСкачать

Что Будет, Если СПЛАВИТЬ ВСЕ МЕТАЛЛЫ Вместе?Скачать

Общая характеристика металлов. 9 класс.Скачать

Химия 11 класс (Урок№13 - Сплавы металлов.)Скачать

Получение алканов. Реакция Кольбе (механизм + сложные случаи). ЕГЭ по химии.Скачать