Если удалить пространство из всех атомов человеческого тела, то то, что останется, сможет пролесть в игольное ушко.
- —>СТАТИСТИКА —>
- —>МЫ ВКОНТАКТЕ —>
- —>НЕМНОГО РЕКЛАМЫ —>
- Наши спонсоры
- Как паять алюминий при помощи медного купороса
- Понадобится
- Как паять алюминий без специального флюса
- Смотрите видео
- Опасна ли химическая грелка и как ее сделать своими руками.
- А теперь о том, как не надо делать химическую грелку.
- Особенности предлагаемой автором грелки из медного купороса.
- 3 комментария
- 📽️ Видео
—>СТАТИСТИКА —>
—>МЫ ВКОНТАКТЕ —>
—>НЕМНОГО РЕКЛАМЫ —>
Наши спонсоры
Водород – это необычайно легкий газ – он в 14 раз легче воздуха и в два раза легче гелия. Если надуть им резиновый шарик, он взлетит ввысь. Это свойство водорода использовали раньше для наполнения воздушных шаров и дирижаблей.
Сегодня мы будем получать водород химическим способом из легкодоступных материалов и заставим шарик летать.
Мы изучили несколько способов получения водорода при помощи химической реакции. При выборе мы исходили из наличия доступных реактивов и безопасности. И самый простой способ получить водород в домашних условиях – это реакция алюминия, медного купороса и пищевой соли в воде (Al+CuSO4+NaCl+H2O).
Для эксперимента нам понадобилось следующее оборудование: бутылка пластиковая 1л, капельница (продается в любой аптеке за копейки), медный купорос (в хоз-товарах в отделе удобрения для растений), пищевая соль, алюминиевая пищевая фольга (или алюминиевая проволока), надувной шарик.
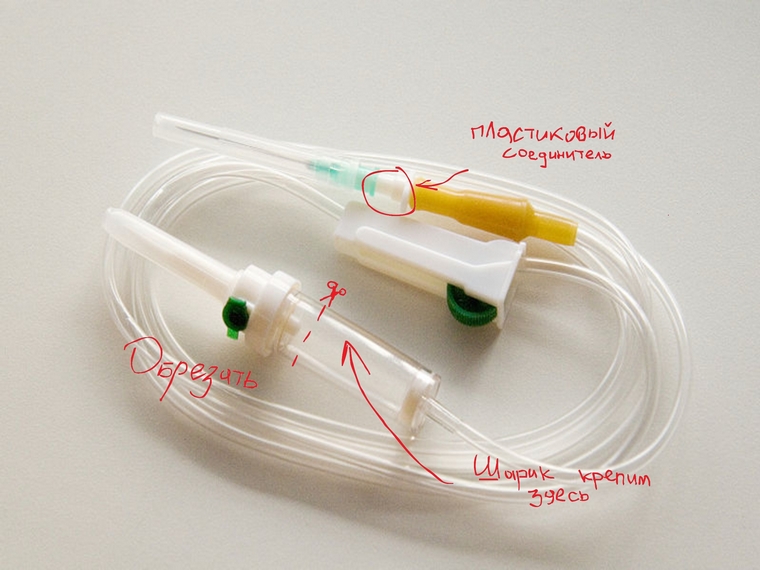
В пробке от пластиковой бутылки нагретым на плите гвоздем проделываем отверстие. В это отверстие вставляем пластиковый соединитель от капельницы и приклеиваем (мы использовали супер-клей). Затем на этот соединитель надеваем трубку капельницы. Толстый конец капельницы обрезаем, как показано на рисунке. На него мы надеваем резиновый шарик.
В литровую пластиковую бутылку насыпали равное количество медного купороса и пищевой соли (по 100г, соли можно больше).
Затем залили водой (примерно 700 мл) и взболтали до полного растворения.
Раствор окрасился в ярко зеленый цвет.
Далее необходимо заготовить алюминиевые комочки из пищевой фольги (такие по размеру, чтобы легко и быстро проходили в горлышко бутылки) . Если есть алюминиевая проволока, используйте ее (метра два алюминиевой проволоки сложите зигзагом, чтобы получился пучок легко пролезающий в бутылку). Мы использовали и то ,и другое.
Бутылку с раствором медного купороса и соли нужно поставить предварительно в емкость с водой (кастрюля или ведерко). Так как в ходе реакции бутылка будет сильно нагреваться и может расплавиться. ( Также раствор может быстро закипеть без охлаждения и выскочить наружу прежде, чем Вы закроете пробку. Проверено!).
Затем нужно закинуть в бутылку проволоку и фольгу и закрыть подготовленной крышкой с трубкой. Делать это нужно быстро, так как реакция начинается мгновенно и водород начинает выделяться сразу.
Мы наблюдем, как образуется множество пузырьков водорода около алюминия. Над поверхностью раствора виден белый дымок пара. При реакции выделяется большое количество тепла и наша бутылка сильно нагревается. Со временем цвет раствора меняется на более темный, а затем и вовсе становится черным. Комочки алюминия окрашиваются в ржаво-оранжевый цвет. Это на них выделяется медь из раствора медного купороса.
Через отверстие в пробке по трубке водород поступает в шарик. Шарик постепенно наполняется водородом и через 10-20 минут реакции уже видно, как он поднимается в воздух.
Примечание: для того, чтобы шарик проще надувался водородом следует до начала эксперимента его растянуть, т.е. надуть несколько раз и сдуть.
Смотрите видео эксперимента.
Как это работает (Химическая реакция):
Алюминий – активный металл. В чистом виде он вступает в химическую реакцию с водой, растворяясь в ней, при этом выделяется водород. Но, если бросить алюминий в воду, никакой реакции не наблюдается. Почему?! А все потому, что алюминий защищен оксидной пленкой. Чтобы реакция началась нужно разрушить эту пленку. Под действием медного купороса ( CuSO 4 ) + пищевой соли ( NaCl ) эта оксидная плёнка разрушается, а алюминий реагирует с водой с образованием водорода H 2 и гидроокиси алюминия Al ( OH )3.
Медный купорос и хлорид натрия образуют комплекс. Раствор становится ярко зеленого цвета.
2) Образовавшийся хлорид меди CuCl 4 разрушает оксидную пленку алюминия.
3) 2 Al + 6 H 2 O = 2 Al ( OH )3 + 3 H 2 ↑
Происходит реакция алюминия с водой с выделением водорода ( H 2 ).
1) CuSO4 + 4NaCl Na2[CuCl4] + Na2SO4
Медный купорос и хлорид натрия образуют комплекс. Раствор становится ярко зеленого цвета.
2) Образовавшийся хлорид меди CuCl4 разрушает оксидную пленку алюминия.
3) 2Al + 6 H2O = 2 Al(OH)3 + 3 H2↑
Происходит реакция алюминия с водой с выделением водорода (H2).
Видео:медный купорос + соль и алюминий = водород. цветной опытСкачать

Как паять алюминий при помощи медного купороса
Существует множество способов как припаять проводник к алюминиевой поверхности, но этот немного особенный. Данный метод является химическим и заключается в предварительном покрытии алюминия микрослоем меди. Но не стоит пугаться, так как все крайне просто, а все реактивы доступны абсолютно каждому.
Видео:7 ПРОСТЫХ ХИМИЧЕСКИХ ОПЫТОВ!Скачать

Понадобится
- Хлорное железо (III) для травления плат.
- Медный купорос.
- Поваренная соль.
- Вода.
- Припой и флюс. На Алиэкспресс со скидкой — http://alii.pub/64fqb2
Инструменты: ватные палочки, пластиковая губка на прищепке, шприц, обойный нож, пластиковая ложка, терка жесткая, паяльник и пр.
Видео:Химическая реакция йода и алюминия.Скачать

Как паять алюминий без специального флюса
Наливаем с помощью шприца чистую воду в неметаллическую емкость, например, в пластиковый одноразовый стаканчик и добавляем в воду медный купорос.
Закрываем емкость крышкой и энергично встряхиваем некоторое время, чтобы медный купорос полностью растворился в воде.
Отмеряем и переливаем с помощью шприца 7 миллилитров водного раствора медного купороса в стеклянную емкость, добавляем строго одну каплю хлорного железа с помощью пипетки и тщательно перемешиваем пластиковой ложечкой.
В качестве алюминиевой поверхности используем алюминиевую баночку. Удаляем в двух отстоящих друг от друга местах на боковой поверхности банки краску посредством ножа.
Берем ватную палочку. Мокаем ее в раствор медного купороса и хлорного железа. Далее мокаем в соль.
Затем начинаем многократно проводить ватной палочкой по зачищенной поверхности.
При этом будет наблюдаться небольшое повышение температуры. В результате мы удалим оксидную пленку и подготовим поверхность. В конце чистой бумажной салфеткой удаляем все следы обработки.
Вновь смачиваем свежую ватную палочку в растворе, но уже без поваренной соли, и снова натираем поверхность.
Замечаем, как слой меди мгновенно покрывает алюминиевую поверхность.
Полируем ее стальной теркой.
Ну вот и все. Припаять уже к медной поверхности не составит труда.
Данный способ относительно быстр и прост. Не содержит дефицитных реактивов и вполне может быть применен по назначению.
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Смотрите видео
Видео:Водород из поваренной соли, алюминия и медного купоросаСкачать

Опасна ли химическая грелка и как ее сделать своими руками.
В сети можно найти немало разработок самодельных химических грелок для рыболовов и туристов. Работа грелки основана на химической реакции с участием воды, соли, алюминия и медного купороса. Грелка используется для отогревания окоченевших пальцев рук на рыбалке. Можно с помощью нее разогреть остывшую пищу.
Надо признать, что реактивы не из дешевых сейчас, возможно проще и выгодней взять каталитическую грелку, одной заправки хватает на 6-8 часов работы, после 200-300 применений просто меняется платиновый элемент. Но, как утверждает автор разработки, которую мы рассматриваем, у китайской каталитической грелки есть свои минусы. Если попадется хилый китай, то катализатора хватит на неделю. К тому же, такая грелка чувствительна к температуре. В наружном кармане корпус остывает, топливо перестает испарятся и грелка без топлива перестает выдавать тепло. Капризная она в этом плане. Даже чехол не спасает. А уж если ее замерзшими руками взять, то совсем быстро остынет.
Какой алюминий использован в грелке? Пищевая фольга. Ширина 28 см, длина 20 см, толщина 14 мкм. Соотношение медного купороса и кухонной соли 2:1. В пробку вклеен бамбуковый шампур на термоклей.
В эксперименте очень холодная вода. Смесь нагревается до комнатной температуры за счет растворения безводного медного купороса. Взбалтываем бутылочку со смесью для ускорения химической реакции. Фольга на шампуре будет равномерно нагревать жидкость в бутылке. В ходе реакции будет выделяться водород и тепло, которое ускорит реакцию. Давление в бутылке нужно контролировать и постоянно стравливать водород. Алюминий растворяется а из раствора выделяется медь. Если в течение минуты газ не выделяется, значит реакция закончилась. В принципе воду можно даже вскипятить, но такого нагрева не выдержит бутылка.
А теперь о том, как не надо делать химическую грелку.
Желая свести время реакции к минимуму, автор видео решил увеличить площадь контакта алюминия. С этой целью он измельчил алюминиевые пластинки. Далее, как обычно заложил в бутылку в нужной пропорции соль и медный купорос. Залил водой. Размешал. Закинул алюминиевую болванку и закрутил крышку. Приоткрыв крышку, чтобы стравить водород, он получил заряд с грязной горячей жидкостью на себя.
Посмотрите на видео эксперимент, показывающий химическую реакцию, лежащую в основе грелки и как ее сделать своими руками. Ну, а если вы хотите увидеть сразу, «во что вылилось» нарушение технологии, то есть об опасностях химических грелок, то с момента 3:41.
Особенности предлагаемой автором грелки из медного купороса.
Подобный рецепт кочует по сети не один десяток лет, но в нем все сводится к смешиванию солей, добавлению опилок, алюминия и воды. И при этом не
ясно как регулировать скорость реакции, температуру грелки и как отводить выделяющиеся газы. Автор выбрал простой путь. Короткая, но активная химическая реакция дает тепло, которое удерживает смесь солей. Это позволяет экономить реактивы и удерживать температуру в комфортном диапазоне.
По мере остывания грелки можно добавлять новые порции алюминия.
Скорость химической реакции зависит от концентрации, температуры и площади поверхности реагирующих веществ. Поэтому алюминий в виде фольги, а не проволоки, труб, уголков и прочего. Т.к. концентрация солей в процессе реакции падает, то солей должно быть с избытком. Растворимость медного купороса в 100 граммах воды при 25 градусах Цельсия 23 грамма. Больше 4-х кратного количества брать не советую т.к. в процессе реакции выделяется медь в виде тончайшего порошка, которая сгущает раствор солей и препятствует циркуляции раствора. Медный купорос прокаливался с целью повысить начальную температуру раствора, чтобы не ждать несколько лишних минут до начала реакции, но можно обойтись и без этого.
Деревянный шампур призван утопить сверток фольги и изолировать его от стенок бутылки. В противном случае фольга покрывается множеством пузырьков и всплывает. При этом все тепло выделяется в верхней части бутылки, что приводит к сильному разогреву и деформации стенок. В случае с шампуром, пузырьки газа заставляют жидкость циркулировать, поэтому постоянно встряхивать бутылку и выпускать газ не обязательно. Достаточно просто не закручивая пробку, дать бутылке пару минут постоять. По этому же принципу работают армейские
беспламенные нагреватели пищи.
Другая — безопасная грелка, очень интересного принципа работы в другой статье.
Видео:Проводим интересные опыты с медным купоросом!Скачать

3 комментария
CuSO4 + 2NaCl > Na2SO4+CuCl2.
первоначальный разогрев происходит не за счет растворения сульфата мели, а за счет реакции сульфата меди и хлорида натрия.
Образующаяся хлорная медь взаимодействует с алюминием по экзотермической реакции
Кроме того, прокалить купорос и высыпать в воду, бессмысленная бредятина.
Интересно, откуда у автора статьи взялся водород.
Кроме того, надо быть полным идиотом, чтобы при проведении экзотермических реакций герметично закрывать посуду. Газы при нагревании расширяются, следовательно в емкости давление растет, а это к хорошему не приведет! Физику учить надо, бестолочь.
Автору следует записаться и походить в химический кружок во дворце пионеров
Эх, Анатолий, не надо изучать химию в кружках. Тут реакции уровня 10-го класса, и автор совершенно прав насчет водорода. Погуглите хотя бы.
Анатолий, вот вы вроде умный, а хамло конченное
📽️ Видео
Эти изобретения знает только старый Мастер на все руки! Функция медного купоросаСкачать

Галилео. Эксперимент. Растворяем алюминийСкачать

Химическая реакция цинка и медного купоросаСкачать

МЕДНЕНИЕ СТАЛЬНЫХ ДЕТАЛЕЙ ЗА 2 СЕКУНДЫ!!!Скачать

СОЛИ ХИМИЯ 8 КЛАСС: Химические Свойства Солей и Получение // Реакция Солей с Кислотами и МеталламиСкачать

Активный алюминий 🧪 Реакция алюминия с водой ⚗️ Опыты по химииСкачать

Прикольные химические реакции медный купорос + натрия хлорид + алюминийСкачать

ДВС АВТО +Медный купарос.Скачать

разобрал двигатель.. 6000 км прошёл после медного купоросаСкачать

Алюминий против соляной кислоты #химия #опыты #кислоты #scienceСкачать

Веселая наука. Снова медный купоросСкачать

Заключительные Выводы!!! По Омеднению Деталей ДвигателяСкачать

Химический опыт/ Медный купорос+раствор соли+алюминий Weitt channelСкачать

Взаимодействие железа с сульфатом медиСкачать