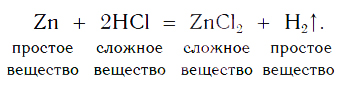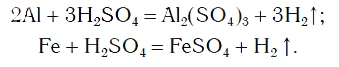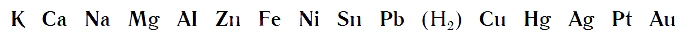- We are checking your browser. gomolog.ru
- Why do I have to complete a CAPTCHA?
- What can I do to prevent this in the future?
- Анодный и катодный процессы при атмосферной коррозии
- Как правильно решать задачи на атмосферную коррозию
- Урок 24. Выделение водорода в реакциях кислот с металлами
- Вытеснительный ряд металлов
- 🔥 Видео
Видео:Тема 20. Выделение водорода в реакциях кислот с металлами. Ряд активности металлов.Скачать

We are checking your browser. gomolog.ru
Видео:Реакции металлов с кислородом и водой. 8 класс.Скачать

Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
Видео:Химия. 7 класс. Реакции разбавленных кислот с металлами /26.01.2021/Скачать

What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 702e1b426e0e9711 • Your IP : 87.119.247.227 • Performance & security by Cloudflare
Видео:Взаимодействие металлов с кислотами. 8 класс.Скачать

Анодный и катодный процессы при атмосферной коррозии
Видео:СЕРНАЯ КИСЛОТА разбавленная и концентрированная - в чем отличия? | Химия ОГЭСкачать

Как правильно решать задачи на атмосферную коррозию
Задание 281.
Как происходит атмосферная коррозия луженого и оцинкованного железа при нарушении покрытия? Составьте электронные уравнения анодного и катодного процессов.
Решение:
а) Олово имеет менее отрицательный стандартный электродный потенциал (-0,14 В), чем железо (-0,44 В), поэтому оно является катодом, железо – анодом. При контакте олова и железа в атмосфере разрушаться будет железо:
Анодный процесс: Fe 0 — 2 
Катодный процесс в нейтральной среде: 1/2O2 + H2O + 2 
Так как ионы Fe 2+ с гидроксид-ионами ОН- образуют нерастворимый гидроксид, то продуктом коррозии будет Fe(OH)2.
б) Цинк имеет более отрицательный стандартный электродный потенциал (-0,763 В), чем железо (-0,44 В), поэтому он является анодом, железо – катодом.
Анодный процесс: Zn0 — 2 
Катодный процесс в нейтральной среде: 1/2O2 + H2O + 2 
Так как ионы Zn 2+ с гидроксид-ионами ОН – образуют нерастворимый гидроксид, то продуктом коррозии будет Zn(OH)2.
Задание 282.
Медь не вытесняет водород из разбавленных кислот. Почему? Однако, если к медной пластинке, опущенной в кислоту, прикоснуться цинковой, то на меди начинается бурное выделение водорода. Дайте этому объяснение, составив электронные уравнения анодного и катодного процессов. Напишите уравнение протекающей химической реакции.
Решение:
Стандартный электродный потенциал для полуреакции Cu 0 — 2 
Анодный процесс: Zn 0 — 2 
Катодный процесс: 2Н + + 2 
Ионно-молекулярная форма процесса:
Zn 0 + 2H + = Zn 2+ + Н20↑
Таким образом, при опускании в раствор разбавленной кислоты медной пластинки, контактирующей с цинковой пластинкой, наблюдается выделение пузырьков газообразного водорода, так как протекает реакция:
Zn 0 + 2H + = Zn 2+ + Н20 ↑
Задание 283.
Как происходит атмосферная коррозия луженого железа и луженой меди при нарушении покрытия? Составьте электронные уравнения анодного и катодного процессов.
Решение:
а) Коррозия лужёного железа в атмосферных условиях. Стандартный электродный потенциал системы: Sn 0 — 2 

Анодный процесс: Fe 0 — 2 
Катодный процесс в нейтральной среде: 1/2O2 + H2O + 2 
Так как ионы Fe 2+ с гидроксид-ионами ОН- образуют нерастворимый гидроксид, то продуктом коррозии будет Fe(OH)2.
б) Коррозия лужёной меди в атмосферных условиях. Олово имеет более отрицательный стандартный электродный потенциал (-0,14 В), чем медь (+0,34 В), поэтому оно является анодом, мед – катодом. При контакте олова и меди в атмосфере разрушаться будет олово:
Анодный процесс: Sn 0 — 2 
Катодный процесс в нейтральной среде: 1/2O2 + H2O + 2 
Так как ионы Sn 2+ с гидроксид-ионами ОН- образуют нерастворимый гидроксид, то продуктом коррозии будет Sn(OH)2.
Видео:КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать

Урок 24. Выделение водорода в реакциях кислот с металлами
В уроке 24 «Выделение водорода в реакциях кислот с металлами» из курса «Химия для чайников» познакомимся с рядом активности металлов, а также больше узнаем о кислотах в химических реакциях.
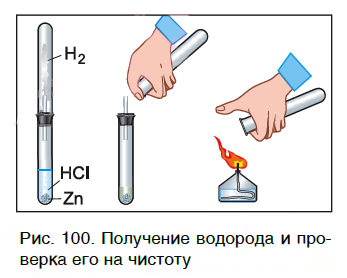
Характерное химическое свойство кислот — выделение из них водорода в реакциях с некоторыми металлами. Атомы металлов замещают атомы водорода в молекулах кислот, в результате чего водород выделяется в виде газа. В пробирку с хлороводородной кислотой опустим кусочек цинка. На поверхности металла образуются, а затем выделяются из раствора пузырьки газа. Соберем этот газ в пробирку и поднесем ее к пламени спиртовки (рис. 100). Мы услышим хлопок. Это свидетельствует о наличии в пробирке водорода.
Каплю образовавшегося раствора поместим на стеклянную пластинку и подогреем ее в пламени спиртовки. После испарения воды на пластинке остается вещество белого цвета. Опытным путем можно установить, что состав этого вещества выражается формулой ZnCl2.
Теперь мы можем записать уравнение реакции цинка с кислотой:
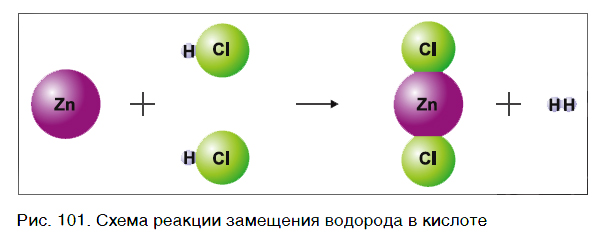
На рисунке 101 дана схема этой реакции. Из уравнения и поясняющей его схемы видим, что атомы цинка замещают атомы водорода в кислоте. В результате из простого вещества цинка и сложного вещества хлороводородной кислоты образуются два новых: сложное вещество ZnCl2 и простое вещество водород Н2.
Так же протекают реакции алюминия, железа, других металлов и с раствором серной кислоты:
Эти химические реакции подтверждают, что кислоты являются сложными веществами, состоящими из атомов водорода,
способных замещаться на атомы металла, и кислотных остатков.
Видео:8 класс. Кислоты. Химические свойства разбавленных кислот.Скачать

Вытеснительный ряд металлов
При проведении опыта вы убедились, что алюминий энергично вытесняет водород из раствора хлороводородной кислоты. С железом реакция вытеснения водорода протекает менее энергично, а с медью вовсе не идет.
По интенсивности вытеснения водорода из кислот металлы можно разместить в ряд:
Его называют рядом активности или вытеснительным рядом металлов.
Чем левее расположен металл в вытеснительном ряду до водорода (Н2), тем активнее он вытесняет водород из кислот. Металлы, стоящие в ряду правее водорода, из кислот водород не вытесняют.
Зная расположение металлов в вытеснительном ряду, заранее можно предсказать:
- Будут ли реагировать металлы с кислотами с выделением водорода;
- Насколько активно будут протекать эти реакции.
Для получения водорода из кислот в лаборатории или школьном кабинете химии необходимо брать металлы, которые в вытеснительном ряду стоят до водорода. Но не каждый металл подходит для этих целей. Активные металлы натрий и калий реагируют с кислотами со взрывом, а реакции кислот с оловом и свинцом протекают медленно. Наиболее подходящими металлами для практического получения водорода являются цинк и алюминий. Как вы убедились, при проведении реакций этих металлов с раствором хлороводородной кислоты они протекают спокойно и достаточно быстро.
Краткие выводы урока:
- Кислоты — сложные вещества, состоящие из атомов водорода, способных замещаться на атомы металлов, и кислотных остатков.
- Металлы, стоящие в вытеснительном ряду до водорода, вытесняют его из кислот.
- В лаборатории водород получают в реакции металлов с кислотами.
Надеюсь урок 24 «Выделение водорода в реакциях кислот с металлами» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
🔥 Видео
Медь и азотная кислота 🧑🔬Скачать

1. КАК МЕТАЛЛЫ РЕАГИРУЮТ С КИСЛОТАМИ/ Нужно знать/ ЕГЭ химия 2020Скачать

Реакции кислот с металлами. Урок 23. Химия 7 класс.Скачать

Опыты по химии. Отношение кислот к металламСкачать

Взаимодействие металлов со сложными веществамиСкачать

Химия. 8 класс. Реакции металлов с растворами кислот /21.10.2020/Скачать

Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Особенности серной и азотной кислот | Химия ЕГЭ, ЦТСкачать

Взаимодействие серной кислоты с металламиСкачать

Взаимодействие кислот с металламиСкачать

Серная кислота и металлы за 10 минут | ХИМИЯ ЕГЭ | СОТКАСкачать

КислотыСкачать

Сильные и слабые кислотыСкачать