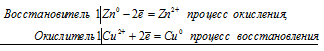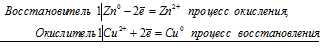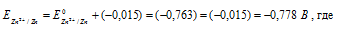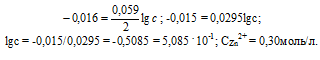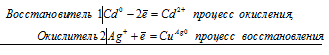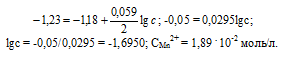- Решение задач по химии на составление электронных и молекулярных уравнений реакций окисления
- Медь может вытеснить серебро из раствора его соли уравнение
- Реакция взаимодействия нитрата серебра (I) и меди
- Реакция взаимодействия нитрата серебра (I) и меди
- Реакция взаимодействия оксида натрия, оксида азота (II) и оксида азота (IV)
- Реакция взаимодействия карбида скандия и соляной кислоты
- Реакция взаимодействия сульфата скандия (III) и гидроксида натрия
- Выбрать язык
- Разделы
- ТОП 5 записей
- Популярные записи
- Элементы, реакции, вещества
- Предупреждение.
- 📽️ Видео
Видео:Вымещение серебра медью из раствораСкачать

Решение задач по химии на составление электронных и молекулярных уравнений реакций окисления
Задание 241.
В два сосуда с голубым раствором медного купороса поместили в первый цинковую пластинку, а во второй серебряную. В каком сосуде цвет раствора постепенно пропадает? Почему? Составьте электронные и молекулярные уравнения соответствующей реакции.
Решение:
Стандартные электродные потенциалы цинка, меди и серебра соответственно равны -0,76 В, +0,34 В и +0,80 В. Исходя из того, что цинк имеет более электроотрицательный потенциал, чем медь, то между цинком и медным купоросом проходит реакция (цинк вытесняет медь из соли), и раствор соли при этом обесцвечивается, так как образуется бесцветный сульфат цинка:
Zn0 + Cu 2+ = Zn 2+ + Cu 0
Zn + CuSO4 = ZnSO4 + Cu
Серебро, имея более электроположительный потенциал, чем медь не способно вытеснять ионы меди из сульфата меди, поэтому раствор медного купороса, с опущенной в него серебряной пластинкой, не обесцвечивается.
Задание 242.
Увеличится, уменьшится или останется без изменения масса цинковой пластинки при взаимодействии ее с растворами: а) CuSO4; б) МgSO4; в) Рb(NO3)2? Почему? Составьте электронные и молекулярные уравнения соответствующих реакций.
Решение:
а) Стандартные электродные потенциалы цинка и меди соответственно равны -0,76 В и +0,34 В. Исходя из того, что цинк имеет более электроотрицательный потенциал, чем медь, то между цинком и медным купоросом проходит реакция (цинк вытесняет медь из соли), и раствор соли при этом обесцвечивается, так как образуется бесцветный сульфат цинка, а цинковая пластинка будет уменьшаться по массе:
Zn 0 + Cu 2+ = Zn 2+ + Cu 0
б) Так как стандартный электродный потенциал цинка (-0,76 В) больше, чем стандартный электродный потенциал магния (-2,36 В), то цинк не способен вытеснять магний из растворов его солей, поэтому цинковая пластинка останется без изменений.
в) Так как стандартный электродный потенциал цинка (-0,76 В) меньше, чем у свинца (-0,13 В), то металлический цинк будет обладать большими восстановительными способностями чем ионы Pb 2+ , и реакция будет протекать с растворением цинковой пластинки, т. е. её масса будет уменьшаться.
Zn 0 + Pb 2+ = Zn 2+ + Pb 0
Задание 243.
При какой концентрации ионов Zn 2+ (в моль/л) потенциал цинкового электрода будет на 0,015 В меньше его стандартного электродного потенциала? Ответ: 0,30 моль/л.
Решение:
Найдём значение электродного потенциала цинка в растворе его соли:
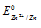
Электродный потенциал металла (Е) зависит от концентрации его ионов в растворе. Эта зависимость выражается уравнением Нернста:
Е 0 – стандартный электродный потенциал металла; n – число электронов, принимающих участие в процессе; с – концентрация ионов металла в растворе его соли (при точных вычислениях – активность). Так как уменьшение потенциала цинка равно 0,015 В, то используя уравнение Нернста, получим выражение для расчета концентрации ионов цинка в растворе:
Ответ: 0,30 моль/л.
Задание 244.
Увеличится, уменьшится или останется без изменения масса кадмиевой пластинки при взаимодействии ее с растворами:
а); AgNO3; б) ZnSO4; в) NiSO4? Почему? Составьте электронные и молекулярные уравнения соответствующих реакций.
Решение:
а) Стандартные электродные потенциалы кадмия и серебра соответственно равны -0,403 В и +0,80 В. Исходя из того, что кадмий имеет более электроотрицательный потенциал, чем серебро, то между кадмием и нитратом серебра проходит реакция (кадмий вытесняет серебро из соли), и кадмиевая пластинка при этом будет уменьшаться по массе.
Cd 0 + 2Ag + = Cd 2+ + 2Ag 0
б) Так как стандартный электродный потенциал кадмия (-0,403 В) больше, чем стандартный электродный потенциал цинка (-0,76 В), то кадмий не способен вытеснять цинк из растворов его солей, поэтому кадмиевая пластинка останется без изменений.
в) Так как стандартный электродный потенциал кадмия (-0,403 В) меньше, чем у никеля (-0,25 В), то металлический кадмий будет обладать большими восстановительными способностями чем ионы Ni 2+ , и реакция будет протекать с растворением кадмиевой пластинки, т. е. её масса будет уменьшаться.
Cd 0 + Ni 2+ = Cd 2+ + Ni 0
Задание 245.
Марганцевый электрод в растворе его соли имеет потенциал -1,23 В. Вычислите концентрацию ионов Мn 2+ (моль/л). Ответ. 1,89 . 10-2 моль/л.
Решение:
Электродный потенциал металла (Е) зависит от концентрации его ионов в растворе. Эта зависимость выражается уравнением Нернста:
Е 0 – стандартный электродный потенциал металла; n – число электронов, принимающих участие в процессе; с – концентрация ионов металла в растворе его соли (при точных вычислениях – активность). Так как уменьшение потенциала цинка равно 0,015 В, то используя уравнение Нернста, получим выражение для расчета концентрации ионов Mn 2+ в растворе:
Ответ. 1,89 . 10 -2 моль/л.
Видео:ЧИСТЕЙШЕЕ СЕРЕБРО после восстановления медью из раствора ЭкспериментСкачать

Медь может вытеснить серебро из раствора его соли уравнение
Дана схема превращений
Вычислите сумму молярных масс (г/моль) твёрдого при температура 20 °С неорганического вещества и органического вещества молекулярного строения
Медь способна вытеснять серебро из растворов солей серебра, т. к. медь более активный металл. В результате получается:
Одно из веществ, получившихся в результате реакции будет веществом «А», другое – «Б». Серебро – простое вещество, не подвергается разложения, следовательно, вещество «А» — это нитрат меди. Все нитраты при нагревании разлагаются. Нитрат меди разлагается:
Вещество «Х» — твердое вещество, следовательно, это оксид меди. Молярная масса = 80 г/моль.
Вещество «Б» — серебро. При взаимодействии с концентрированной азотной кислотой образуются соли – нитраты, оксид азота (IV) и вода::
С аммиаком может вступать в реакцию оксид азота как кислотный оксид. И так как ему соответствуют две кислоты азотная и азотистая, то при взаимодействии с основаниями или с аммиаком должно получатся две соли : нитрит и нитрат. Но данные соли не взаимодействуют с альдегидами . Следовательно, надо вспомнить химические свойства альдегидов и предложить предыдущее превращение. Альдегиды взаимодействуют с аммиачным раствором оксида серебра, который получают при смешивании нитрата серебра с раствором аммиака.
Следовательно, с аммиаком взаимодействует нитрат серебра и получается аммиачный раствор оксида серебра .
Аммиачный раствор оксида серебра окисляет альдегиды в соответствующие кислоты. В данном случае получается уксусная кислота. . Молярная масса = 60 г/моль
Видео:Серебро медью из электролита.Скачать

Реакция взаимодействия нитрата серебра (I) и меди
Видео:Как удалить медь с серебрянных контактовСкачать

Реакция взаимодействия нитрата серебра (I) и меди
Уравнение реакции взаимодействия нитрата серебра (I) и меди:
Реакция взаимодействия нитрата серебра (I) и меди.
В результате реакции образуются нитрат меди (II) и серебро.
Реакция протекает при нормальных условиях.
Формула поиска по сайту: 2AgNO3 + Cu → Cu(NO3)2 + 2Ag.
Реакция взаимодействия оксида натрия, оксида азота (II) и оксида азота (IV)
Реакция взаимодействия карбида скандия и соляной кислоты
Реакция взаимодействия сульфата скандия (III) и гидроксида натрия
Выбрать язык
Разделы
ТОП 5 записей
Популярные записи
Элементы, реакции, вещества
Предупреждение.
Все химические реакции и вся информация на сайте предназначены для использования исключительно в учебных целях — только для решения письменных, учебных задач. Мы не несем ответственность за проведение вами химических реакций.
Химические реакции и информация на сайте
не предназначены для проведения химических и лабораторных опытов и работ.
📽️ Видео
АФФИНАЖ СЕРЕБРА - ВЫТЕСНЕНИЕ МЕДЬЮ!Скачать

Осаждение серебра на медьСкачать

КАК ДОБЫТЬ МЕДЬ, БЕЗ ЭЛЕКТРОЛИЗА? ИЗ ОТРАБОТАННЫХ РАСТВОРОВ!Скачать

Серебряные контакты. Предварительная очистка от лишних металлов.Скачать

АФФИНАЖ СЕРЕБРА 80 ИЗ КОНТАКТОВ НА МЕДИ.Скачать

Медная проволока реагирует с раствором нитрата серебра #ShortsСкачать

Аффинаж серебра из контактов на меди. Восстановление щёлочью и сахаром, мой первый опыт.Скачать

Что будет при соединении меди и нитрата серебра | Shorts короткие видео приколы, юмор, познавательноСкачать

СЕРЕБРО из контактов на медной подложкеСкачать

Два способа восстановления серебра 99 и 999 СравнениеСкачать

Серебро. Аффинаж аудиопленки и серебра на медиСкачать

Восстановление меди железом из отработанных растворовСкачать

Серебро скуски и на медиСкачать

Получение СЕРЕБРА из нитрата серебра. Реакция МЕДИ и НИТРАТА СЕРЕБРА. Опыты по химии.Getting SILVER.Скачать

Серебро. Восстановление медью. Будет ли 999? Добыл красный кислород?Скачать