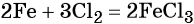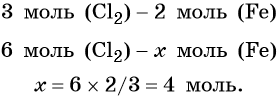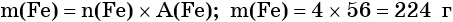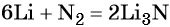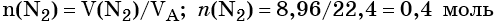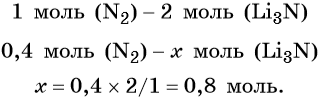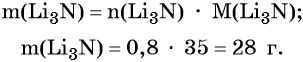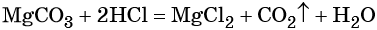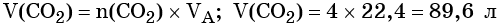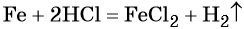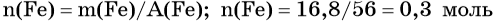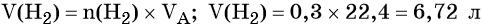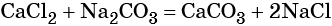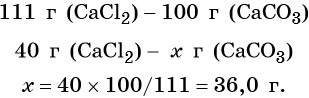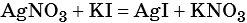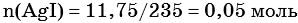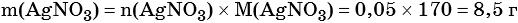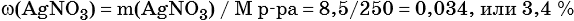Основой для проведения количественных расчётов в химии является закон сохранения массы. Согласно этому закону масса реагентов равна массе продуктов реакции.
Отсюда следует, что для любой химической реакции массы реагентов и продуктов реакции относятся между собой как молярные массы веществ, умноженные на их стехиометрические коэффициенты.
Для расчёта по химическим уравнениям можно использовать два эквивалентных способа: через количество вещества или через пропорцию. Подчеркнём ещё раз: официального запрета на использование метода пропорций при решении задач на ОГЭ и ЕГЭ нет!
Для определения массы (или количества вещества) продуктов реакции или исходных веществ по уравнениям химических реакций вначале составляют уравнение химической реакции и устанавливают стехиометрические коэффициенты; затем определяют молярную массу, массу и количество вещества известных реагентов химической реакции; составляют и решают пропорцию, в которую в зависимости от условий задачи вводят числовые значение величин: молярные массы, массы, количества веществ или их объёмы (для газов).
При этом в одном столбце пропорций должны находиться одинаковые характеристики вещества с одной и той же размерностью.
Пример 1. Масса железа, вступившего в реакцию с 6 моль хлора, равна _________ г. (Ответ запишите с точностью до целого числа.)
Решение. Составляем уравнение химической реакции:
Из этого уравнения следует, что 3 моль Cl2 реагируют с 2 моль Fe, т. е.:
Определяем массу железа:
Пример 2. Масса нитрида лития, образовавшегося в результате его реакции с азотом объёмом 8,96 л, равна_______________ г.
Решение. Составляем уравнение химической реакции:
Определяем количество вещества азота, вступившего в реакцию:
Из уравнения реакции следует, что из 1 моль N2 образуется 2 моль Li3N, т. е.:
Определим массу Li3N:
Пример 3. Объём углекислого газа, образовавшегося в результате разложения карбоната магния количеством вещества 4 моль избытком соляной кислоты, равен________ л.
Решение. Составляем уравнение химической реакции:
Из этого уравнения следует, что количество вещества углекислого газа и карбоната магния равны между собой, т. е. n(CO2) = 4 моль.
Пример 4. Объём водорода, который выделится при растворении 16,8 г железа в избытке разбавленной соляной кислоты, равен _________ л.
Решение. Составляем уравнение химической реакции:
Определим количество вещества железа:
Количество вещества железа и водорода в данном уравнении реакции равны между собой. Следовательно, количество вещества водорода также равно 0,3 моль.
Вычислим объём водорода:
Пример 5. Масса осадка, который образуется в результате взаимодействия 40,0 г хлорида кальция с избытком карбоната натрия, равна _________г.
Решение. Составляем уравнение реакции:
Согласно уравнению химической реакции составим пропорцию и решим её:
Пример 6. 250 г раствора нитрата серебра смешали с избытком раствора йодида калия. Выпал осадок массой 11,75 г. Вычислите массовую долю нитрата серебра в исходном растворе.
Элементы ответа (допускаются иные формулировки ответа, не искажающие его смысла)
1) Составлено уравнение химической реакции:
2) По массе осадка йодида серебра рассчитано его количество вещества, а затем в соответствии с уравнением реакции — количество вещества и масса нитрата серебра, содержащегося в исходном растворе:
Из уравнения реакции следует, что n(AgI) = n(AgNO3) = 0,05 моль, тогда:
3) Вычислена массовая доля нитрата серебра в исходном растворе:
| Критерии оценивания | Баллы |
| Ответ правильный и полный, включает все названные элементы | 3 |
| Правильно записаны два первых элемента из названных выше | 2 |
| Правильно записан один из названных выше элементов (1-й или 2-й) | 1 |
| Все элементы ответа записаны неверно | 0 |
| Максимальный балл | 3 |
- Тренировочные задания
- Расчеты массы (объема, количества вещества) продукта реакции, если одно из веществ дано в виде раствора с определенной массовой долей растворенного вещества
- Содержание:
- 21. Задачи Вычисление массовой доли растворенного вещества
- 1. К раствору силиката калия массой 25,5 г и массовой долей 10% прилили избыток раствора нитрата кальция. Вычислите массу образовавшегося осадка.
- 2. К раствору сульфата алюминия массой 60,8 г и массовой долей 15% прилили избыток раствора хлорида бария. Вычислите массу образовавшегося осадка.
- 3. Вычислите объём газа (н. у.), который выделится при действии избытка сульфида железа(II) на 500 г 12%-ного раствора серной кислоты.
- 4. Через 60 г раствора с массовой долей гидроксида натрия 11% пропустили сернистый газ. При этом образовался сульфит натрия. Вычислите объём (н. у.) вступившего в реакцию газа.
- 5. Раствор соляной кислоты массой 182,5 г и массовой долей 10% добавили к избытку сульфида магния. Вычислите объём (н. у.) выделившегося газа.
- 6. После пропускания через раствор гидроксида калия 6,72 л сернистого газа (н. у.) получили 340,5 г раствора сульфита калия. Вычислите массовую долю соли в полученном растворе.
- 7. При взаимодействии 120 г раствора нитрата свинца с небольшим избытком раствора иодида калия выпало 10,5 г осадка. Рассчитайте массовую долю нитрата свинца в исходном растворе.
- 8. При растворении 18,25 г технического цинка в избытке разбавленной соляной кислоты выделилось 5,6 л (н. у.) водорода. Определите массовую долю примесей в этом образце цинка.
- 9. Рассчитайте массу осадка, который выпадет при взаимодействии избытка карбоната калия с 31,4 г раствора нитрата бария с массовой долей последнего 10%.
- 10. В избытке соляной кислоты растворили 2,11 г. руды, содержащей 71% карбоната железа(II). Определите объём углекислого газа, выделившегося при этом.
- 11. При растворении в избытке разбавленной серной кислоты цинка, содержащего 9,5% нерастворимых примесей, выделилось 4,48 л (н. у.) водорода. Определить массу исходного образца металла, содержащего примеси.
- 12. При обжиге 96 кг пирита (минерала, содержащего FeS2 ) образовался сернистый газ объёмом 30,69 м 3 (в пересчёте на н. у.). Рассчитайте массовую долю негорючих примесей в пирите.
- 13. К 150 г раствора карбоната натрия добавили избыток разбавленной серной кислоты, и раствор нагрели до окончания выделения газа. Всего выделилось 4,48 л газа (н. у.). Рассчитайте массовую долю карбоната натрия в исходном растворе.
- 14. К 200 г баритовой воды добавили избыток раствора карбоната натрия, выпал осадок массой 8,9 г. Определите массовую долю гидроксида бария в исходном растворе.
- 15. Какой объём воздуха (н. у.) потребуется для полного сжигания 36 кг дисульфида железа(II) FeS2 до сернистого газа? Объёмная доля кислорода в воздухе составляет 21%.
- 16. К раствору с массовой долей гидроксида натрия 15% добавили избыток раствора сульфата меди(II). При этом образовался осадок массой 24,5 г. Определите массу исходного раствора щелочи.
- 17. Оксид меди(II) массой 38 г может прореагировать с 154 г раствора соляной кислоты. Определите массовую долю кислоты в растворе.
- 18. При взаимодействии 19,6 г гидроксида меди(II) с соляной кислотой получили 134 г раствора хлорида меди(II). Вычислите массовую долю соли в полученном растворе.
- 19. Через 126 г раствора с массовой долей азотной кислоты 30% был пропущен аммиак, который полностью прореагировал. Определите объём (н.у.) аммиака, вступившего в реакцию.
- 20. Определите объемную долю аммиака в его газовой смеси с воздухом, если известно, что на нейтрализацию 150 л (н.у.) этой смеси было израсходовано 2,913 л 4,9 %-ного раствора серной кислоты плотностью 1,03 г/мл (продукт реакции – средняя соль).
- 21. Какой объем газа (при н.у.) выделится при взаимодействии избытка меди со 100мл 9,54 %-ного раствора азотной кислоты (ρ=1,057 г/мл)
- 22. Какой объем сероводорода (при н.у.) образуется при взаимодействии 880 г технического сульфида железа(II), содержащего 10% примесей, с раствором, содержащим 10 моль соляной кислоты
- 23. На мрамор, содержащий 5% примесей, подействовали избытком 10%-ного раствора азотной кислоты , при этом выделилось 5,6 л (при н.у.) газа. Определите массу использованного минерала
- 24. Какой объем 60%-ного раствора азотной кислоты плотностью 1,305 г/мл можно получить, используя азотсодержащий продукт каталитического окисления 896 л (при н.у.) аммиака?
- 25. Техническую кальцинированную соду, содержащий 5% примесей, обработали избытком соляной кислоты. При этом выделилось 2 моль углекислого газа. Определите массу технической соды, вступившей в реакцию с кислотой
- 💥 Видео
Видео:ОГЭ. Задание 22. Решение задач. Часть 1. Растворы и осадки.Скачать

Тренировочные задания
1. К 300 г раствора нитрата бария прибавили избыток раствора сульфата натрия. Масса выпавшего осадка составила 23,3 г. Определите концентрацию соли в исходном растворе.
2. К 150 г раствора сульфата натрия прибавили избыток раствора хлорида бария. Масса выпавшего осадка составила 23,3 г. Определите концентрацию соли в исходном растворе.
3. К 300 г раствора силиката натрия прибавили избыток раствора нитрата кальция. Масса выпавшего осадка составила 12,0 г. Определите концентрацию соли в исходном растворе.
4. К 150 г раствора карбоната калия прибавили избыток раствора соляной кислоты. При этом выделился газ объёмом 3,36 л (н. у.). Определите концентрацию соли в исходном растворе.
5. К 250 г раствора гидрокарбоната натрия прибавили избыток раствора бромоводородной кислоты. При этом выделился газ объёмом 5,6 л. Определите концентрацию соли в исходном растворе.
6. К 50 г раствора карбоната натрия прибавили избыток раствора хлорида бария. Масса выпавшего осадка составила 7,88 г. Определите концентрацию соли в исходном растворе.
7. К 200 г раствора хлорида бария прибавили избыток раствора карбоната калия. Масса выпавшего осадка составила 7,88 г. Определите концентрацию соли в исходном растворе.
8. К 200 г раствора хлорида железа (II) прибавили избыток раствора гидроксида калия. Масса выпавшего осадка составила 18,0 г. Определите концентрацию соли в исходном растворе.
9. К 400 г раствора нитрата свинца прибавили избыток раствора йодида натрия. Масса выпавшего осадка составила 23,05 г. Определите концентрацию соли в исходном растворе.
10. К 300 г раствора йодида натрия прибавили избыток раствора нитрата свинца. Масса выпавшего осадка составила 23,05 г. Определите концентрацию соли в исходном растворе.
11. Определите массу осадка, который выпадет при взаимодействии 150 г 14,8%-ного раствора хлорида кальция с избытком раствора карбоната натрия.
12. Определите объём газа (н. у.), который выделится при взаимодействии 120 г 8,8%-ного раствора карбоната натрия с избытком раствора соляной кислоты.
13. Определите массу соли, которая выпадет в осадок при взаимодействии 140 г 13,5%-ного раствора нитрата цинка с избытком раствора сульфида натрия.
14. Определите массу осадка, который выделится при взаимодействии 200 г 18,8%-ного раствора нитрата меди с избытком раствора сульфида натрия.
15. Определите массу осадка, который выпадет при взаимодействии 200 г 6,1%-ного раствора силиката натрия с избытком раствора хлорида цинка.
16. Определите массу осадка, который выделится при взаимодействии 200 г 12,7%-ного раствора хлорида железа (II) с избытком раствора сульфида натрия.
17. Определите массу осадка, который выделится при взаимодействии 50 г 17%-ного раствора нитрата серебра с избытком раствора бромида калия.
18. Определите массу осадка, который образуется при взаимодействии 200 г 6,1%-ного раствора силиката натрия с избытком раствора нитрата кальция.
19. Определите массу осадка, который образуется при взаимодействии 50 г 5,8%-ного раствора хлорида магния с избытком раствора фосфата натрия.
20. Определите объём газа, который выделится при взаимодействии 200 г 6,9%-ного раствора карбоната калия с избытком раствора соляной кислоты.
21. Оксид фосфора (V) массой 21,3 г растворили в растворе гидроксида калия, в результате чего был получен раствор средней соли массой 500 г. Определите концентрацию фосфата калия в конечном растворе.
22. Раствор хлорида железа (II) полностью прореагировал со 120 г раствора гидроксида натрия, в результате чего образовалось 6,0 г осадка. Определите массовую долю гидроксида натрия в исходном растворе.
23. Какой объём аммиака (н. у.) может полностью прореагировать со 150 г 20%-ного раствора серной кислоты с образованием средней соли?
24. В 200 г 20%-ного раствора соляной кислоты растворили магний до прекращения выделения газа. Определите объём выделившегося при этом водорода (н. у.).
25. Аммиак объёмом 10 л (н. у.) пропустили через раствор серной кислоты с массовой долей 8% до образования средней соли. Определите массу исходного раствора.
26. Определите объём сероводорода (н. у.), который необходимо пропустить через 130 г 6%-ного раствора хлорида меди (II) до полного осаждения сульфида меди (II).
27. Сероводород объёмом 3,36 л (н. у.) пропустили через раствор гидроксида натрия, в результате чего получили 180 г раствора сульфида натрия. Определите массовую долю соли в полученном растворе.
28. Алюминий массой 8,1 г может нацело прореагировать с 250 г раствора серной кислоты. Определите массовую долю серной кислоты в исходном растворе.
29. К 250 г раствора нитрата серебра добавили раствор хлорида калия до прекращения выделения осадка, масса которого составила 14,35 г. Определите массовую долю нитрата серебра в исходном растворе.
30. К 300 г 5%-ного раствора хлорида магния добавили избыток раствора фосфата калия. Вычислите массу выпавшего при этом осадка.
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Расчеты массы (объема, количества вещества) продукта реакции, если одно из веществ дано в виде раствора с определенной массовой долей растворенного вещества
Содержание:
Вычисления количественных характеристик продуктов реакций (масса, объём, моль) в случаях, когда одно вещество находится в растворённом виде и имеет определённую массовую долю
Алгоритм данного вида расчётов следующий:
- Нахождение массы растворённого в-ва. В зависимости от условий задачи расчёт может вестись или
- по формуле: m(р.в.) = m(р-ра)·ω(р.в.) /100% с известными массовыми долями р-ра и растворённого в-ва;
- по формуле m(р-ра) = p(р-ра)·V(р-ра) с известными объёмом р-ра, его плотностью, массовой долей растворённого в-ва. Затем вычисляется масса растворённого в-ва как в подпункте а).
- Определить кол-во молей в-ва, чью массу сосчитали в п.1: n(в-ва) = m(в-ва)/M(в-ва), здесь M –молярная масса в-ва.
- Составить уравнение хим. реакции с правильно расставленными коэффициентами.
- На основе принципа равенства отношений количеств участников химического взаимодействия к своим коэффициентам сделать расчёт кол-ва молей, нужного для ответа на вопрос задачи вещества: n(А)/n(B) = k(А)/k(В)
- По найденному кол-ву в-ва при необходимости вычислить массу: m = M·n Применительно к газообразным в-вам использовать формулу: V(газа) = Vm·n(газа) = n(газа)·22,4 л/моль
| Пример | |
| Условие | |
| Решение |
Определить число молей H2SO4: Составить уравнение данной реакции: Исходя из равенства отношений количеств H2SO4 и BaSO4 к своим коэффициентам и преобразовав пропорцию, определить кол-во осаждённого BaSO4 в молях: Вычислить массу осадка: m(BaSO4) = M(BaSO4) ∙ n(BaSO4) = 233 г/моль ∙ 0,3 моль = 69,9 г масса выпавшего осадка BaSO4 равна 69,9 г Видео:Расчет выхода продукта от теоретически возможного. 10 класс.Скачать  21. Задачи Вычисление массовой доли растворенного вещества1. К раствору силиката калия массой 25,5 г и массовой долей 10% прилили избыток раствора нитрата кальция. Вычислите массу образовавшегося осадка.Решение 1) Составим уравнение реакции: 2) Рассчитаем массу и количество вещества силиката калия, содержащегося в растворе: 3) Определим массу осадка: по уравнению реакции Ответ: 1,93 г. 2. К раствору сульфата алюминия массой 60,8 г и массовой долей 15% прилили избыток раствора хлорида бария. Вычислите массу образовавшегося осадка.Решение 1) Составим уравнение реакции: 2) Рассчитаем массу и количество вещества сульфата алюминия, содержащегося в растворе: 3) Определим массу осадка: по уравнению реакции Ответ: 18,66 г. 3. Вычислите объём газа (н. у.), который выделится при действии избытка сульфида железа(II) на 500 г 12%-ного раствора серной кислоты.Решение 1) Составим уравнение реакции: 2) Рассчитаем массу и количество вещества серной кислоты, содержащейся в растворе: 3) Определим объём сероводорода: по уравнению реакции Ответ: 13,66 л. 4. Через 60 г раствора с массовой долей гидроксида натрия 11% пропустили сернистый газ. При этом образовался сульфит натрия. Вычислите объём (н. у.) вступившего в реакцию газа.Решение 1) Составим уравнение реакции: 2) Рассчитаем массу и количество вещества гидроксида натрия, содержащегося в растворе: m(NaOH) = (m(р-ра)∙ω)/100% = (60∙11)/100 = 6,6 г.; n(NaOH) = m(NaOH)/M(NaOH) = 6,6/40 = 0,165 моль. 3) Определим объём сернистого газа, вступившего в реакцию: по уравнению реакции n(SO2) = 0,5∙n(NaOH) = 0,5∙0,165 = 0,0825 моль; Ответ: 1,85 л. 5. Раствор соляной кислоты массой 182,5 г и массовой долей 10% добавили к избытку сульфида магния. Вычислите объём (н. у.) выделившегося газа.Решение 1) Составим уравнение реакции: 2) Рассчитаем массу и количество вещества соляной кислоты, содержащейся в растворе: m(HCl) = (m(р-ра)∙ω)/100% = (182.5∙10)/100 = 18,25 г. n(HCl) = m(HCl)/M(HCl) = 18,25/36,5 = 0,5 моль. 3) Определим объём выделившегося газа: по уравнению реакции n(H2S) = 0,5∙n(HCl) = 0,5∙0,5 = 0,25моль; Ответ: 5,6 л. 6. После пропускания через раствор гидроксида калия 6,72 л сернистого газа (н. у.) получили 340,5 г раствора сульфита калия. Вычислите массовую долю соли в полученном растворе.Решение 1) Составим уравнение реакции: 2) Рассчитаем массу и количество вещества сульфита калия, полученного в результате реакции: по уравнению реакции 3) Определим массовую долю сульфита калия в растворе: Ответ: 13,92 % 7. При взаимодействии 120 г раствора нитрата свинца с небольшим избытком раствора иодида калия выпало 10,5 г осадка. Рассчитайте массовую долю нитрата свинца в исходном растворе.Решение 1) Составим уравнение реакции: 2) Рассчитаем количество вещества и массу нитрата свинца: по уравнению реакции 3) Определим массовую долю нитрата свинца в растворе: Ответ: 6,34 % 8. При растворении 18,25 г технического цинка в избытке разбавленной соляной кислоты выделилось 5,6 л (н. у.) водорода. Определите массовую долю примесей в этом образце цинка.Решение 1) Составим уравнение реакции: 2) Рассчитаем количество вещества водорода и цинка: по уравнению реакции 3) Определим массу чистого цинка и массовую долю примесей: m(Zn) = n(Zn)∙M(Zn) = 0,25∙65 = 16,25 г. m(примесей) = m(технич.Zn) — m(Zn) = 18,25 – 16,25 = 2,0 г. ω(примесей) = (m(примесей)/m(технич.Zn))∙100% = (2,0/18,25)∙100 = 10,96 % Ответ: 10,96 %. 9. Рассчитайте массу осадка, который выпадет при взаимодействии избытка карбоната калия с 31,4 г раствора нитрата бария с массовой долей последнего 10%.Решение 1) Составим уравнение реакции: 2) Рассчитаем массу и количество вещества нитрата бария в растворе: 3) Определим массу вещества, выпавшего в осадок: по уравнению реакции Ответ: 2,36 г. 10. В избытке соляной кислоты растворили 2,11 г. руды, содержащей 71% карбоната железа(II). Определите объём углекислого газа, выделившегося при этом.Решение 1) Составим уравнение реакции: 2) Определим массу чистого карбоната железа и его количество вещества: m(FeCO3) = (m(руды)∙ω)/100% = (2,11∙71)/100 = 1,50 г. 3) Рассчитаем количество вещества выделившегося углекислого газа и его объем: по уравнению реакции Ответ: 0,29 л 11. При растворении в избытке разбавленной серной кислоты цинка, содержащего 9,5% нерастворимых примесей, выделилось 4,48 л (н. у.) водорода. Определить массу исходного образца металла, содержащего примеси.Решение 1) Составим уравнение реакции: 2) Рассчитаем количество вещества водорода и цинка: по уравнению реакции 3) Определим массу, массовую долю чистого цинка и массу смеси (исходного образца, содержащего примеси): m(Zn) = n(Zn)∙ M(Zn) = 0,2∙65 = 13 г. ω(Zn) = 100 — ω(примесей) = 100-9,5 = 90,5 % m(смеси) = (m(Zn)∙100)/ω(Zn) = 13∙100/90,5 = 14,36 г. Ответ: 14,36 г. 12. При обжиге 96 кг пирита (минерала, содержащего FeS2 ) образовался сернистый газ объёмом 30,69 м 3 (в пересчёте на н. у.). Рассчитайте массовую долю негорючих примесей в пирите.Решение 1) Составим уравнение сгорания пирита: 2) Рассчитаем количество вещества сернистого газа: 3) Определим массу чистого FeS2, массу примесей и их массовую долю в исходном веществе: Пусть количество вещества пирита приходящегося на 1,37 кмоль сернистого газа составляет x. Тогда по уравнению реакции составим пропорцию: Масса чистого пирита, вступившего в реакцию равна: масса примесей равна: m(примесей) = 99 – 82,2 = 13,8 кг Массовая доля примесей: ω(примесей) = (m(примесей)∙100)/m(пирита) = 13,8∙100/96 = 14,375 % Ответ: 14,375 %. 13. К 150 г раствора карбоната натрия добавили избыток разбавленной серной кислоты, и раствор нагрели до окончания выделения газа. Всего выделилось 4,48 л газа (н. у.). Рассчитайте массовую долю карбоната натрия в исходном растворе.Решение 1) Составим уравнение реакции: 2) Рассчитаем количество вещества и массу карбоната натрия: по уравнению реакции 3) Определим массовую долю карбоната натрия в растворе: Ответ: 14,13 %. 14. К 200 г баритовой воды добавили избыток раствора карбоната натрия, выпал осадок массой 8,9 г. Определите массовую долю гидроксида бария в исходном растворе.Решение 1) Составим уравнение реакции: 2) Рассчитаем количество вещества карбоната бария и гидроксида бария: по уравнению реакции 3) Определим массу гидроксида бария и его массовую долю в баритовой воде: Ответ: 3,85 %. 15. Какой объём воздуха (н. у.) потребуется для полного сжигания 36 кг дисульфида железа(II) FeS2 до сернистого газа? Объёмная доля кислорода в воздухе составляет 21%.Решение 1) Составим уравнение реакции: 2) Рассчитаем количества вещества FeS2 и кислорода: Для определения количества вещества кислорода составим пропорцию по уравнению реакции: 3) Рассчитаем объёмы кислорода и воздуха: V(воздуха) = V(O2)∙100/ω(O2) = 18,48∙100/21 = 88 м 3 Ответ: 88 м 3 . 16. К раствору с массовой долей гидроксида натрия 15% добавили избыток раствора сульфата меди(II). При этом образовался осадок массой 24,5 г. Определите массу исходного раствора щелочи.Решение 1) Составим уравнение реакции: 2) Рассчитаем количество вещества выпавшего в осадок гидроксида меди (II): 3) Определим количество вещества, массу гидроксида натрия, массу исходного раствора: по уравнению реакции n(NaOH) = 2n(Cu(OH)2) = 2∙0,25 = 0,5 моль m(NaOH) = n(NaOH)∙M(NaOH) = 0,5∙40 = 20 г. m(р-ра) = m(NaOH)∙100%/ω(NaOH) = 20∙100/15 = 133,33 г. Ответ: 133,33 г. 17. Оксид меди(II) массой 38 г может прореагировать с 154 г раствора соляной кислоты. Определите массовую долю кислоты в растворе.Решение 1) Составим уравнение реакции: 2) Рассчитаем количество вещества оксида меди (II): n(СuO) = m(СuO)/M(СuO) = 38/80 = 0,475 моль. 3) Определим количество вещества, массу соляной кислоты и её массовую долю в растворе: n(HCl) = 2n(CuO) = 2∙0,475 = 0,95 моль m(HCl) = n(HC)∙M(HC) = 0,95∙36,5 = 34,675 г. ω(HCl) = (m(HCl)/m(р-ра))∙100% = (34,675/154)∙100 = 22,52 % Ответ: 22,52 %. 18. При взаимодействии 19,6 г гидроксида меди(II) с соляной кислотой получили 134 г раствора хлорида меди(II). Вычислите массовую долю соли в полученном растворе.Решение 1) Составим уравнение реакции: 2) Рассчитаем количество вещества прореагировавшего гидроксида меди (II): 3) Определим количество вещества, массу образовавшегося хлорида меди (II) и его массовую долю в получившемся растворе: 19. Через 126 г раствора с массовой долей азотной кислоты 30% был пропущен аммиак, который полностью прореагировал. Определите объём (н.у.) аммиака, вступившего в реакцию.Решение 1) Составим уравнение реакции: 2) Рассчитаем массу и количество вещества прореагировавшей азотной кислоты: 3) Определим количество вещества и объём вступившего в реакцию аммиака: 20. Определите объемную долю аммиака в его газовой смеси с воздухом, если известно, что на нейтрализацию 150 л (н.у.) этой смеси было израсходовано 2,913 л 4,9 %-ного раствора серной кислоты плотностью 1,03 г/мл (продукт реакции – средняя соль).Решение 1) Составим уравнение реакции: 2) Рассчитаем массу и количество вещества серной кислоты: 3) Определим количество вещества и объёмную долю аммиака: По уравнению реакции: 21. Какой объем газа (при н.у.) выделится при взаимодействии избытка меди со 100мл 9,54 %-ного раствора азотной кислоты (ρ=1,057 г/мл)Решение 1) Составим уравнение реакции: 2) Рассчитаем массу и количество вещества азотной кислоты: 3) Определим количество вещества и объём выделившегося газа: n(NO) = 0,16∙2/8 = 0,04 моль 22. Какой объем сероводорода (при н.у.) образуется при взаимодействии 880 г технического сульфида железа(II), содержащего 10% примесей, с раствором, содержащим 10 моль соляной кислотыРешение 1) Составим уравнение реакции: 2) Рассчитаем массу и количество вещества FeS: ω(FeS) = 100 — ω(примесей) = 100-10 = 90% m(FeS) = (m(р-ра))∙ω(FeS)/100% = 880∙90/100 = 792 г. n(FeS) = m(FeS)/M(FeS) = 792/88 = 9 моль. 3) Определим объём выделившегося газа: По уравнению реакции: FeS находится в избытке, HCl прореагирует полностью и образуется 5 моль H2S 23. На мрамор, содержащий 5% примесей, подействовали избытком 10%-ного раствора азотной кислоты , при этом выделилось 5,6 л (при н.у.) газа. Определите массу использованного минералаРешение 1) Составим уравнение реакции: 2) Рассчитаем количество вещества CO2: 3) Определим массу минерала: По уравнению реакции: ω(СaCO3) = 100 — ω(примесей) = 100-5 = 95% m(минерала) = m(СaCO3)∙100%/ω(СaCO3) = 25∙100/95 = 26,3 г. 24. Какой объем 60%-ного раствора азотной кислоты плотностью 1,305 г/мл можно получить, используя азотсодержащий продукт каталитического окисления 896 л (при н.у.) аммиака?Решение 1) Составим уравнения реакций: В процессе не образуется азотсодержащих побочных продуктов, т.е. все атомы азота, входившие в NH3, переходят в HNO3. Поэтому можно составить схему для расчета: 2) Рассчитаем количество вещества аммиака: 3) Рассчитаем массу раствора HNO3: По схеме расчета: 4) Рассчитаем объем раствора HNO3: V(HNO3) = m(р-ра)/ρ(HNO3)∙ = 4200/1,305 = 3218,4 мл = 3,22 л. 25. Техническую кальцинированную соду, содержащий 5% примесей, обработали избытком соляной кислоты. При этом выделилось 2 моль углекислого газа. Определите массу технической соды, вступившей в реакцию с кислотойРешение 1) Составим уравнение реакции: 2) Рассчитаем массу чистого Na2CO3: По уравнению реакции: 3) Определим массу технической соды: ω(Na2CO3) = 100 — ω(примесей) = 100-5 = 95% 💥 ВидеоКак Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Химия ПростоСкачать  МОЛЯРНАЯ МАССА ХИМИЯ // Урок Химии 8 класс: Относительная Молекулярная МассаСкачать  8 класс. Массовая доля растворенного вещества. Решение задач.Скачать  Решение задач по уравнениям реакций, если одно из реагирующих веществ взято в избытке. 1 ч. 9 класс.Скачать  Расчеты по уравнениям химических реакций. 1 часть. 8 класс.Скачать  Как ЛЕГКО понять Химию с нуля — Массовая доля вещества // ХимияСкачать  ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать  ХИМИЯ С НУЛЯ — Как решать задачи по Химии на Массовую ДолюСкачать  Задачи на примеси. 1 часть. 9 класс.Скачать  Молярная масса. 8 класс.Скачать  Как за 4 МИНУТЫ выучить Химию? Химическое Количество, Моль и Закон АвогадроСкачать  Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать  Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать  Задача 2. Вычислите количество вещества и массу осадкаСкачать  Сложные задачи на растворы с химическим уравнением и избытком / недостатком.Скачать  Химия. 9 класс. Вычисление массы вещества по уравнению реакции, если известна масса другого веществаСкачать  Закон сохранения массы. Расстановка коэффициентов. Урок 14. Химия 7 класс.Скачать  |