До недавнего времени элементы этой электрохимической системы являлись наиболее распространенными несмотря на то, что появились они одними из первых и сохранились практически в неизмененном виде благодаря своим характеристикам:
— дешевизна и доступность сырья;
— простота технологии производства;
— низкая конечная стоимость, определенная низкими затратами производителя;
— удовлетворительные для большинства областей применения электрические параметры.
Именно соотношение цены и качества дало возможность им почти полтора века удерживать пальму первенства. Но все-таки в последнее время многие производители неуклонно сокращают их производство или полностью отказываются от их выпуска, что объясняется повышением требований производителей современного электронного оборудования к электрическим параметрам источников питания.
К числу недостатков солевых батареек относятся:
— резкое падение напряжения в течение разряда;
— значительное снижение отдаваемой емкости при увеличении разрядных токов до значений, необходимых для современных устройств;
— резкое ухудшение характеристик при отрицательных температурах;
— маленький срок хранения (порядка двух лет).
Понятие «номинальная емкость» редко употребляется для характеристики марганцево-цинковых батареек, так как их емкость сильно зависит от режимов и условий эксплуатации.
Основными недостатками этих элементов являются значительная скорость снижения напряжения на всем протяжении разряда и значительное уменьшение отдаваемой емкости при увеличении тока разряда. Конечное разрядное напряжение устанавливают в зависимости от нагрузки в интервале 0,7-1,0 В.
Важна не только величина тока разряда, но и временной график нагрузки. При прерывистом разряде большими и средними токами работоспособность батареек заметно увеличивается по сравнению с непрерывным режимом работы.Однако при малых разрядных токах и многомесячных перерывах в работе емкость их может снижаться вследствие саморазряда.
Элементы работоспособны в интервале температур от -20 до +60 °С. При длительном воздействии высокой температуры увеличивается саморазряд элементов. А при низкой температуре заметно уменьшается отдаваемая емкость. Но при корректировке рецептуры электролита выпускается серия хладостойких батареек, работоспособных в диапазоне температур от -40 до +40 °С.
На работоспособность солевых марганцево-цинковых элементов существенно сказывается время их хранения с момента изготовления. Саморазряд их определяется, главным образом, коррозией цинкового электрода, а также взаимодействием активных масс положительного электрода с загустителями электролита. В зависимости от рецептур активных масс и электролита, конструктивного исполнения и размеров элементов их сохранность колеблется от 1 года до 3 лет. К концу гарантированного срока утрата емкости может составлять 30-40 %.
При использовании в устройствах, у элементов на последней стадии разряда и по его окончании может произойти течь электролита, что связано с повышением объема активной массы положительного электрода и выдавливанием электролита из его пор. Особенно сильно этот эффект проявляется после разряда большими токами или короткого замыкания. В конце разряда в результате медленного разложения диоксида марганца может также выделяться кислород, а в результате коррозии цинка — водород, что тоже способствует увеличению внутреннего объема батарейки.
Электроды и электролит.Активная масса положительного электрода (называющаяся «агломерат») состоит из смеси диоксида марганца с чешуйчатым графитом либо ацетиленовой сажей и электролитом. При этом технология изготовления MnO2заметно сказывается на электрических характеристиках элементов. Графит и сажа увеличивают электрическую проводимость активной смеси. Их массовая доля составляет 8-20% в зависимости от назначения источника тока. Чем выше разрядные токи, на которые рассчитан марганцево-цинковый элемент, тем выше содержание токопроводящих добавок. Для повышения степени использования окислителя активную массу пропитывают раствором электролита.
Отрицательный электрод изготовляется из коррозионно-стойкого цинка высокой степени чистоты (массовая доля цинка 99,94% и более). Цинк содержит маленькое количество свинца, галлия или кадмия (десятые или сотые доли процента), которые являются ингибиторами коррозии цинка.
Электролитом в элементах этой системы ранее был раствор хлорида аммония (классические элементы Лекланше). Хлорид аммония принимает участие в токообразующих реакциях, обеспечивает ионную проводимость электролита и стабилизирует pH электролита при незначительных токах разряда. Но образование малорастворимых комплексных соединений, выпадающих в объеме катодной массы, приводит, с одной стороны, к росту внутреннего сопротивления элемента, а с другой — к избыточному выведению электролита из области реакции. Поэтому позднее электролит из раствора хлорида аммония был заменен на раствор хлорида цинка, иногда с добавкой хлорида кальция. Такие марганцево-цинковые батарейки могут разряжаться длительное время с относительно высокими плотностями тока и имеют более пологую разрядную кривую. Хлорид цинка ускоряет загустевание электролита, обладает буферными и антигнилостными свойствами. Работоспособность таких элементов при пониженных температурах значительно выше, чем классических. Для снижения температуры замерзания электролита в его состав вводят хлорид кальция. Кроме упомянутых ранее ингибиторов коррозии цинка, иногда дополнительно вводят бихромат калия и сульфат хрома, являющийся дубителем, предотвращающим разжижение электролита при увеличении температуры.
При использовании хлорида аммония электродные процессы описываются следующим уравнением токообразующей реакции:
При использовании хлорида цинка уравнение имеет вид:
Энергетические показатели элементов с хлоридно-цинковым электролитом существенно выше: при средних и повышенных токах нагрузки они могут обеспечить в 1,5-2 раза большую длительность работы. Работоспособность их при пониженных температурах тоже выше.
Конструкция солевых батареек
В солевых элементах корпус, сделанный из цинка, является отрицательным электродом. Положительный электрод представляет из себя брикет из спрессованной активной массы, увлажненный электролитом, в центре которой расположен токоотвод — угольный стержень, пропитанный составами на основе парафина для снижения потери воды из электролита. Сверху токоотвод обжат металлическим колпачком. Электролит в сепараторе загущенный. В элементах есть газовая камера, в которую поступают газы, выделяющиеся при разряде и саморазряде. Сверху размещают прокладку. Для уменьшения вероятности течи в результате питтинговой коррозии тонкостенного цинкового стакана элемент помещают в футляр, картонный или полимерный, иногда дополнительно применяется футляр из белой жести. В этом случае дно и верх элемента также закрывают белой жестью.
Рис. 7.4. Марганцево-цинковый солевой гальванический элемент
Щелочные (алкалиновые) батарейки
Щелочные марганцево-цинковые батарейки начали производить в середине 20 века. Одной из первых их промышленный выпуск освоила компания Duracell (США).
Окислителем является диоксид марганца, а восстановителем — цинк в виде порошка, что позволяет значительно развить поверхность и тем самым уменьшить вероятность пассивации поверхности цинка при больших токах разряда.Для замедления коррозии раньше использовалось амальгамирование (растворение в ртути) как объемное, так и поверхностное. После введения ограничений на применение ртути, применяются цинковые порошки высокой степени чистоты, легированные определенными металлами, а также органические ингибиторы коррозии.
Компоненты щелочных батареек.Активным материалом анода является порошкообразный цинк высокой степени чистоты. Для уменьшения скорости коррозии цинк может быть легирован небольшими добавками свинца, индия, висмута и алюминия. Скорость коррозии цинка существенно возрастает при увеличении содержания в нем железа, поэтому очень важно снижать долю железа до минимального уровня. Средний диаметр частиц цинка — в границах 155-255 мкм, удельная поверхность составляет около 0,02 м 2 /г.
Активная масса анода содержит цинк (объемная доля 18-33 %), загуститель (гель-компонент), раствор электролита, оксид цинка и ингибитор коррозии (см. таблицу). В качестве гель-компонента используют производные целлюлозы, полиакрилаты, поливиниловый спирт и другие полимеры.
Типичный состав анодной массы щелочной батарейки
| Компонент | Содержание (масс. %) |
| Порошок цинка | 55-75 |
| Раствор KOH (32-55%) | 25-45 |
| Оксид цинка | до 2 |
| Загуститель | 0,4-2 |
| Ингибитор коррозии | до 0,05 |
Активная масса катода содержит кроме диоксида марганца, графит либо ацетиленовую сажу, раствор KOH и связующее (см. таблицу). Содержание компонентов в активной массе катода у различных изготовителей может колебаться в широком диапазоне. Например, содержание углеродистых материалов может достигать 15 % и выше.
Типичный состав катодной массы щелочной батарейки
| Компонент | Содержание (масс. %) |
| Диоксид марганца | 79-85 |
| Углерод | 7-10 |
| Раствор KOH (35-55%) | 7-10 |
| Связующее | 0-1 |
В качестве электролита применяются концентрированные растворы KOH (иногда NaOH) с добавками ZnO, а иногда и LiOH. Электролит загущен природными или синтетическими полимерными соединениями, содержащими OH-группы.
В начале процесса разряда происходит окисление цинка с образованием цинката ZnO2 2 — (или Zn(OH)4 2 — ). После насыщения раствора электролита цинкатом, начинается вторичный процесс:
Zn + 2OH — → Zn(OH)2+ 2
с последующим разложением гидроксида цинка на ZnO и Н2О. На второй стадии в элементе наступает баланс выделения и поглощения ионов ОН — и щелочь не расходуется, благодаря этому для его работы хватает малого количества электролита, который заполняет только поры электродов и межэлектродное пространство.
Порошковый цинковый электрод обеспечивает существенное увеличение коэффициента использования активного материала в сравнении с солевыми элементами.При беспрерывном разряде средними и повышенными токами щелочные элементы обеспечивают емкость большую (до 7-10 раз), чем солевые элементы тех же габаритов.Щелочные элементы лучше функционируют и при низких температурах: при -20 ºС отдают такую же емкость, как солевые в режиме беспрерывного разряда при комнатной температуре. Скорость саморазряда щелочных марганцево-цинковых элементов меньше: после 1 года хранения при +20 °С или 3 месяцев при +50 °С потери емкости составляют примерно 10 % начальной емкости.Гарантийный срок хранения щелочных элементов составляет 5-7 лет, иногда он достигает 10 лет.
Итак, при одинаковых размерах солевых и щелочных батареек продолжительность работы последних при одинаковых малых токах в 1,5-2 раза больше, а при больших — в 4-10 раз больше.
Конструкция щелочных батареек
Размеры цилиндрических элементов совпадают с размерами элементов марганцево-цинковой системы с солевым электролитом. В то же время, устройство щелочных батареек отличается от устройства солевых аналогов: щелочные элементы имеют как бы вывернутую конструкцию (рис. 7.5).
Рис. 7.5. Марганцево-цинковый щелочной гальванический элемент
В элементах со щелочным электролитом цинк всегда находится в виде порошка, поэтому вместо цинкового стаканчика применяют стальной никелированный цилиндрический корпус, служащий токоотводом положительного электрода. Активная масса положительного электрода подпрессовывается к внутренней стенке корпуса. В щелочном элементе можно расположить больше активной массы положительного электрода, чем в солевом элементе того же объема. Например, в щелочной элемент типоразмера D можно поместить 37-41 г диоксида марганца, тогда как в солевой элемент помещается только 22-28 г. Во внутреннюю полость, образованную активной массой положительного электрода, вставляется сепаратор, пропитанный электролитом. В качестве сепарационных материалов применяются гидратцеллюлозные пленки (целлофан) либо нетканые полимерные материалы. По оси элемента размещен латунный токоотвод отрицательного электрода, а все пространство между этим токоотводом и сепаратором плотно забивается анодной пастой, состоящей из цинкового порошка, пропитанного загущенным электролитом. Часто уже при изготовлении элементов в качестве электролита применяется щелочь, предварительно насыщенная цинкатами, что позволяет избежать расходования щелочи в начале эксплуатации. Кроме того, присутствие цинкатов в электролите замедляет скорость коррозии цинка.Из-за более плотной активной массы и применения стального корпуса щелочные батарейки при тех же размерах обычно тяжелее солевых на 25-50 %.
Емкость и энергия щелочных батареек.Как и у всех химических источников тока, емкость батареек со щелочным электролитом уменьшается при увеличении тока разряда и снижении температуры, но менее резко, чем у элементов с солевым электролитом. Удельная емкость элементов со щелочным электролитом при разряде малыми токами приблизительно в 1,5 раза превышает удельную емкость элементов с солевым электролитом. При разряде большими токами это различие достигает 4-10-кратного.Емкость источника тока при прерывистом разряде средними и большими нормированными токами выше, чем при непрерывном разряде. Но при прерывистом разряде малыми токами емкость источника тока меньше емкости при непрерывном разряде вследствие саморазряда.
Во всем мире в производстве наблюдается стабильная тенденция по росту доли более энергоемких щелочных марганцево-цинковых элементов.Следует еще раз особо подчеркнуть, что для уменьшения саморазряда элементов в настоящее время используются не ртуть и кадмий, а другие ингибиторы коррозии цинка, которые менее токсичны.
Основные рабочие характеристики химических источников тока
1. Величина напряжения на разомкнутых клеммах.В зависимости от конструкции единичный источник может создавать только определенную разность потенциалов. Для использования в электрических устройствах их объединяют в батареи.
2. Удельная емкость.За определенное время (в часах) один химический источник тока может выработать ограниченное количество тока (в амперах), которые относят к единице веса либо объема.
3. Удельная мощность.Характеризует способность единицы веса или объема химического источника тока вырабатывать мощность, образованную произведением напряжения на силу тока.
4. Продолжительность эксплуатации.Еще этот параметр называют сроком годности.
5. Значение токов саморазряда.Эти побочные процессы электрохимических реакций приводят к расходу активной массы элементов, вызывают коррозию, снижают удельную емкость.
6. Цена на изделие.Зависит от конструкции, применяемых материалов и ряда других факторов.
Лучшими химическими источниками тока считаются те, у которых высокие значения первых четырех параметров, а саморазряд и стоимость низкие.
Аккумуляторы
Аккумулятор (лат. accumulator — собиратель, от accumulo — собираю, накопляю), устройство для накопления энергии с целью её последующего использования. В зависимости от вида накапливаемой энергии различают аккумуляторы: электрические, гидравлические, тепловые, инерционные.
Электрический аккумулятор служит для накопления электрической энергии путём превращения её в химическую с обратным преобразованием по мере надобности; химический источник электрического тока многоразового пользования, работоспособность которого может быть восстановлена путём заряда, т. е. пропусканием тока в направлении, обратном направлению тока при разряде. Первые опыты по созданию электричества аккумулятора были проведены в начале 19 в. В. В. Петровым и И. Риттером. Особенно большой вклад в изучение свойств, разработку и совершенствование конструкций аккумулятора внесли русские учёные Э. Х. Ленц, Д. А. Лачинов, Е. П. Тверитинов, Н. Н. Бенардос, П. Н. Яблочков, М. П. Авенариус, английский физик У. Гров, француз Г. Планте и многие др. (в мировой практике только по свинцовому аккумулятору к 1937 зарегистрировано 20 000 патентов). В 1900 Т. А. Эдисон изобрёл аккумулятор щелочного типа, получивший широкое распространение. Электрический аккумулятор состоит из двух электродов, погруженных в раствор электролита; разность потенциалов электродов -ЭДС аккумулятора. Преобразование химической энергии в электрическую происходит при наличии замкнутой электрической цепи на основе химической (токообразующей) реакции.
Аккумулятор характеризуется сроком службы, т. е. числом возможных циклов заряд-разряд, допустимым без значительного падения характеристик; электрическим зарядом (распространён термин «ёмкость»), т. е. количеством электричества в кулонах или ампер-часах, которое он может отдать при разряде; средним напряжением, во время заряда и разряда; удельной энергией, КПД.
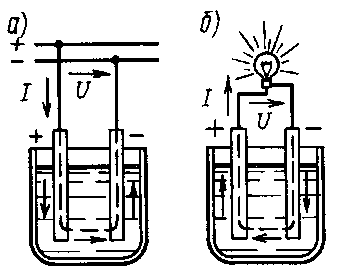
Принцип действия.Аккумуляторомназывается химический источник тока, который способен накапливать (аккумулировать) в себе электрическую энергию и по мере необходимости отдавать ее во внешнюю цепь. Накапливание в аккумуляторе электрической энергии происходит при пропускании по нему тока от постороннего источника (рис. 7.6, а). Этот процесс, называемыйзарядом аккумулятора, сопровождается превращением электрической энергии в химическую, в результате чего аккумулятор сам становится источником тока. При разряде аккумулятора (рис. 7.6, б) происходит обратное превращение химической энергии в электрическую. Аккумулятор обладает большим преимуществом по сравнению с гальваническим элементом. Если элемент разрядился, то он приходит в полную негодность; аккумулятор жепосле разряда может быть вновь заряжен и будет служить источником электрической энергии. В зависимости от рода электролита аккумуляторы разделяют на кислотные и щелочные.
Рис. 7.6. Заряд (а) и разряд (б) аккумулятора
Устройство свинцового аккумулятора
В кислотном аккумуляторе электродами являются свинцовые пластины, покрытые так называемыми активными массами, которые взаимодействуют с электролитом при электрохимических реакциях в процессе заряда и разряда. Активной массой положительного электрода (анода) служит перекись свинца PbO2, а активной массой отрицательного электрода (катода) — чистый (губчатый) свинец Pb. Электролитом является 25-34 %-ный водный раствор серной кислоты.
Исходным материалом для изготовления пасты для положительных пластин служит порошок свинца Pb, а для отрицательных- порошок перекиси свинца PbO2, которые замешиваются на водном растворе серной кислоты. Строение активных масс в таких пластинах пористое; благодаря этому в электрохимических реакциях участвуют не только поверхностные, но и глубоколежащие слои электродов аккумулятора.
Для повышения пористости и уменьшения усадки активной массы в пасту добавляют графит, сажу, кремний, стеклянный порошок, сернокислый барий и другие инертные материалы, называемыерасширителями. Они не принимают участия в электрохимических реакциях, но затрудняют слипание (спекание) частиц свинца и его окислов и предотвращают этим уменьшение пористости.
Рис. 7.7. Устройство пластин (а) и общий вид (б)
1 — блок отрицательных пластин; 2 — выводные штыри; 3 — блок панцирных положительных пластин; 4 — панцирь; 5 — активная масса; 6 — отверстие с пробкой для заливки электролита; 7 — крышка; 8 — эбонитовый сосуд; 9 — пространство для осаждения шлама
При изготовлении аккумуляторов пластины подвергают специальным зарядно-разрядным циклам. Этот процесс носит названиеформовки аккумулятора. В результате формовки паста положительных пластин электрохимическим путем превращается в перекись (двуокись) свинца PbO2и приобретает коричневый цвет. Паста отрицательных пластин при формовке переходит в чистый свинец Pb, имеющий пористую структуру; отрицательные пластины приобретают серый цвет.
Для предотвращения замыкания пластин посторонними предметами (щупом для измерения уровня электролита, устройством для заливки электролита и др.) пластины в некоторых аккумуляторах покрывают полихлорвиниловой сеткой.
Для увеличения емкости в каждый аккумулятор устанавливают несколько положительных и отрицательных пластин; одноименные пластины соединяют параллельно в общие блоки, к которым приваривают выводные штыри. Блоки положительных и отрицательных пластин обычно устанавливают в эбонитовом аккумуляторном сосуде (рис. 7.7,б) так, чтобы между каждыми двумяпластинами одной полярности располагались пластины другой полярности. По краям аккумулятора ставят отрицательные пластины, так как положительные пластины при установке по краям склонны к короблению. Пластины отделяют одну от другой сепараторами, выполненными из микропористого эбонита, полихлорвинила, стекловойлока или другого изоляционного материала. Сепараторы предотвращают возможность короткого замыкания между пластинами при их короблении.
Пластины устанавливают в аккумуляторном сосуде так, чтобы между их нижней частью и дном сосуда имелось некоторое свободное пространство. В этом пространстве скапливается свинцовый осадок (шлам), образующийся вследствие отпадания отработавшей активной массы пластин в процессе эксплуатации.
Разряд и заряд.При разряде аккумулятора положительные ионы H + и отрицательные ионы кислотного остаткаSО4 2 — , на которые распадаются молекулы серной кислоты H2SО4, направляются соответственно к положительномуи отрицательному электродам и вступают в электрохимические реакции с их активными массами. Между электродами возникаетразность потенциалов около 2 В, обеспечивающая прохождение электрического тока при замыкании внешней цепи. В результатеэлектрохимических реакций, возникающих при взаимодействии ионов водорода с перекисью свинца PbO2положительногоэлектрода и ионов сернокислого остатка SО4 2 — со свинцом Pb отрицательного электрода, образуется сернокислый свинец PbSО4(сульфат свинца), в который превращаются поверхностные слои активной массы обоих электродов. Одновременно при этих реакциях образуется некоторое количество воды, поэтому концентрация серной кислоты понижается, т. е. плотность электролита уменьшается.
Аккумулятор может разряжаться теоретически до полного превращения активных масс электродов в сернокислый свинец и истощения электролита. Однако практически разряд прекращают гораздо раньше. Образующийся при разряде сернокислый свинец представляет собой соль белого цвета, плохо растворяющуюся в электролите и обладающую низкой электропроводностью. Поэтому разряд ведут не до конца, а только до того момента, когда в сернокислый свинец перейдет около 35 % активной массы. В этом случае образовавшийся сернокислый свинец равномерно распределяется в виде мельчайших кристалликов в оставшейся активной массе, которая сохраняет еще достаточную электропроводность, чтобы обеспечить напряжение между электродами 1,7-1,8 В.
Разряженный аккумулятор подвергают заряду, т. е. присоединяют к источнику тока с напряжением, большим напряжения аккумулятора. При заряде положительные ионы водорода перемещаются к отрицательному электроду, а отрицательные ионы сернокислого остатка SО4 2 — — положительному электроду и вступают в химическое взаимодействие с сульфатом свинца PbSО4, покрывающим оба электрода. В процессе возникающих электрохимических реакций сульфат свинца PbSО4растворяется и на электродах вновь образуются активные массы: перекись свинца PbO2на положительном электроде и губчатый свинец Pb — на отрицательном. Концентрация серной кислоты при этом возрастает, т. е. плотность электролита увеличивается.
Электрохимические реакции при разряде и заряде аккумулятора могут быть выражены уравнением
PbO2+ Pb + 2H2SO4 
Читая это уравнение слева направо, получаем процесс разряда, справа налево — процесс заряда.
Полностью заряженный аккумулятор имеет э. д. с. около 2,2 В. Таково же приблизительно и напряжение на его зажимах, так как внутреннее сопротивление аккумулятора весьма мало. При разряде напряжение аккумулятора довольно быстро падает до 2 В, а затем медленно понижается до 1,8-1,7 В, при этом напряжении разряд прекращают во избежание повреждения аккумулятора.
При заряде напряжение аккумулятора быстро поднимается до 2,2 В, а затем медленно повышается до 2,3 В и, наконец, снова довольно быстро возрастает до 2,6-2,7 В. При 2,4 В начинают выделяться пузырьки газа, образующегося в результате разложения воды на водород и кислород. При 2,5 В оба электрода выделяют сильную струю газа, а при 2,6-2,7 В аккумулятор начинает как бы кипеть, что служит признаком окончания заряда.
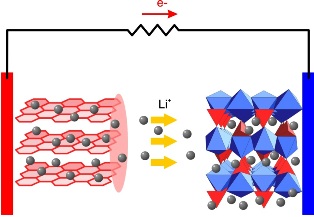
Сегодня одним из наиболее перспективных типов аккумуляторов являетсялитий-ионный аккумулятор. В этих аккумуляторах в качестве отрицательного электрода выступает алюминий, а в качестве положительного электрода – медь. Электроды могут иметь различную форму, как правило, это фольга в форме цилиндра или продолговатого пакета.
На алюминиевую фольгу наносяткатодный материал, которым чаще всего может быть один из трех: кобальтат лития LiCoO2, литий-феррофосфат LiFePO4, или литий-марганцевая шпинель LiMn2O4, а на медную фольгу наносят графит. Литий-феррофосфат LiFePO4 является единственным, на данный момент, безопасным катодным материалом с точки зрения опасности взрыва и экологичности в целом.
Полимерные электролиты, способные внедрять в свой состав соли лития, в силу своей пластичности делают возможным изготовление литий-ионных аккумуляторов с большой внутренней поверхностью и почти любой формы, а это значительно повышает как технологичность производства, так и массогабаритные характеристики.
В процессе заряда такого аккумулятора, ионы лития перемещаются через электролит, и внедряются в кристаллическую решетку графита на аноде, образуясоединение графитит лития LiC6. При разряде происходит обратный процесс – от анода ионы лития движутся к катоду (окислителю), а во внешней цепи к катоду движутся электроны, в результате процесс приобретает электрическую нейтральность.
Рис. 7.8. Схема работы литий-ионного аккумулятора
Номинальное напряжение литий-ионного аккумулятора составляет 3,6 вольта, однако разность потенциалов при зарядке может достигать 4,23 вольта. В связи с этим фактом, заряд производится при максимально допустимом напряжении не более 4,2 вольта.
Некоторые соединения лития могут легко возгораться, если напряжение превышено, поэтому в литий-ионные аккумуляторы, традиционно, встраиваютсяконтроллеры уровня заряда, не допускающие превышения критического напряжения. Еще одним способом обеспечения безопасности является встроенный клапан для сбрасывания избыточного давления внутри пакета.
Литий-ионные аккумуляторы уже заняли свое достойное место на рынке портативной бытовой техники. Это элементы питания сотовых телефонов, фотоаппаратов, видеокамер, планшетов, плееров, и т.д.
Литий-феррофосфат LiFePO4считается самым перспективным катодным материалом в силу своей экологичности. Кобальтат лития LiCoO2, в свою очередь, ядовит и экологически вреден, а у аккумуляторов на его основе лишь 50% ионов можно извлечь из структуры соединения, ведь если из него извлечь литий полностью, то структура станет нестабильной, кобальт перейдет в степень окисления +4 и сможет окислить кислород, а выделяющийся атомарный кислород станет окислять электролит, и произойдет взрыв. Аккумуляторы с повышенной емкостью (на основе LiCoO2) крайне взрывоопасны.
Литий-феррофосфат LiFePO4 был предложен в качестве катодного материала аккумуляторов для более мощных устройств в 1997 году Джоном Гуденафом.
Литий-феррофосфат есть в земной коре, и не создаст никаких экологических проблем в будущем. Из него не может выделяться кислород, так как он весь очень прочно связан фосфором с образованием устойчивого фосфат-иона. Однако, для возможности применения этого материала, его нужно было раздробить на мелкие частички, иначе он остался бы изолятором в силу очень малой проводимости. Частички сделали пластинчатыми с малыми размерами вдоль направления движения ионов лития, затем покрыли нанометровым слоем углерода.
Такие наночастицы LiFePO4 способны заряжаться за 10 минут, а если еще модифицировать покрытие, то время заряда сократится до 1-3 минут. В перспективе, именно этот материал сможет обеспечить питание электромобилей в течение 10 лет. Уже сейчас технологически возможен цикл зарядки-разрядки за 5-10 минут при полной безопасности.
- Химические источники тока. Марганцево-цинковый первичный элемент: устройство, уравнение процессов, достоинства и недостатки.
- Марганцево-цинковые элементы
- Марганцево-цинковые элементы Текст научной статьи по специальности « Нанотехнологии»
- Аннотация научной статьи по нанотехнологиям, автор научной работы — Александров Виктор Иванович, Кошель Александр Антонович, Юдин Виктор Семенович
- Похожие темы научных работ по нанотехнологиям , автор научной работы — Александров Виктор Иванович, Кошель Александр Антонович, Юдин Виктор Семенович
- MANGANESE-ZINC ELEMENTS
- Текст научной работы на тему «Марганцево-цинковые элементы»
- 📹 Видео
Видео:Гальванический элементСкачать

Химические источники тока. Марганцево-цинковый первичный элемент: устройство, уравнение процессов, достоинства и недостатки.
Читайте также:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Обозначения | Номинальные размеры | |||
| МЭК | СССР | США | Диаметр, мм | Высота, мм |
| R08 | — | O | 10.5 | 3 |
| R06 | 283 | — | 10.5 | 22 |
| R03 | 286 | AAA | 10.5 | 44.5 |
| R4 | 314 | R | 14.5 | 38 |
| R6 | 316 | AA | 14.5 | 50.5 |
| R8 | 326 | A | 16 | 50.5 |
| R10 | 332 | BR | 21.5 | 37 |
| R12 | 336 | B | 21.5 | 60 |
| R14 | 343 | C | 26.2 | 50 |
| R20 | 373 | D | 34.2 | 61.3 |
| R22 | 374 | E | 34.2 | 75 |
| R25 | 376 | F | 34.2 | 91 |
| R26 | — | G | 34 | 105 |
| R27 | — | J | 34 | 150 |
| — | 425 | — | 40 | 100 |
| — | 465 | — | 51 | 125 |
Таблица 1. Унифицированные размеры цилиндрических сухих элементов.
Конструкция галетного элемента показана на рис.3. Отрицательный электрод представляет собой цинковуюпластину 1,на одну из сторон которой нанесен электропроводный слой 2. Этот слой состоит из графита и высокомолекулярных связующих материалов, образующих плотную пленку, непроницаемую для электролита. Электропроводный слой, по сути дела, является перегородкой двух соседних элементов. К цинковому электроду прижата диафрагма с электролитной пастой 3 (аналогичная диафрагме набивных элементов). Наконец, к диафрагме прижат плоский агломерат 4, имеющий выступ, которым он при сборке батареи прижимается к электропроводному слою соседнего элемента. Агломерат обернут тонкой бумагой 5, предотвращающей выкрашивание кусочков активной массы и образование межэлементных замыканий. Все детали галетного элемента стянуты в единое целое с помощью кольца из поливинилхлорида 6, которое обеспечивает внутренний контакт отдельных деталей и предохраняет от выползания электролита.

6) Модификации и разновидности двуокиси марганца
Двуокись марганца образует большое количество кристаллографических модификаций, обозначаемых буквами греческого алфавита. В природе встречаются α-МnО2 — криптомелан, β-МnО2 — пиролюзит и γ-МnО2 — рамсделит. Некоторые модификации содержат посторонние катионы, например К + , Ва 2+ (α- и γ-МnО2 ) или 4—6% структурной воды (α-, γ-, δ- и т]-МпО2 ). Стехиометрический состав выражается формулой МnОn где п колеблется от 1,9 до 2.
В элементах используются четыре разновидности двуокиси марганца. Природная руда. Наибольшее значение имеют месторождения пиролюзита. Обогащенная пиролюзитная руда содержит 85— 90 % β-МnО2 и является наиболее дешевым, но относительно малоактивным электродным материалом. Она почти не подвержена самопроизвольному разложению и обеспечивает хорошую сохраняемость элементов.
Активированный пиролюзит (ГАП) получают прокаливанием пиролюзита, в ходе которого на поверхности зерен МnО2 частично разлагается с образованием Мn3 О4 . При последующей обработке серной кислотой растворяются низшие окислы марганца и примеси и образуется высокопористая γ-МnО2 . ГАП имеет более положительный (примерно на 0,15—0,2 В) начальный потенциал и более высокий коэффициент использования, чем исходный пиролюзит.
Электролитическую двуокись марганца (ЭДМ) получают анодным осаждением из растворов сульфата марганца на графитовых анодах. Она состоит из γ-МпО2 и отличается высокой степенью чистоты и высокой активностью. Из-за этого, а также из-за возможности использования в качестве исходного сырьябедных марганцевых руд ЭДМ находит все более широкое применение в элементной промышленности.
Искусственную двуокись марганца (ИДМ) получают химическим путем. В зависимости от способа приготовления образуются продукты с разными свойствами. Большое значение имеет сильно гидратированная ИДМ, получаемая термическим разложением перманганатов. Она представляет собой η-МnО2 и имеет довольно стабильный разрядный потенциал.
Удельная проводимость порошков МnО2 , измеренная при давлении 100 МПа, колеблется для разных сортов от 0,1 до 5 См/м. Для повышения удельной электрической проводимости в активную массу добавляют природные чешуйчатые сорта графита («элементный графит») и (или) ацетиленовую сажу. Сажа играет также очень важную роль, повышая влагоемкость активной массы и удерживая запас электролита вблизи всех частиц электрода. Использование других сортов сажи или искусственного графита не дает нужных результатов. Содержание углеродистых добавок колеблется от 8 до 20 %. В элементы, предназначенные для разряда большими токами, вводят до 20 % графита. В элементы, рассчитанные на малые токи и на длительное хранение, вводят минимальное количество добавок.
в) Отрицательный электрод
В марганцево-цинковых элементах используется цинк с чистотой не менее 99,94 %, обладающий относительно высокой коррозионной стойкостью. Допускаются примеси, на которых скорость выделения водорода низка, например кадмия или свинца. Иногда используются специальные присадки свинца, которые улучшают структуру цинка и облегчают вытяжку стаканчиков.
Основными компонентами электролита являются хлориды аммония (нашатырь) и цинка, а также загустители — мука или крахмал. Оба хлорида участвуют во вторичных реакциях и тем самым во многом определяют характер процесса разряда элементов. Повышение содержания NН4 С1 в электролите увеличивает удельную электрическую проводимость, но одновременно снижается рН раствора, что ускоряет коррозию цинка. Поэтому сохраняемость элементов с повышенным содержанием NН4 С1 ниже. ZnС12 сильно влияет на тиксотропные свойства электролитов, загущенных мукой или крахмалом — в присутствии ZnСl2 электролит загустевает гораздо быстрее. Кроме того, растворы ZnС12 обладают антигнилостными и частично буферными свойствами. В присутствии ZnС12 уменьшается тенденция растворов к «выползанию» и к образованию солевых налетов.
В электролит элементов, предназначенных для работы при низких температурах, часто добавляют хлорид кальция, который снижает температуру замерзания раствора. В некоторых случаях для этой же цели вводится хлорид лития.
Так как отдельные компоненты электролита по-разному влияют на положительный и отрицательный электроды, то для пропитки агломератов и диафрагм обычно применяют разные рецептуры. В частности, в электролиты для пастовых диафрагм, соприкасающихся с цинковым электродом, с целью снижения саморазряда вводят от 5 до 15 г/л хлорида ртути (II) (сулемы). Ртуть контактно осаждается на поверхности цинка и амальгамирует ее. С той же целью в электролит иногда добавляют небольшие количества бихромата калия, служащего ингибитором коррозии цинка. В некоторые электролиты добавляют дубители— хромовые квасцы или сульфат хрома, предотвращающие разжижение загущенного электролита при повышенной температуре.
д) Марганцево-цинковые элементы со стабильным напряжением
В 1960-х годах были получены модификации ИДМ, позволившие создать положительный электрод со стабильным напряжением разряда. Эти модификации (η-МпО2 ) имеют в своей структуре достаточно большое количество конституционной воды, т. е. часть атомов кислорода в решетке замещена гидроксильными группами. Эти формы двуокиси марганца имеют хорошие ионообменные свойства: часть протонов в кристаллической решетке может замещаться на ионы цинка. Вероятно, разряд положительного электрода с гидратированной двуокисью марганца первично протекает по уравнению (3). В самом начале разряда происходит незначительное увеличение рН и напряжение несколько снижается. Вскоре начинается вторичная реакция, связанная с внедрением ионов цинка в двуокись марганца и образованием новой фазы — гетеролита:
В результате этой реакции подщелачивание раствора приостанавливается. Образующийся гетеролит не изоморфен с двуокисью марганца и не образует с ней фазы переменного состава. По этой причине потенциал положительного электрода не зависит от степени разряженности. Суммарная реакция в элементе, включающая две стадии (3) и (7), описывается простым уравнением

е) Марганцево-воздушно-цинковые элементы
Образующаяся при разряде двуокиси марганца гидроокись трехвалентного марганца МnООН может в принципе вновь частично окисляться кислородом воздуха до смешанной фазы, богатой МnО2 . Поэтому свободный доступ воздуха к активной массе положительного электрода увеличивает емкость элемента. Кроме того, применяемые в агломератах углеродные материалы — сажа и графит — способны адсорбировать кислород и в какой-то мере работать как кислородные электроды. Поэтому довольно широкое распространение получили смешанные марганцево-воздушно-цинковые элементы, в которых катодный процесс сводится одновременно к восстановлению двуокиси марганца и кислорода воздуха. В таких элементах в состав агломератов вводят повышенное содержание углеродных добавок, а сажу часто заменяют активированным углем, имеющим очень развитую поверхность и хорошо адсорбирующим кислород. Примером такой рецептуры может быть следующая: 35—40 % двуокиси марганца, 45 % графита, 15—20 % активированного угля.
В конструкции марганцево-воздушно-цинковых элементов предусматриваются специальные каналы для лучшей подачи воздуха ко всему агломерату. До начала разряда эти каналы остаются заклеенными бумагой, которую следует разрывать при включении элементов на разряд. При разряде малыми токами такие элементы работают преимущественно как воздушные; при средних и больших токах в основном восстанавливается двуокись марганца.
В варианте марганцево-воздушно-цинковых элементов выпускаются отдельные виды элементов и батарей для фонарей и радиоаппаратуры. В определенных режимах разряда они имеют удельную емкость, примерно вдвое превышающую удельную емкость обычных марганцево-цинковых элементов.
4. Характеристики марганцево-цинковых элементов
Разрядные характеристики марганцево-цинковых элементов зависят от состава активной массы положительного электрода и состава электролита. Типичные разрядные кривые стаканчикового элемента 373 (торговое название «Марс» или «Сатурн») при непрерывном разряде приведены на рис.5. Начальное напряжение при малых токах разряда составляет 1,6—1,65, а при больших 1,2—1,3 В. В зависимости от особенностей питаемой аппаратуры и от значения тока разряд ведется до конечного напряжения 0,7—1,0 В.


Разрядные кривые элемента 373 при низких температурах представлены на рис.7. Как видно, даже при небольшом токе (jр = 0,002) емкость заметно уменьшается уже при температуре О °С; при температуре —40 °С она составляет только 20 % емкости при комнатной температуре. При больших токах пределом работоспособности считается температура —20 °С. При температурах ниже —20 °С обычно применяемые электролиты замерзают, поэтому в них вводят добавки, снижающие температуру замерзания. Так как эти добавки сказываются на показателях при повышенных температурах, иногда используют разные рецептуры для элементов, работающих в разных температурных интервалах: хладостойких (от —40 до 40°С) и летних (от —20 до 60 °С).

Номинальные характеристики марганцево-цинковых элементов относятся к свежеизготовленным элементам, т. е. к элементам, хранившимся с момента изготовления не больше месяца. Сохраняемость марганцево-цинковых элементов и батарей колеблется в зависимости от размера, конструктивного варианта и рецептур активной массы и электролита от 3 мес до 3 лет. Во время хранения протекают процессы старения и саморазряда, вследствие которых емкость и напряжение разряда снижаются, а внутреннее сопротивление увеличивается. К концу гарантированного срока хранения снижение емкости составляет 30—40 %. Большое значение для сохраняемости имеет тщательность герметизации, которая уменьшает испарение воды и поступление кислорода воздуха к цинковому электроду. Очень надежными в этом отношении являются цилиндрические элементы в стальном корпусе.
Процессы саморазряда и старения сильно зависят от температуры. Два-три месяца хранения в тропических условиях (например, при 45 °С) считаются эквивалентными одному году хранения в нормальных температурных условиях (20—25 °С). При низких температурах (например, при -20°С) элементы и батареи могут длительно храниться без существенного снижения показателей.
Видео:Элемент ЛекланшеСкачать

Марганцево-цинковые элементы Текст научной статьи по специальности « Нанотехнологии»
Видео:Медно цинковый аккумулятор и концентрационный.Скачать

Аннотация научной статьи по нанотехнологиям, автор научной работы — Александров Виктор Иванович, Кошель Александр Антонович, Юдин Виктор Семенович
В данной статье рассмотрены характерные особенности марганцево-цинковых элементов , их достоинства и недостатки, конструктивные особенности. Особое внимание в статье уделяется рассмотрению вариантов конструкций марганцево-цинковых элементов и их преимуществам.
Видео:Ртутно-цинковые элементы питания РЦ53.Скачать

Похожие темы научных работ по нанотехнологиям , автор научной работы — Александров Виктор Иванович, Кошель Александр Антонович, Юдин Виктор Семенович
Видео:Гадолиний. Необычный лантаноид про который лучше не знать.Скачать

MANGANESE-ZINC ELEMENTS
This article discusses characteristics of manganese-zinc cells, their advantages and disadvantages, design features. Special attention is paid to the consideration of options for construction of manganese-zinc cells and their advantages.
Видео:Свинцово цинковый элемент с воздушной деполяризацией.ПОДВОДНЫЕ КАМНИ.Часть №-2.Скачать

Текст научной работы на тему «Марганцево-цинковые элементы»
Александров Виктор Иванович
канд. воен. наук, доц. кафедры электроснабжения и радиотелемеханики, доцент Тюменского высшего военно-инженерного командного училища
Кошель Александр Антонович
доц. кафедры электроснабжения и радиотелемеханики доцент Тюменского высшего военно-инженерного командного училища
Юдин Виктор Семенович
преподаватель кафедры электроснабжения и радиотелемеханики Тюменского высшего военно-инженерного командного училища
the candidate of the military Sciences, associate Professor in the Department of electrical and radiotéléphonie,
associate Professor of Tyumen higher military engineering command school
associate Professor in the Department of electrical and radiotelephonic associate Professor of Tyumen higher military engineering command school
lecturer of the Department of electrical and radiotelephonic Tyumen higher military engineering command school
В данной статье рассмотрены характерные особенности марганцево-цинковых элементов, их достоинства и недостатки, конструктивные особенности. Особое внимание в статье уделяется рассмотрению вариантов конструкций марганцево-цинковых элементов и их преимуществам.
This article discusses characteristics of manganese-zinc cells, their advantages and disadvantages, design features. Special attention is paid to the consideration of options for construction of manganese-zinc cells and their advantages.
Ключевые слова: Марганцево-цинковые элементы, электрохимическая система, состав и устройство, активное вещество.
Keywords: Manganese-zinc elements, electrochemical system, the composition and active substance.
В жизни современного общества все больше и больше требуется электрическая энергия. В связи с этим стали широко распространятся химические источники тока. В их ряду особое место занимают марганцево-цинковые элементы.
Марганцево-цинковые (МЦ) элементы в зависимости от состава электролита делят на солевые и щелочные.
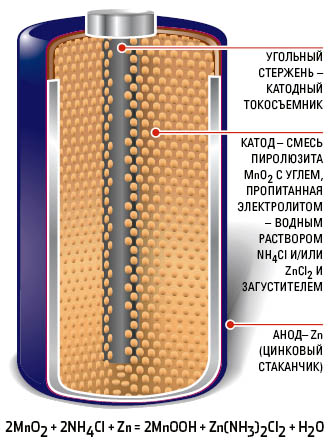
В солевых МЦ элементах использована электрохимическая система
Активным веществом отрицательного электрода является цинк ^п), активным веществом положительного электрода является двуокись марганца (MnO2), к которой для лучшей электропроводности и повышения коэффициента использования добавляют графит и ацетиловую сажу. Электролитом служит раствор хлористого аммония (N^0) с различными добавками. Элементы такой конструкции называются угольно-цинковыми.
Разновидностью угольно-цинкового солевого МЦ элемента являются хлористо-цинковые элемен-
ты Лекланше, названные в честь их изобретателя Ж. Лекланше.
Главное различие между угольно-цинковыми и хлористо-цинковыми элементами заключается в электролите. В хлористо-цинковом элементе в качестве электролита применяют только раствор хлористого цинка, а в угольно-цинковом элементе электролит вместе с хлористым цинком содержит насыщенный раствор хлористого аммония. Отказ от применения хлористого аммония улучшает электрохимические свойства элемента, но при этом повышаются требования к системе его уплотнения. Поэтому для элементов Лекланше применяют новый тип уплотнения, который ранее не использовался в угольно-цинковых элементах.
Достоинства солевых МЦ элементов:
• простота и дешевизна в производстве и эксплуатации, что обусловило их широкое применение;
• надежность в эксплуатации.
Недостатки солевых МЦ элементов:
• низкие энергетические показатели;
• эксплуатация при температурах до -5 0С;
• плохо работают при больших токах разряда и низких температурах;
• имеют заметный саморазряд и невысокую герметичность.
В щелочных МЦ элементах реализована система
Электрохимическая система аналогична системе солевых МЦ элементов, в которой в качестве электролита используется щелочь в виде раствора водного гидроокиси калия. МЦ элементы со щелочным электролитом называют алкалическими элементами.
Достоинства алкалических элементов:
• допускают до 10 — 50 перезарядок с отдачей энергии (после перезарядки) в 3-4 раза меньшей, чем у свежеизготовленных элементов;
• эксплуатируются при температурах от -25 до +55 0С;
• хорошо работают при больших токах разряда;
• обладают лучшей герметичностью и меньшим саморазрядом, чем МЦ элементы с солевым электролитом.
Недостатки алкалических элементов:
• дороже в производстве и эксплуатации.
Устройство марганцево-цинковых элементов.
Различают цилиндрические, прямоугольные и
плоские элементы, каждая разновидность имеет свои характерные особенности конструкции. Существуют типоразмерные ряды, которые утверждены Международной электротехнической комиссией (МЭК) с целью унифицировать габаритные размеры и токовыводы элементов многоцелевого назначения, выпускаемых в разных странах; существует международная индексация этих элементов.
Устройство цилиндрического солевого МЦ элемента.
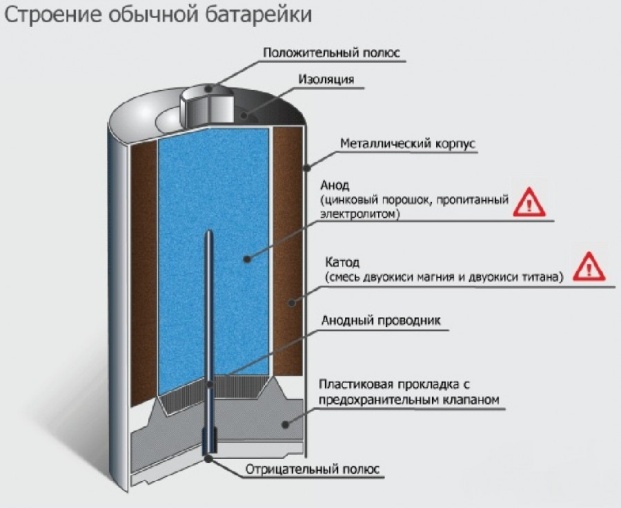
Основными составными частями элемента являются отрицательный и положительный электроды, сепаратор и узел герметизации (рис. 1).
Рисунок 1. Солевой элемент: 1-колпачок;
2, 4, 5-шайбы; 3-битумная мастика;
6-отрицательный электрод; 7 — активная масса
положительного электрода; 8-токоотвод;
Отрицательный электрод 6 изготовлен из чистого цинка или цинка, легированного свинцом (
0,05%), и имеет форму стакана. Электрод одновременно выполняет функцию корпуса и должен обладать определенной механической прочностью, поэтому масса цинка значительно превышает требуемую для токообразующей реакции.
Положительный электрод состоит из активной массы 7 и токоотвода в виде угольного стержня 8. Электрод имеет форму цилиндра и расположен по отношению к цинковому электроду соосно. В состав активной массы, которую часто называют агломе-ратной (или агломератом), входят: природный диоксид марганца — пиролюзит, искусственный диоксид марганца, электропроводящие добавки (графит и ацетиловая сажа).
Сепаратором 9 служит щелочестойкая бумага -матрица, на которую предварительно наносят слой загущенного электролита; такой сепаратор называют пастовой диафрагмой. Загущение электролита производят с помощью картофельного или кукурузного крахмала и пшеничной муки. Картонная прокладка 10 препятствует короткому замыканию между электродами. Металлический колпачок 1 служит внешним контактом положительного электрода. С помощью шайб 4 и 5 фиксируется газовое пространство для водорода, выделяющегося при саморазряде элемента. Слой битумной композиции 3, прикрытый сверху декоративной шайбой 2, предназначен для герметизации элемента. Цилиндрические элементы могут иметь картонную защитно-декоративную гильзу-футляр (на рисунке не показана), которая защищает боковую поверхность элемента и снабжена товарной этикеткой.
Еще раз оценим преимущества рассмотренного варианта конструкции:
• компактность и простота.
• низкие потери напряжения и сравнительно равномерное растворение цинкового стакана.
• высокая технологичность элемента и низкая его стоимость.
Применение тонкостенного цинкового электрода долгое время относили к достоинствам конструкции, т. к. это позволяло обходиться без специального корпуса, следовательно, удешевляло и сокращало технологию. Однако питтинговая коррозия (растворение цинкового стакана и появление в нем сквозных отверстий) сокращает срок службы элемента; коэффициент использования цинка, и без того малый, снижается еще больше. Кроме того, вытекающий при этом электролит имеет значительную коррозионную активность и, воздействуя на контактные части блоков питания радиоприемной и передающей аппаратуры, выводит их из строя.
Устройство цилиндрического солевого МЦ элемента.
С целью устранения этих недостатков был разработан модернизированный вариант конструкции. Принципиальное отличие этого элемента от простого солевого МЦ элемента заключается в том (рис. 2), что элемент 3 заключен в корпус из жести 4, отделенный от цинкового стакана картонной гильзой 5, выполняющей функции электрического изолятора.
Рисунок 2. Модернизированный солевой МЦ элемент: 1-крышка; 2-токоотвод; 3-элемент;
4-корпус; 5-гильза; 6 -дно
Знак «минус» элемента выведен на дно 6, знак «плюс» — на крышку 1, плотно прижатую к угольному токоотводу 2. В случае сквозного растворения стенки электролит впитывается картонной стенкой 6 и не вытекает наружу, срок службы и коэффициент использования цинка при этом ощутимо повышаются. МЦ элементы в подобном конструкционном варианте занимают преимущественное положение среди цилиндрических солевых элементов, выпускаемых в США, Японии, ФРГ и др. странах. В России такая конструкция принята для элементов 343 и 373 типоразмеров.
Для элемента 316 используется компромиссный вариант, его корпус-анод заключен в полихлорвиниловую термоусадочную трубу, которая надежно защищает боковую поверхность цинкового стакана, оставляя открытыми токоотводы — дно («минус») и колпачок («плюс»).
1. Химические источники тока: Учебное пособие для вузов инженерных войск / Бондаренко Н.И., Сугаков В.Г.; — Кстово: НВВИКУ, 2005. — 200 с.
📹 Видео
d-Элементы. Элементы VIВ и VIIВ групп. Хром. Марганец.Скачать

Выщелачивание цинкового огаркаСкачать

Естественная карбонизацияСкачать

Что такое монофланец? | Функция, исполнения и области примененияСкачать

Получение сульфата цинка (Цинк из батареек)Скачать

Лекция 77. Генератор гармонических колебани на основе цепочки ВинаСкачать

🔥 КАМНИ ВМЕСТО БАТАРЕЕК ⚡ Электричество из кристаллов мрамора!Скачать

Получение сульфата марганца из диоксида (из батареек)Скачать

Магнитомягкие материалы для устройств преобразующих электромагнитную энергиюСкачать

Проект "Cупер восстановитель золота" Часть перваяСкачать

Отбор по пару ниже и выше дефлегматора. ТЕОРИЯ |Изобретатель|Азбука ВинокураСкачать
СОЕДИНЕНИЯ МАРГАНЦА IV и VII | Таисия Фламель | ВебиумСкачать

Ртутная батарейка - mercury battery РтутьСкачать

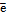


 В начальной стадии по мере такого внедрения водорода кристаллическая решетка МnО2 лишь несколько растягивается, но не меняет своей структуры; в результате образуется гомогенная фаза переменного состава уМnООН(1-y)МnО2 . В ходе разряда значение у непрерывно увеличивается и соответственно изменяется потенциал электрода. Существенным является то, что из-за медленности переноса протонов состав поверхностного слоя зерна МnО2 отличается от состава глубинных слоев—вблизи поверхности степень разряженности, т. е. значение у, больше.
В начальной стадии по мере такого внедрения водорода кристаллическая решетка МnО2 лишь несколько растягивается, но не меняет своей структуры; в результате образуется гомогенная фаза переменного состава уМnООН(1-y)МnО2 . В ходе разряда значение у непрерывно увеличивается и соответственно изменяется потенциал электрода. Существенным является то, что из-за медленности переноса протонов состав поверхностного слоя зерна МnО2 отличается от состава глубинных слоев—вблизи поверхности степень разряженности, т. е. значение у, больше. В старых вариантах элементов (рис. 2, а) агломерат обернут тонкой тканью — миткалем — и обвязан ниткой; такой агломерат называют «куколка». Зазор 8 между куколкой и цинковым стаканом (1—3мм) заполняют жидким электролитом; после кратковременного нагревания этот жидкий раствор под влиянием загустителя превращается в студнеобразную массу. В настоящее время по этой технологии изготавливают крупные элементы, а иногда также элементы, предназначенные для разряда повышенными токами. Вместо обвязки агломерата часто используют его обклейку тканью или бумагой.
В старых вариантах элементов (рис. 2, а) агломерат обернут тонкой тканью — миткалем — и обвязан ниткой; такой агломерат называют «куколка». Зазор 8 между куколкой и цинковым стаканом (1—3мм) заполняют жидким электролитом; после кратковременного нагревания этот жидкий раствор под влиянием загустителя превращается в студнеобразную массу. В настоящее время по этой технологии изготавливают крупные элементы, а иногда также элементы, предназначенные для разряда повышенными токами. Вместо обвязки агломерата часто используют его обклейку тканью или бумагой.