Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Mn + H2O  Mn(OH)2 + H2
Mn(OH)2 + H2
Реакция взаимодействия марганца и воды с образованием гидроксида марганца(II) и водорода. Реакция протекает при температуре около 150°C.
Металлический марганец медленно взаимодействует с водяной парой.
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Марганец, цинк и серебро
Марганец
Содержится в количестве 0,03% по массе в земной коре. Наряду с железом и его сплавами относится к черным металлам.
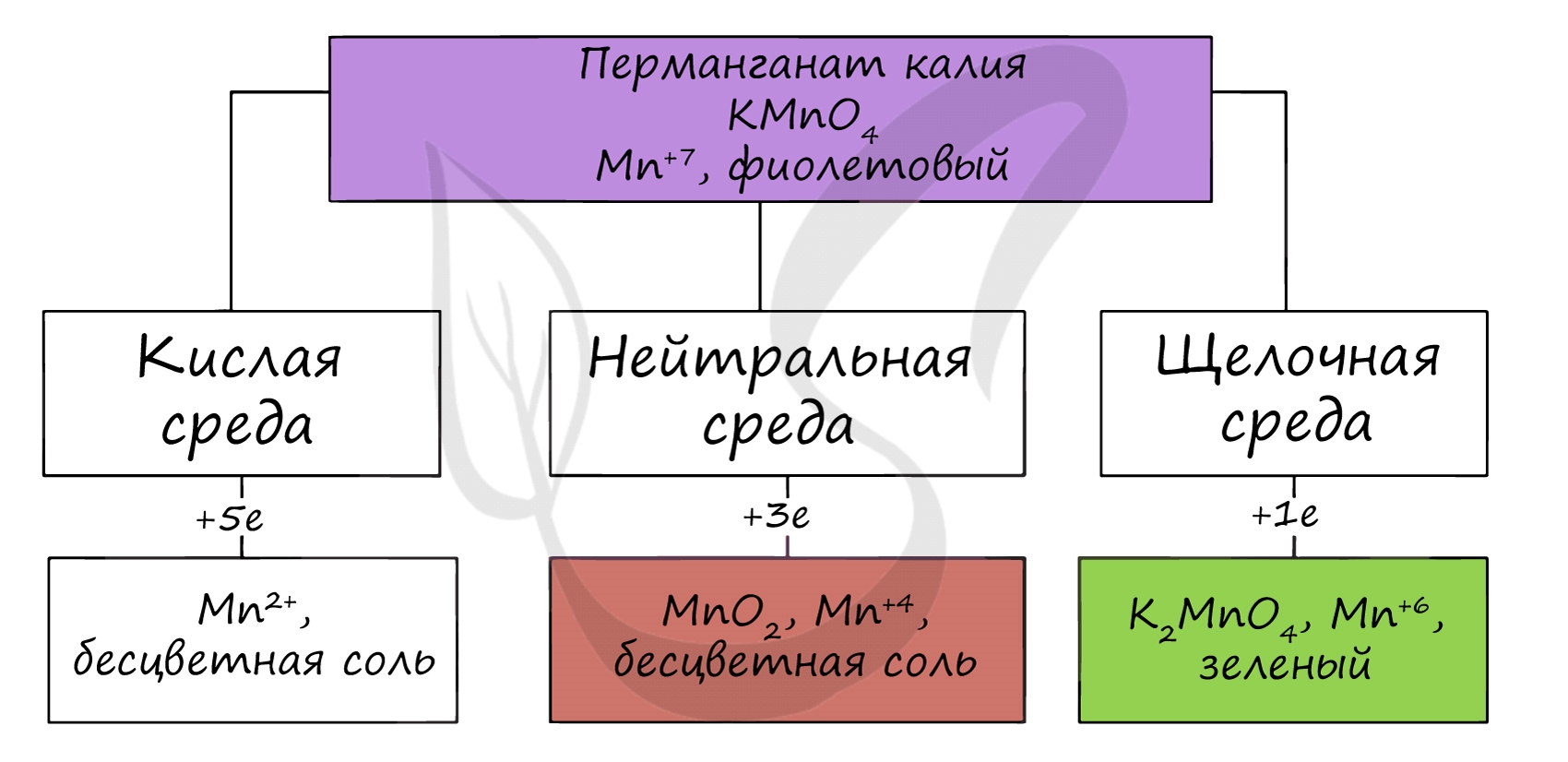
Для соединений марганца характерны степени окисления +2, +3, +4, +6 +7. В соединения +2 и +3 марганец проявляет основные свойства, +4 — амфотерные, +6, +7 — кислотные.
Наиболее известными минералами, в которых содержится марганец, являются:
- MnO2 — пиролюзит
- MnO(OH) — бурая марганцевая руда, манганит
- 3Mn2O3*MnSiO3 — браунит
Получают марганец алюминотермией, восстановлением коксом, электролизом.
MnO2 + C = (t) Mn + CO
- Реакции с неметаллами
На воздухе марганец вступает во взаимодействие с кислородом, пассивируется: на поверхности металла образуется оксидная пленка.
При нагревании марганец реагирует с азотом, углеродом, кремнием, бором и фосфором.
При нагревании марганец вытесняет водород из воды.
Реакции с кислотами
Марганец стоит в ряду напряжений до водорода и способен вытеснить его из кислот.
Под воздействием кислот, которые обладают окислительными свойствами, марганец окисляется.
Соединения марганца (II)
Для соединений марганца (II) характерны основные свойства. Оксид марганца (II) может быть получен разложением карбоната марганца, либо восстановлением оксида марганца (IV) до оксида марганца (II).
При растворении (и нагревании!) марганца в воде образуется гидроксид марганца (II).
Соединения марганца (II) на воздухе неустойчивы, Mn(OH)2 быстро буреет, превращаясь в оксид-гидроксид марганца (IV).
Оксид и гидроксид марганца (II) проявляют основные свойства. При реакции с кислотами дает соответствующие соли.
Соли марганца (II) получаются при его растворении в разбавленных кислотах. Эти соли способны вступать в реакции с другими солями, кислотами, если выпадает осадок, выделяется газ или образуется слабый электролит.
При действии сильных окислителей ион Mn 2+ способен переходить в ион Mn 7+
Соединения марганца (IV) проявляют амфотерный характер. Оксид марганца (IV) можно получить разложением нитрата марганца (II).
В реакциях с щелочами марганец переходит в СО +6, в кислой среде — принимает СО +2.
MnO2 + Na2CO3 + NaNO3 = Na2MnO4 + NaNO2 + CO2 (гидролиз карбоната натрия идет по аниону, среда — щелочная)
Соединения марганца (VI) — MnO3, H2MnO4 — неустойчивы, в свободном виде не получены. Обладают кислотными свойствами. Наиболее устойчивые соли — манганаты, окрашивающие раствор в зеленый цвет.
Манганаты получают в ходе разложения перманганатов, а также реакциями в щелочной среде.
В водной среде манганаты разлагаются на с.о. +7 и +4. Манганаты окисляют хлором.
Соединения марганца (VII) — неустойчивый Mn2O7, и относительно устойчивая в разбавленных растворах HMnO4 — проявляют кислотные свойства. Соли марганцовой кислоты — перманганаты.
В различных средах — кислотной, нейтральной и щелочной — марганец принимает различные степени окисления. Внимательно изучите таблицу ниже.
Оксид марганца (VII) получают в реакции перманганата с сильными кислотами.
При растворении оксида марганца (VII) (кислотного оксида) в щелочи образуются соли марганцовой кислоты — перманганаты.
Марганцовая кислота получается в реакциях сильных окислителей с солями марганца (II).
В растворах с концентрацией марганцовой кислоты более 20% происходит ее разложение.
При нагревании перманганата калия (в быту — марганцовка) разлагается с образованием бурого MnO2, выделением кислорода.
При стоянии в растворе постепенно разлагается водой.
В кислой среде марганец принимает наиболее устойчивую (для кислой среды) — Mn 2+ , в щелочной — Mn 6+ .
Название цинка, вероятно, связано формой его кристаллитов: в переводе с немецкого Zinke — зубец. С древнейших времен известен сплав меди с цинком — латунь.
Для цинка характерна постоянная степень окисления +2.
Наиболее известные минералы, в которых содержится цинк:
- ZnS — цинковая обманка, сфалерит
- ZnO — цинкит
- ZnCO3 — симсонит, цинковый шпат
- 2ZnO*SiO2*H2O — гемиморфит
Пирометаллургический метод получения цинка заключается в обжиге цинковой обманки, и последующем восстановлении оксида цинка различными восстановителями: чаще всего C, также возможно CO и H2.
ZnO + C = (t) Zn + CO
ZnO + CO = (t) Zn + CO2
Гидрометаллургический метод получения основывается на электролизе сульфата цинка.
- Реакции с неметаллами (и аммиаком 🙂
На воздухе цинк покрывается оксидной пленкой. При нагревании цинк реагирует с галогенами, фосфором, серой, селеном.
Для цинка не характерны реакции с водородом, бором, кремнием, азотом, углеродом. Нитрид цинка можно получить в ходе реакции цинка с аммиаком.
Реакции с кислотами
Цинк способен проявлять амфотерные (двойственные) свойства: реагирует как с кислотами, так и с основаниями. При добавлении цинка в раствор щелочи выделяется водород.
Zn + H2O + NaOH = Na2[Zn(OH)4] + H2↑ (тетрагидроксоцинкат натрия)
Соединения цинка (II)
Эти соединения обладают амфотерными свойствами. Оксид цинка (II) можно получить в ходе реакции горения цинка или при разложении нитрата цинка.
Оксид цинка (II) проявляет амфотерные свойства, реагирует как с кислотами, так и с щелочами.
ZnO + H2O + 2NaOH = Na2[Zn(OH)4] (тетрагидроксоцинкат натрия)
Комплексные соли образуются в растворе, при прокаливании они не образуются.
ZnO + 2NaOH = (t) H2O + Na2ZnO2 (цинкат натрия)
Оксид цинка (II) может быть восстановлен до чистого цинка различными восстановителями.
ZnO + C = (t) Zn + CO
ZnO + CO = (t) Zn + CO2
Гидроксид цинка (II) получается в ходе реакций между растворимыми солями цинка и щелочами.
Гидроксид цинка (II) обладает амфотерными свойствами, реагирует как с кислотами, так и с основаниями.
При прокаливании комплексные соли распадаются, вода испаряется.
Серебро
Драгоценный металл, известный человеку с древнейших времен. Встречаемся в самородном виде. Будучи благородным металлом, серебро обладает низкой реакционной способностью.
- Реакции с неметаллами
Серебро не окисляется кислородом даже при высокой температуре. Галогены легко окисляют серебро до соответствующих галогенидов. При нагревании с серой получается сульфид серебра.
Реакции с кислотами
Серебро не растворяется в соляной и разбавленной серной кислотах, однако способно реагировать с концентрированными кислотами.
Потемнение серебряных изделий обусловлено реакцией серебра с сероводородом в присутствии кислорода.
С органическими веществами
В дальнейшем, при изучении органической химии, вы не раз столкнетесь с соединением серебра — аммиачным раствором оксида серебра.
Будет полезно, если вы уже сейчас познакомитесь с его формулой на примере реакции окисления уксусного альдегида до уксусной кислоты.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Марганец, цинк и серебро
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Марганец (Mn)
Соединения марганца:
Пиролюзит(минерал марганца) был известен людям еще с древних времен, он использовался нашими предками для осветления стекла, получаемого варкой. До 1774 г. пиролюзит считали разновидностью магнитного железняка. И только в 1774 г. швед К. Шееле догадался, что в пиролюзите присутствует неизвестный тогдашней науке металл, после чего Ю. Ган получил металлический марганец, нагревая пиролюзит в печке с углем. Свое название «марганец» получил в начале 19 века (от немецкого Manganerz — марганцевая руда).
Марганец занимает 14-е место среди всех химических элементов по распространенности в земной коре. Больше всего марганца содержится в основных породах. Самостоятельные месторождения марганца крайне редки, чаще этот металл сопутствует железу во многих его рудах. Достаточно много марганца содержится в железо-марганцевых конкрециях, расположенных в донной части Мирового океана.
Минералы, богатые марганцем:
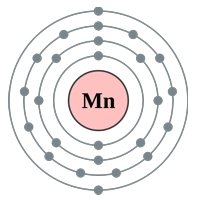
Рис. Строение атома марганца.
Электронная конфигурация атома марганца — 1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 2 (см. Электронная структура атомов). В образовании химических связей с другими элементами могут участвовать 2 электрона, находящихся на внешнем 4s-уровне + 5 электронов 3d-подуровня (всего 7 электронов), поэтому в соединениях марганец может принимать степени окисления от +7 до +1 (наиболее часто встречаются +7, +2). Марганец является химически активным металлом. Аналогично алюминию при комнатной температуре реагирует с кислордом, содержащимся в атмосферном воздухе, с образованием прочной защитной оксидной пленки, которая предотвращает дальнейшее окисление металла.
Физические свойства марганца:
- металл серебристо-белого цвета;
- твердый;
- хрупкий при н. у.
Известны 4 модификации марганца: α-форма; β-форма; γ-форма; δ-форма.
До 710°C устойчивой является α-форма, которая при дальнейшем нагревании последовательно через все модификации переходит к δ-форме (1137°C).
Видео:ОВР с соединениями марганца, хрома железа и меди | Химия с Юлией ВишневскойСкачать

Химические свойства марганца
- марганец (порошок) легко реагирует с кислородом, образуя оксиды, вид которого зависит от температуры реакции:
- 450°C — MnO2;
- 600°C — Mn2O3;
- 950°C — Mn3O4;
- 1300°C — MnO.
- мелкораздробленный марганец при нагревании реагирует с водой с выделением водорода:
Mn + 2H2O = Mn(OH)2 + H2; - марганец (порошок) при нагревании вступает в реакцию с азотом, углеродом, серой, фосфором:
Mn + S = MnS; - активно реагирует с разбавленными соляной и серной кислотами с выделением водорода:
Mn + 2HCl = MnCl2 + H2; - реагирует с разбавленной азотной кислотой:
3Mn + 8HNO3 = 3Mn(NO3)2 + 2NO + 4H2O.
Видео:Окислительно-восстановительные реакции в кислой среде. Упрощенный подход.Скачать

Применение и получение марганца
- чистый марганец получают электролизом водных растворов MnSO4 с добавкой (NH4)2SO4 при pH=8-8,5: анод — свинец; катод — нержавеющая сталь (чешуйки марганца снимают с катодов);
- менее чистый марганец получают из его оксидов металлотермическими методами:
- алюмотермия:
4Al + 3MnO2 = 3Mn + 2Al2O3; - кремнийтермия:
Si + MnO2 = Mn + SiO2.
- алюмотермия:
- в металлургии марганец используют для связывания серы и кислорода:
Mn + S = MnS; 2Mn + O2 = 2MnO; - в качестве лигирующей добавки при выплавке различных сплавов (марганец дает коррозоустойчивость, вязкость, твердость):
- манганин — сплав марганца с медью и никелем;
- ферромарганец — сплав марганца с железом;
- марганцевая бронза — сплав марганца с медью.
- Калия перманганат издавная используют в качестве антисепитческого средства, которое действует только на поверхности кожи и слизистых оболочек.
Биологическая роль марганца:
Марганец входит в десятку «металлов жизни», необходимых для нормальной жизнедеятельности животных и растительных клеток.
В теле взрослого человека содержится порядка 12 мг марганца, который участвует в образовании белковых комплексов, а также входит в состав некоторых нуклеиновых кислот, аминокислот, ферментов (аргиназы и холинэстеразы).
Марганец наряду с магнием участвует в активации гидролиза АТФ, обеспечивая тем самым энергетическую жизнедеятельность живой клетки.
Ионы марганца участвуют в активации нуклеазы — данный фермент необходим для разложения нуклеиновых кислот до нуклеотидов.
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
📹 Видео
Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Реакции металлов с кислородом и водой. 8 класс.Скачать

ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

Заканчиваем решать 13-й вариант сборника Добротина (номера 29-34)Скачать

Химические уравнения. Урок 15. Химия 7 классСкачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Химические свойства марганца. Часть 1.Скачать

Электролиз сульфата МАРГАНЦАСкачать

22е задание с ОВР(получение гидроксида марганца (II))Скачать

68 учеников этого НЕ ЗНАЮТ! Таблица Менделеева — Как пользоваться?Скачать

ВОДА+ЙОД+ПЕРЕКИСЬ ВОДОРОДА+СОДА/\WATER+IODINE+HYDROGEN PEROXIDE+BAKING SODAСкачать

Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

ХИМИЧЕСКИЙ ОПЫТ - Глицерин и МарганцовкаСкачать

Химические св-ва соединений марганца Mn (+7) (KMnO4). Решаем окислительно-восстановительные р-ции.Скачать

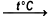 Mn(OH)2 + H2
Mn(OH)2 + H2