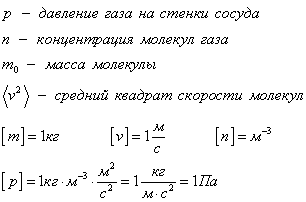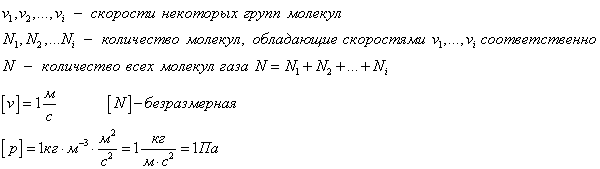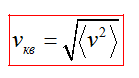- Тестирование онлайн
- Идеальный газ
- Параметры состояния газа
- Основное уравнение молекулярно-кинетической теории
- Температура
- Основное уравнение молекулярно-кинетической теории (Ерюткин Е.С.)
- Урок физики : «Идеальный газ в молекулярно-кинетической теории. Основное уравнение молекулярно- кинетической теории газа.» план-конспект урока по физике (10 класс) на тему
- Скачать:
- Предварительный просмотр:
- 🎬 Видео
Видео:Тема 2. Макро и микропараметры. Идеальный газ. Основное уравнение МКТ идеального газаСкачать

Тестирование онлайн
Видео:Идеальный газ. Основное уравнение молекулярно-кинетической теории газов. 10 класс.Скачать

Идеальный газ
Это несуществующая физическая модель газа, который состоит из большого числа молекул, размеры которых ничтожно малы по сравнению со средними расстояниями между ними. Молекулы такого газа можно считать материальными точками, это означает, что их вращательное и колебательное движения не принимаются во внимание. Движение молекул происходит без столкновений с другими молекулами, подчиняется законам Ньютона. Соударения молекул со стенками сосуда являются абсолютно упругими.
Видео:Урок 145. Идеальный газ. Основное ур-ние МКТ ид. газа - 1Скачать

Параметры состояния газа
Давление, температура и объем — параметры состояния газа. Или их называют макропараметрами. Температура — внешняя характеристика скоростей частиц газа. Давление — внешняя характеристика соударений со стенками, например, сосуда. Объем — место, куда заключены частицы газа. Газ занимает весь предоставленный ему объем. Существуют еще внешние параметры, например тела или поля, действующие на газ из вне.
Микропараметры (маленькие, внутренние характеристики) газа — это параметры, которые мы не можем оценить без специальных экспериментов, например, скорость и направление движения каждой молекулы газа.
Состояние термодинамической системы, когда все ее параметры при неизменных внешних условиях не изменяются со временем, называют равновесным.
Видео:Идеальный газ. Основное уравнение молекулярно-кинетической теории газов. Практическая часть.10 классСкачать

Основное уравнение молекулярно-кинетической теории
Уравнение связывает микропараметры и макропараметры (давление, объем и температуру) идеального газа.
Рассмотрим идеальный газ, который находится в кубическом сосуде. Каждая молекула упруго сталкивается со стенкой сосуда, при этом изменятся ее импульс. Столкновение всех молекул со стенкой на макроуровне ощущается как давление газа на сосуд. В формулах будут присутствовать средние значения, потому что какая-то молекула движется быстрее, какая-то помедленнее, для того, чтобы оценить примерную скорость, будем брать средние значения.
Основное уравнение мкт имеет вид

Средний квадрат скорости молекул

Средняя квадратичная скорость vкв молекул это квадратный корень из среднего квадрата скорости
Средняя кинетическая энергия молекул

Можно вывести формулы

Видео:Идеальный газ в молекулярно-кинетической теории | Физика 10 класс #28 | ИнфоурокСкачать

Температура
Это макропараметр, который характеризует способность тел к теплопередаче. Если два тела разной температуры контактируют, то произойдет переход энергии или передача теплоты от более горячего к холодному. Установится тепловое равновесие, все части будут одинаковой температуры.
Температура характеризует интенсивность движения частиц, поэтому связана со средней кинетической энергией частиц. Из опыта известно, что средняя кинетическая энергия молекул не зависит от вида газа и определяется температурой.


Связь между температурами по шкале Цельсия и по шкале Кельвина
Видео:Физика 10 класс : Основное уравнение молекулярно-кинетической теории идеального газаСкачать

Основное уравнение молекулярно-кинетической теории (Ерюткин Е.С.)
Этот видеоурок доступен по абонементу
У вас уже есть абонемент? Войти
Как уже было сказано ранее, начиная с этого урока, мы приступаем к изучению только газов. На прошлом уроке мы дали представление о способах количественного описания некой порции вещества. Сейчас же мы начнём описывать газ со стороны его качественных характеристик (микро- и макропараметров). Мы сформулируем понятие об идеальном газе, опишем его параметры и введём соотношение, связывающее эти параметры (основное уравнение МКТ).
Видео:Урок 147. Задачи на основное уравнение МКТ идеального газаСкачать

Урок физики : «Идеальный газ в молекулярно-кинетической теории. Основное уравнение молекулярно- кинетической теории газа.»
план-конспект урока по физике (10 класс) на тему
План-конспект урока физики «Идеальный газ в молекулярно-кинетической теории. Основное уравнение молекулярно- кинетической теории газа.»
Видео:Физика 10 класс (Урок№18 - Основное уравнение МКТ.)Скачать

Скачать:
| Вложение | Размер |
|---|---|
| Идеальный газ в молекулярно-кинетической теории. Основное уравнение молекулярно- кинетической теории газа | 75.28 КБ |
Видео:Урок 146. Основное уравнение МКТ идеального газа - 2Скачать

Предварительный просмотр:
Урок в 10 классе
Тема: «Идеальный газ в молекулярно-кинетической теории. Основное уравнение молекулярно- кинетической теории газа.»
Познавательная: дать основные понятия идеального газа и основного уравнения МКТ
Обучающая: объяснить связь между энергией и температурой
Воспитательная: воспитание научного мировоззрения.
- Оргмомент
- Проверка д.з.
- Постановка целей и задач урока.
- Объяснение нового материала.
Идеальный газ – это газ со следующими свойствами:
- Размеры молекул малы по сравнению со средним расстоянием между ними; молекулы можно принять за материальные точки;
- Силы притяжения между молекулами не учитываются, а силы отталкивания возникают только при соударениях;
- Молекулы сталкиваются друг с другом как абсолютно упругие шары, движение которых описывается законами классической механики (в этом случае принимать молекулы за материальные точки нельзя).
На основании этой модели можно объяснить, почему газ занимает весь предоставленный ему объём, лёгкую сжимаемость газов, давление, которое оказывает газ на стенки сосудов, газовые законы.
Как и любая модель, модель идеального газа имеет свои ограничения. Она применима при небольших давлениях (менее 100 атм) и не очень низких температурах.
Для описания состояния газа можно воспользоваться микропараметрами . Это – масса и скорость молекул, энергия и импульс молекул, их концентрация. Данные параметры являются индивидуальными характеристиками молекул. Найти их с помощью простых измерительных приборов невозможно. Гораздо большую практическую роль играют макропараметры . Значения макропараметров определяются совместным действием огромного количества молекул, и измерить их можно, используя достаточно простые приборы.
Три макропараметра – объём, давление и температура – позволяют описать состояние любой газовой системы.
Под объёмом газа понимают объём сосуда, в котором находится газ.
Единица измерения объёма в системе СИ – 1 м 3 .
Давление газа – это средняя сила ударов молекул о стенки сосуда, приходящаяся на единицу поверхности стенки.
Единица измерения давления в системе СИ – 1 паскаль.
1 паскаль – это давление, при котором на площадь поверхности 1 м 2 действует сила в 1 Н, направленная перпендикулярно поверхности.
Внесистемная единица измерения давления – физическая атмосфера.
Физический смысл основного уравнения МКТ заключается в том, что давление идеального газа — это совокупность всех ударов молекул о стенки сосуда. Это уравнение можно выразить через концентрацию частиц, их среднюю скорость и массу одной частицы:
p – давление молекул газа на границы емкости,
m 0 – масса одной молекулы,
n — концентрация молекул, число частиц N в единице объема V;
v 2 — средне квадратичная скорость молекул.
Вывод основного уравнения МКТ
Частицы идеального газа при соударениях с границами емкости ведут себя как упругие тела. Такое взаимодействие описывается согласно законам механики. При соприкосновении частицы с границей емкости проекция v x скоростного вектора на ось ОХ, проходящую под прямым углом к границе сосуда, меняет свой знак на противоположный, но сохраняется неизменной по модулю:
Поэтому после соударения частицы с границей емкости проекция импульса молекулы на ось ОХ меняется с mv 1x = –mv x на mv 2x = mv x .
Изменение импульса молекулы ΔP равняется удвоенному произведению массы молекулы на ее скорость:
Поскольку в каждом из шести основных направлений декартовой системы координат (вверх, вниз, вперед, назад, вправо, влево) движется одна шестая часть частиц N/6. Тогда число частиц, которые сталкиваются с каждой стенкой за время Δt равно:
S – площадь этой стенки
n — концентрация частиц
Давление p равно отношению силы F к площади S, на которую действует эта сила:
Суммарная сила, с которой частицы давят на стенку равна отношению произведения числа этих частиц N и изменения импульса ΔP ко времени, в течение которого происходит давление:
Исходя из вышенаписанного получаем:
Если заменить среднее значение кинетической энергии поступательного движения молекул — E:
и подставить эту формулу в основное уравнение МКТ, получим давление идеального газа:
Давление идеального газа равняется двум третям средней кинетической энергии поступательного движения молекул на единицу объема. При решении задач реальный газ можно считать идеальным газом, если он одноатомный и можно пренебречь взаимодействием между частицами.
- Закрепление – решение задач
1. При неизменной концентрации молекул гелия средняя кинетическая энергия теплового движения его молекул уменьшилась в 4 раза. При этом давление газа:
1) уменьшилось в 16 раз
2) уменьшилось в 2 раза
3) уменьшилось в 4 раза
4) не изменилось
Согласно основному уравнению МКТ, давление p прямо пропорционально средней кинетической энергии поступательного движения молекул: . Если правая часть уравнения уменьшается в 4 раза, то и левая должна тоже уменьшится в 4 раза, ответ: 3.
2. Давление газа зависит от:
А) концентрации молекул
Б) средней кинетической энергии молекул
Выберите верный вариант:
1) только от А 2) только от Б 3) и от А, и от Б 4)ни от А, ни от Б
Правильный ответ – 3, согласно основному уравнению МКТ, см. предыдущую задачу.
3. В результате остывания газа средняя кинетическая энергия теплового движения его молекул уменьшилась в три раза. При этом абсолютная температура газа:
1) уменьшилась в 3 раза
2) уменьшилась в 9 раз
3) уменьшилось в раз
4) не изменилась
Из основного уравнения МКТ: и определения абсолютной температуры: имеем: – средняя кинетическая энергия хаотического поступательного движения молекул газа пропорциональна абсолютной температуре. Таким образом, если энергия уменьшилась втрое, то и температура – тоже уменьшилась втрое.
4. В результате нагревания идеального газа его давление при постоянной концентрации молекул увеличилось в два раза. При этом абсолютная температура газа:
1) увеличилась в 4 раза
2) увеличилась в 2 раза
3) уменьшилось в 2 раза
4) не изменилась
Согласно зависимости давления газа от абсолютной температуры Т и концентрации его молекул: давление прямо зависит от температуры, и наоборот. Тогда при увеличении давления вдвое температура тоже увеличилась вдвое.
5. При понижении температуры газа в запаянном сосуде давление газа уменьшается. Это уменьшение давления объясняется тем, что
1) уменьшается объём сосуда за счет остывания его стенок
2) уменьшается энергия теплового движения молекул газа
3) уменьшаются размеры молекул газа при его охлаждении
4) уменьшается энергия взаимодействия молекул газа друг с другом
Объем сосуда может измениться вследствие уменьшения давления газа при понижении температуры – так стенки канистры, если в ней был бензин и остались его пары, втягиваются внутрь при похолодании. Но за счет остывания стенок мы это вряд ли заметим невооруженным глазом.
Размеры молекул – величина постоянная и не меняется ни с температурой, ни по другим причинам.
Энергия взаимодействия молекул газа друг с другом определяется их средней кинетической энергией, которая-то и зависит от температуры: , .
6. На графике показана зависимость давления от концентрации для двух идеальных газов при фиксированных температурах. Отношение температур этих газов равно
Согласно уравнению идеального газа . Выразим температуру:
Для первого газа:
Для второго газа:
Отношение температур тогда: . Возьмем точки на графиках, у которых давление одинаковое, тогда:
. Во взятых точках концентрация молекул второго газа вдвое больше, чем первого. Тогда .
7. На графиках представлены зависимости концентрации n и температуры T идеального газа от времени. Из этих зависимостей следует, что давление газа с течением времени
1) увеличивалось
2) уменьшалось
3) не изменялось
4) сначала увеличивалось, а потом изменялось
Согласно уравнению идеального газа давление прямо пропорционально как концентрации, так и температуре. Значит, раз и температура растет, и концентрация – значит, давление все время растет.
8. В результате охлаждения одноатомного идеального газа его давление уменьшилось в 4 раза, а концентрация молекул газа не изменилась. При этом средняя кинетическая энергия теплового движения молекул газа
1) уменьшилась в 16 раз
2) уменьшилась в 2 раза
3) уменьшилась в 4 раза
4) не изменилась
Давление газа зависит от средней кинетической энергии теплового движения молекул так: . Тогда, если левая часть уравнения уменьшена в 4 раза, то и правая должна уменьшиться во столько же раз. При этом мы знаем, что концентрация не менялась – значит, уменьшилась вчетверо средняя кинетическая энергия теплового движения молекул.
- Выводы по уроку
- Домашнее задание по учебнику
🎬 Видео
Физика 10 Идеальный газ Основное уравнение МКТ идеального газа Решение задачСкачать

Решение задач на основное уравнение МКТ идеального газа | Физика 10 класс #29 | ИнфоурокСкачать

Уравнение состояния идеального газа. 10 класс.Скачать

Пошаговая инструкция для крепкого иммунитета круглый годСкачать

Физика. МКТ: Идеальный газ. Центр онлайн-обучения «Фоксфорд»Скачать

Как научиться решать задачи по химии. В чем особенность химических задач.Скачать

Все формулы молекулярной физики, МКТ 10 класс, + преобразования и шпаргалкиСкачать

ЕГЭ по физике. Теория #25. Идеальный газ. Уравнение состояния идеального газаСкачать

🧬 Молекулярная физика: идеальный газ и изопроцессы с нуля | Физика ЕГЭ 2024 | УмскулСкачать

Идеальный газ. Основное уравнение МКТСкачать