Для установления качественного состава многих продуктов питания используется ксантопротеиновая реакция на белок. Наличие ароматических аминокислот в соединении даст положительное изменение цвета исследуемого образца.
- Что такое белок
- Структура протеинов
- Аминокислоты
- Что означает ксантопротеиновая реакция
- Какие определяются аминокислоты
- Какие используют реактивы
- Методика проведения
- Особенности проведения
- Сравнительная реакция с фенолом
- Сравнительная проба с желатином
- Химические уравнения
- Результаты
- Ксантопротеиновая реакция уравнение с азотной кислотой концентрированной
- Лабораторная работа №1
- 📹 Видео
Видео:Реакции 16ти металлов с азотной кислотой разной концентрации Reactions of 16 metals with nitric acidСкачать

Что такое белок
Его еще называют протеином, являющимся строительным материалом для живого организма. Белки поддерживают объем мышц, восстанавливают травмированные и отмершие тканевые структуры различных органов, будь то волосы, кожные покровы или связки. При их участии производятся красные тельца крови, регулируется нормальная работа многих гормонов и клеток иммунной системы.
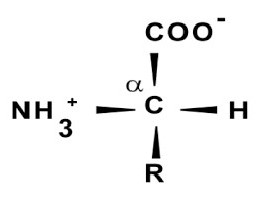
Это сложная молекула, представляющая собой полипептид с массой больше 6*10 3 дальтон. Белковую структуру образуют остатки аминокислотные в большом количестве, соединенные пептидной связью.
Видео:Азотная кислота на ОГЭ по химии | ОГЭ 2023 | УмскулСкачать

Структура протеинов
Отличительной чертой данных веществ по сравнению с низкомолекулярными пептидами является их развитое пространственное трехмерное строение, поддерживаемое влияниями с разной степенью притяжения. Белки обладают четырехуровневой структурой. Для каждого из них присущи свои характеристики.
За основу первичной организации их молекул взята аминокислотная последовательность, строение которых распознает ксантопротеиновая реакция на белок. Такая структура представляет собой периодически повторяющуюся пептидную связь -HN-CH-CO-, а избирательной частью являются радикалы боковой цепочки в аминокарбоновых кислотах. Именно они определяют в дальнейшем свойства вещества в целом.
Первичную белковую структуру считают достаточно прочной, это обусловлено наличием сильных ковалентных взаимодействий в пептидных связях. Образование последующих уровней происходит в зависимости от признаков, установленных на начальном этапе.
Формирование вторичной структуры возможно благодаря скручиванию аминокислотной последовательности в спираль, в которой между витками устанавливаются водородные связи.
Третичный уровень организации молекулы образуется при наложении одной части спирали на другие фрагменты с возникновением между ними всевозможных связей, с водородным, дисульфидным, ковалентным или ионным соединением. В результате получаются ассоциации в виде глобул.
Пространственное расположение третичных структур с образованием химических связей между ними приводит к формированию конечного вида молекулы или четвертичному уровню.
Видео:Азотная кислота. Химические свойства. Реакции с НЕметаллами.Скачать

Аминокислоты
Именно они обуславливают химические свойства белков. Насчитывают около 20 главных аминокислот, входящих в состав полипептидов в разной последовательности. Сюда также причисляют редкие аминокарбоновые кислоты в виде гидроксипролина и гидроксилизина, являющиеся производными основных пептидов.
Как признак ксантопротеиновой реакции распознавания белков, присутствие отдельных аминокислот дает изменение окраски реактивов, что позволяет предполагать о наличии специфических структур в их составе.
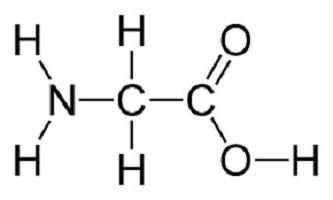
Как оказалось, все они представляют собой карбоновые кислоты, у которых произошло замещение атома водорода на аминогруппу.
Примером строения молекулы может служить структурная формула глицина (HNH− HCH− COOH) как простейшей аминокислоты.
В данном случае один из водородов CH2— углерода может быть заменен более длинным радикалом, включающим бензольное кольцо, амино-, сульфо-, карбоксигруппы.
Видео:Получение концентрированной азотной кислотыСкачать

Что означает ксантопротеиновая реакция
Для проведения качественного анализа протеинов используют различные методики. К ним относят реакции:
- биуретовую с появлением фиолетового окрашивания;
- нингидриновую с образованием сине-фиолетового раствора;
- формальдегидную с установлением красного окрашивания;
- Фоля с выпадением осадка серо-черного цвета.
При проведении каждого метода доказывается присутствие протеинов и наличие определенной функциональной группы в их молекуле.
Существует ксантопротеиновая реакция на белок. Ее называют еще пробой Мульдера. Относится она к цветным реакциям на протеины, в которых присутствуют ароматические и гетероциклические аминокислоты.
Особенностью такой пробы является процесс нитрования кислотой азотной циклических аминокислотных остатков, в частности присоединение нитрогруппы к бензольному кольцу.
Результатом такого процесса является образование нитросоединения, которое осаждается. Это основной признак ксантопротеиновой реакции.
Видео:Азотная кислота и металлы за 13 минут | ХИМИЯ ЕГЭ | СОТКАСкачать

Какие определяются аминокислоты
Не все аминокарбоновые кислоты можно выявить с помощью такой пробы. Основной признак ксантопротеиновой реакции распознавания белков — наличие бензольного кольца или гетероцикла в составе молекулы аминокислоты.
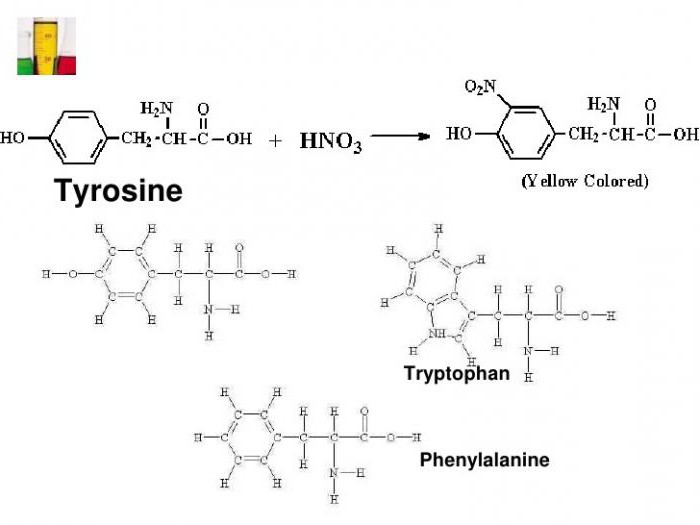
Из протеиновых аминокарбоновых кислот выделяют две ароматические, в которых имеется фенильная группа (у фенилаланина) и гидроксифенильный радикал (у тирозина).
С помощью ксантопротеиновой реакции определяют гетероциклическую аминокислоту триптофан, имеющую ароматическое индольное ядро. Наличие вышеуказанных соединений в белке дает характерное изменение окраски испытуемой среды.
Видео:Азотная кислота. Физические и химические свойства азотной кислоты. Подготовка к ЕГЭ по химии | ХимияСкачать

Какие используют реактивы
Для проведения ксантопротеиновой реакции потребуется приготовить 1%-й раствор протеина яичного или растительного происхождения.
Обычно используют куриное яйцо, которое разбивают для дальнейшего отделения белка от желтка. Для получения раствора 1%-й протеин разводят в десятикратном количестве очищенной воды. После растворения белка полученную жидкость необходимо отфильтровать через несколько слоев марли. Такой раствор следует хранить в холодном месте.
Можно проводить реакцию с растительным белком. Для приготовления раствора используют муку пшеничную в количестве 0,04 кг. Добавляют 0,16 л очищенной воды. Ингредиенты смешивают в колбе, которую ставят на 24 часа в холодное место с температурой около +1°С. По истечении суток раствор взбалтывают, после чего проводят его фильтрацию сначала с помощью ваты, а затем − бумажного складчатого фильтра. Полученную жидкость держат в холодном месте. В таком растворе присутствует в основном альбуминовая фракция.
Для проведения ксантопротеиновой реакции в качестве основного реактива используют азотную кислоту концентрированную. Дополнительными реагентами является раствор 10%-го гидроксида натрия или аммиака, желатиновый раствор и неконцентрированный фенол.
Видео:Реакции металлов с азотной кислотой. Химический опытСкачать

Методика проведения
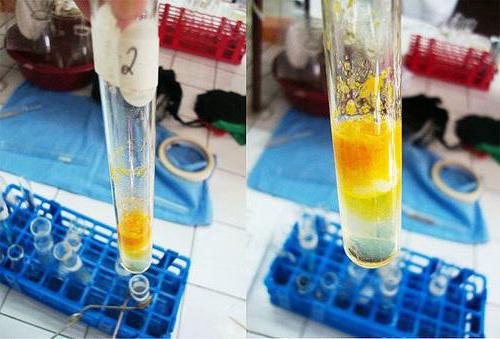
В чистую пробирку вносят 1%-й раствор белка яйца или муки в количестве 2 мл. К нему прибавляют около 9 капель кислоты азотной концентрированной, чтобы прекратилось выпадение хлопьев. Полученную смесь нагревают, в результате осадок желтеет и постепенно исчезает, а его цвет переходит в раствор.
Когда жидкость остынет, в пробирку по стеночке добавляют около 9 капель натрия гидроксида концентрированного, что является избытком для процесса. Реакция среды становится щелочной. Содержимое в пробирке приобретает оранжевую окраску.
Видео:Ксантопротеиновая реакцияСкачать

Особенности проведения
Так как ксантопротеиновой называют качественную реакцию на белки под действием азотной кислоты, то пробу проводят под включенным вытяжным шкафом. Соблюдают все меры безопасности при работе с концентрированными едкими веществами.
В процессе нагревания может происходить выброс содержимого из пробирки, что следует учитывать при закреплении ее в держателе и выборе наклона.
Набирать концентрированную азотную кислоту и едкий натрий следует только с помощью стеклянной пипетки и груши резиновой, запрещается набирать ртом.
Видео:Опыты по химии. Ксантопротеиновая реакцияСкачать

Сравнительная реакция с фенолом
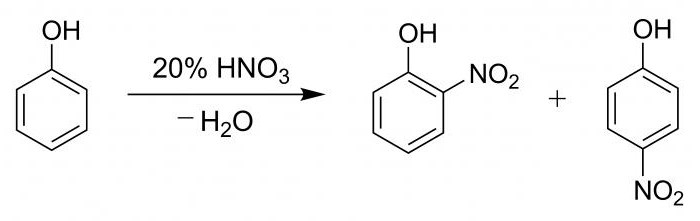
Для наглядности процесса и подтверждения наличия фенильной группы проводят подобную пробу с гидроксибензолом.
В пробирку вносят 2 мл фенола разведенного, затем постепенно, по стеночке, добавляют 2 мл кислоты азотной концентрированной. Раствор подвергают нагреванию, в результате чего он становится желтым. Данная реакция является качественной на присутствие бензольного кольца.
Процесс нитрования гидроксибензола азотной кислотой сопровождается образованием смеси из паранитрофенола и ортонитрофенола в процентном соотношении 15 к 35.
Видео:Как правильно писать ОВР с азотной кислотой? В интернете кто-то неправСкачать

Сравнительная проба с желатином
Чтобы доказать, что ксантопротеиновая реакция на белок выявляет аминокислоты только с ароматическим строением, используют протеины, не имеющие фенольной группы.
В чистую пробирку вносят 1%-й желатиновый раствор в количестве 2 мл. К нему прибавляют около 9 капель кислоты азотной концентрированной. Полученную смесь нагревают. Раствор не окрашивается в желтый цвет, что доказывает отсутствие аминокислот с ароматической структурой. Иногда наблюдается незначительное пожелтение среды, связанное с наличием протеиновых примесей.
Видео:Азотная кислота. Физические и химические свойства. 9 класс.Скачать

Химические уравнения
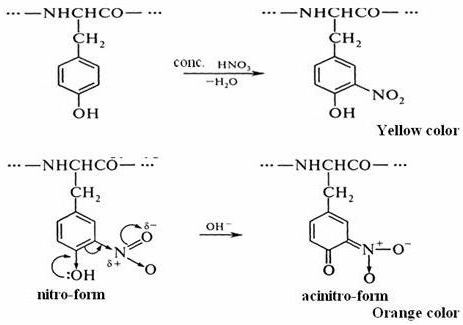
В две стадии проходит ксантопротеиновая реакция на белки. Формула первого этапа описывает процесс нитрования аминокислотной молекулы с помощью кислоты азотной концентрированной.
Примером может служить присоединение нитрогруппы к тирозину с образованием нитротирозина и динитротирозина. В первом случае к бензольному кольцу прикрепляется один NO2-радикал, а во втором соединении уже два атома водорода замещается на NO2. Химическая формула ксантопротеиновой реакции представлена взаимодействием тирозина с азотной кислотой с образованием молекулы нитротирозина.
Процесс нитрования сопровождается переходом бесцветной окраски в желтый тон. При проведении подобной реакции с белками, содержащими аминокислотные остатки триптофана или фенилаланина, цвет раствора также изменяется.
На втором этапе происходит взаимодействие продуктов нитрования молекулы тирозина, в частности нитротирозина, с аммония или натрия гидроксидом. В результате получается натриевая или аммонийная соль, у которых цвет желто-оранжевый. Такая реакция связана с возможностью молекулы нитротирозина переходить в хиноидную форму. В дальнейшем из нее образуется соль нитроновой кислоты, у которой имеется хиноновая система из двойных сопряженных связей.
Так заканчивается ксантопротеиновая реакция на белки. Уравнение второй стадии представлено выше.
Видео:азотный кислота чуть не взорвалась до конца смотрите химия реакция лабораторияСкачать

Результаты
В процессе анализа жидкостей, содержащихся в трех пробирках, раствором сравнения служит разбавленный фенол. Вещества с бензольным кольцом дают качественную реакцию с кислотой азотной. В результате изменяется окраска раствора.
Как известно, желатин включает коллаген в гидролизованной форме. Данный белок не содержит аминокарбоновых кислот ароматического строения. При взаимодействии с кислотой не происходит изменения окраски среды.
В третьей пробирке наблюдается положительная ксантопротеиновая реакция на белки. Вывод можно сделать следующий: все протеины с ароматической структурой, будь то фенильная группа или индольное кольцо, дают изменение цвета раствора. Это связано с образованием нитросоединений с желтой окраской.
Проведение цветной реакции доказывает наличие разнообразной химической структуры в аминокислотах и белках. Пример с желатином показывает, что в его составе присутствуют аминокарбоновые кислоты, не имеющие фенильной группы или циклического строения.
С помощью ксантопротеиновой реакции можно объяснить пожелтение кожи при нанесении на нее сильной азотной кислоты. Такой же цвет приобретет молочная пенка при проведении с ней подобного анализа.
В медицинской лабораторной практике данную цветную пробу не используют для обнаружения белка в моче. Это связано с желтой окраской самой мочи.
Ксантопротеиновая реакция стала все чаще использоваться для количественного подсчета таких аминокислот, как триптофан и тирозин, в составе различных белков.
Видео:Азотная кислота. Химические свойства. Взаимодействие с металлами.Скачать

Ксантопротеиновая реакция уравнение с азотной кислотой концентрированной
16 лет успешной работы в сфере подготовки к ЕГЭ и ОГЭ!
1602 поступивших (100%) в лучшие вузы Москвы
Подготовка к ЕГЭ, ОГЭ и предметным Олимпиадам в Москве
| До окончания записи осталось: | |||||||
| Записаться на экспресс-курс! | |||||||
- home
- map
У Вас возникли вопросы?
Мы обязательно Вам перезвоним:
Этот видеоопыт по химии расскажет вам о том, почему при взаимодействии с азотной кислотой белок становится желтым – это ксантопроеиновая реакция на белки.
Описание.
Ксантопротеиновую реакцию проводят для качественного определения белков, содержащих ароматические аминокислоты. Для испытания возьмем раствор белка куриных яиц. К раствору добавляем концентрированную азотную кислоту. Белок свертывается, происходит денатурация – разрушение структуры белка. Теперь нагреем пробирку с белком.
При нагревании белок становится желтым – азотная кислота взаимодействует с бензольным кольцом, при этом образуется окрашенное соединение. Если добавить в пробирку аммиак, окраска усиливается. Появление окрашивания свидетельствует о наличии ароматических аминокислот в составе белка.
Видео:Реакция алюминия с концентрированной азотной кислотой при нагреванииСкачать

Лабораторная работа №1
Лабораторная работа №1
ХИМИЯ ПРОСТЫХ БЕЛКОВ.
ЦВЕТНЫЕ РЕАКЦИИ НА БЕЛКИ И АМИНОКИСЛОТЫ
Белки представляют собой высокомолекулярные полимерные органические соединения, построенные из остатков различных α-аминокислот, соединенных ковалентной пептидной связью.
Присутствие белка в растворах можно обнаружить с помощью цветных реакций, обусловленных наличием в белке аминокислот, их специфических групп и пептидных связей. Существуют универсальные цветные реакции, т. е. на все белки (биуретовая и нингидриновая), и специфические, т. е. на определенные аминокислоты (ксантопротеиновая, Миллона, Фоля и др.).
На основании некоторых цветных реакций разработаны методы количественного определения белков и аминокислот, которые широко используются в биохимических лабораториях.
Цель: Ознакомиться с универсальными цветными реакциями на белки и специфическими реакциями на отдельные аминокислоты, содержащиеся в белковых растворах.
Работа 1. Биуретовая реакция на пептидную связь (Пиотровского)
Биуретовая реакция обусловлена наличием в белке пептидных связей, которые в щелочной среде образуют с сернокислой медью комплексы фиолетового цвета с красным или синим оттенком. Группа, образующая пептидную связь, в щелочной среде присутствует в своей таутомерной енольной форме:
При избытке щелочи происходит диссоциация ОН-группы, появляется отрицательный заряд, с помощью которого кислород взаимодействует с медью. Возникает солеобразная связь. Кроме того, медь образует дополнительные координационные связи с атомами азота, участвующими в пептидной связи, путем использования их электронных пар. Возникающий таким образом комплекс очень стабилен. Интенсивность окраски комплекса зависит от концентрации белка и количества медной соли в растворе.
Биуретовой реакцией обнаруживаются все без исключения белки, а также продукты их неполного гидролиза – пептоны и полипептиды. Для ди — и трипептидов биуретовая реакция ненадежна. Оттенок зависит от длины полипептидной цепочки. Пептоны при этой реакции дают розовое или красное окрашивание. Биуретовая реакция положительна и с веществами небелкового характера, имеющими в составе не менее двух – CO – NH2-групп, к ним относятся, например, оксамид – NH2 – CO – CO – NH2, биурет – N2H – CO – NH – CO – NH2.
Исследуемый материал: раствор яичного белка, раствор растительного белка, 1% раствор желатина.
Реактивы: 10% раствор NaOH, 1% раствор CuSO4.
Оборудование: пробирки, капельницы.
Ход работы. К 5 каплям водного раствора белка добавляют 5 капель 10% раствора NaOH и 2 капли 1% раствора CuSO4. Содержимое перемешивают. Оно приобретает сине-фиолетовый цвет. Нельзя добавлять избыток CuSO4, так как синий осадок маскирует характерное фиолетовое окрашивание биуретового комплекса.
Работа 2. Нингидриновая реакция на α-аминокислоты
Белки, полипептиды и свободные α-аминокислоты дают синее или фиолетовое окрашивание с нингидрином. При нагревании белка с водным раствором нингидрина аминокислоты окисляются и распадаются, образуя СО2, NH3 и соответствующий альдегид. Нингидрин, являясь сильным окислителем, вызывает окислительное дезаминирование α-аминокислоты, приводящее к образованию аммиака, двуокиси углерода, соответствующего альдегида и восстановленной формы нингидрина. Нингидрин восстанавливается и связывается со второй молекулой нингидрина посредством молекулы аммиака, образуя продукты конденсации, окрашенные в синий, фиолетовый, красный, а в случае пролина – в желтый цвет.
📹 Видео
Опыты по химии. Цветные реакции белка: биуретовая; ксантопротеиноваяСкачать

Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Реакция железа с азотной кислотойСкачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Синтез АЗОТНОЙ КИСЛОТЫ. Реакция НИТРАТА КАЛИЯ и КОНЦЕНТРИРОВАННОЙ СЕРНОЙ КИСЛОТЫ.Опыты по химии домаСкачать

Ксантопротеиновая реакция на белкиСкачать