- История химии в школьном курсе
- Ксантопротеиновая реакция на белок: признаки и формула уравнения
- Что такое белок
- Структура протеинов
- Аминокислоты
- Что означает ксантопротеиновая реакция
- Какие определяются аминокислоты
- Какие используют реактивы
- Методика проведения
- Особенности проведения
- Сравнительная реакция с фенолом
- Сравнительная проба с желатином
- Химические уравнения
- Результаты
- Лабораторная работа №1
- 📸 Видео
История химии в школьном курсе
РЕАКЦИЯ ПИОТРОВСКОГО (БИУРЕТОВАЯ РЕАКЦИЯ)
В белках аминокислоты связаны друг с другом по типу полипептидов и дикетопиперазинов. Образование полипептидов из аминокислот происходит путем отщепления молекулы воды от аминогруппы одной молекулы аминокислоты и карбоксильной группы другой молекулы:
Образующаяся группа –С(О)–NН– называется пептидной группой, связь С–N, соединяющая остатки млекул аминокислот, – пептидной связью.
При взаимодействии дипептида с новой молекулой аминокислоты получается трипептид и т. д.
Дикетопиперазины образуются при взаимодействии двух молекул аминокислот с отщеплением двух молекул воды:
Дикетопиперазины были выделены из белков Н.Д.Зелинским и В.С.Садиковым в 1923 г.
Наличие в белке повторяющихся пептидных групп подтверждается тем, что белки дают фиолетовое окрашивание при действии небольшого количества раствора медного купороса в присутствии щелочи (биуретовая реакция).
Описание опыта. 2–3 мл раствора белка нагревают с 2–3 мл 20%-го раствора едкого кали или натра и несколькими каплями раствора медного купороса. Появляется фиолетовое окрашивание вследствие образования комплексных соединений меди с белками.
- РЕАКЦИЯ РУЭМАННА (НИНГИДРИНОВАЯ РЕАКЦИЯ (1911))
a -Аминокислоты реагируют с нингидрином, образуя сине-фиолетовый комплекс (пурпур Руэманна), интенсивность окраски которого пропорциональна количеству аминокислоты.
Реакция идет по схеме:
Реакция с нингидрином используется для визуального обнаружения a -аминокислот на хроматограммах (на бумаге, в тонком слое), а также для колориметрического определения концентрации аминокислот по интенсивности окраски продукта реакции.
Описание опыта. В пробирку наливают 1 мл 1%-го раствора глицина и 0,5 мл 1%-го раствора нингидрина. Содержимое пробирки осторожно нагревают до появления сине-фиолетового окрашивания.
- Реакция Сакагучи
Эта реакция на аминокислоту аргинин основана на взаимодействии аргинина с a -нафтолом в присутствии окислителя. Ее механизм еще полностью не выяснен. По-видимому, реакция осуществляется по следующему уравнению:
Поскольку производные хинониминов (в данном случае нафтохинона), у которых водород иминогруппы –NH– замещен на алкильный или арильный радикал, всегда окрашены в желто-красные тона, то, по-видимому, оранжево-красный цвет раствора при проведении реакции Сакагучи объясняется возникновением именно производного нафтохинонимина. Не исключена, однако, вероятность образования еще более сложного соединения за счет дальнейшего окисления оставшихся NH-групп аргининового остатка и бензольного ядра a -нафтола:
Описание опыта. В пробирку наливают 2 мл 0,01%-го раствора аргинина, затем добавляют 2 мл 10%-го раствора едкого натра и несколько капель 0,2% спиртового раствора a -нафтола. Содержимое пробирки хорошо перемешивают, приливают 0,5 мл раствора гипобромита и вновь перемешивают. Немедленно добавляют 1 мл 40%-го раствора мочевины для стабилизации быстро развивающегося оранжево-красного окрашивания.
- РЕАКЦИЯ ФОЛЯ
Это реакция на цистеин и цистин. При щелочном гидролизе «слабосвязанная сера» в цистеине и цистине достаточно легко отщепляется, в результате чего образуется сероводород, который, реагируя со щелочью, дает сульфиды натрия или калия. При добавлении ацетата свинца(II) образуется осадок сульфида свинца(II) серо-черного цвета.
Описание опыта. В пробирку наливают 1 мл раствора цистина, прибавляют 0,5 мл 20%-го раствора гидроксида натрия. Смесь нагревают до кипения, а затем добавляют 0,5 мл раствора ацетата свинца(II). Наблюдается выпадение серо-черного осадка сульфида свинца(II):
- РЕАКЦИЯ С ФОРМАЛЬДЕГИДОМ
При взаимодействии a -аминокислот с формальдегидом образуются относительно устойчивые карбиноламины – N-метилольные производные, содержащие свободную карбоксильную группу, которую затем титруют щелочью:
Эта реакция лежит в основе количественного определения a -аминокислот методом формального титрования (метод Сёренсена).
Описание опыта. В пробирку наливают 5 капель 1%-го раствора глицина и прибавляют 1 каплю индикатора метилового красного. Раствор окрашивается в желтый цвет (нейтральная среда). К полученной смеси добавляют равный объем 40%-го раствора формальдегида (формалин). Появляется красное окрашивание (кислая среда):
- РЕАКЦИЯ Циммермана
Это реакция на аминокислоту глицин.
Описание опыта. К 2 мл 0,1%-го раствора глицина, доведенного добавлением 10%-го раствора щелочи до рН = 8, приливают 0,5 мл водного раствора о-фталевого диальдегида. Реакционная смесь начинает медленно окрашиваться в ярко-зеленый цвет. Через несколько минут выпадает зеленый осадок.
- ОБРАЗОВАНИЕ КОМПЛЕКСОВ С МЕТАЛЛАМИ
a -Аминокислоты образуют с катионами тяжелых металлов внутрикомплексные соли. Со свежеприготовленным гидроксидом меди(II) все a -аминокислоты в мягких условиях дают хорошо кристаллизующиеся внутрикомплексные (хелатные) соли меди(II) синего цвета:
В таких солях ион меди координационными связями соединен с аминогруппами.
Описание опыта. В пробирку наливают 3 мл 3%-го раствора сульфата меди(II), добавляют несколько капель 10%-го раствора гидроксида натрия до образования голубого осадка. К полученному осадку гидроксида меди(II) приливают 0,5 мл концентрированного раствора глицина. При этом образуется темно-синий раствор глицината меди:
- КСАНТОПРОТЕИНОВАЯ РЕАКЦИЯ
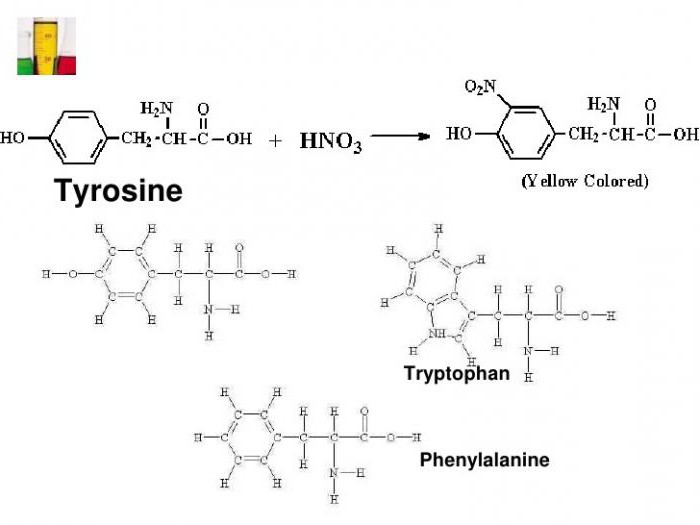
Эта реакция используется для обнаружения a -аминокислот, содержащих ароматические радикалы. Тирозин, триптофан, фенилаланин при взаимодействии с концентрированной азотной кислотой образуют нитропроизводные, имеющие желтую окраску. В щелочной среде нитропроизводные этих a -аминокислот дают соли, окрашенные в оранжевый цвет.
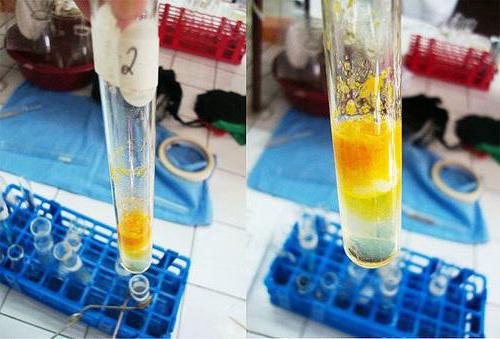
Описание опыта. В пробирку наливают 1 мл раствора тирозина и добавляют 0,5 мл концентрированной азотной кислоты. Смесь нагревают до появления желтой окраски. После охлаждения добавляют 1–2 мл 20%-го раствора гидроксида натрия до появления оранжевой окраски раствора:
- ОСАЖДЕНИЕ БЕЛКА СОЛЯМИ ТЯЖеЛЫХ МЕТАЛЛОВ
Описание опыта. В две пробирки наливают по 1–2 мл раствора белка и медленно, при встряхивании, добавляют по каплям в одну пробирку насыщенный раствор сульфата меди, а в другую – 20%-й раствор ацетата свинца. Образуются осадки труднорастворимых солеобразных соединений белка. Опыт иллюстрирует применение белка как противоядия при отравлении солями тяжелых металлов.
- Открытие аминного азота в белках
Описание опыта. В сухую пробирку помещают немного сухого белка, например желатины. Прибавляют пятикратное количество натронной извести (смесь едкого натра и гидроксида кальция), перемешивают встряхиванием и подогревают. Выделяется аммиак, вызывающий посинение розовой лакмусовой бумажки, смоченной водой. Одновременно ощущается запах жженого волоса, что всегда наблюдается при сжигании белковых веществ.
- Открытие серы в белках
Описание опыта. В пробирку наливают около
0,5 мл раствора уксуснокислого свинца и прибавляют раствор едкого кали до растворения образовавшегося осадка гидроксида свинца. В другую пробирку наливают
2–3 мл раствора белка и приливают такой же объем полученного раствора плюмбита. Нагревают смесь до кипения в течение 2–3 мин. Появление темного окрашивания указывает на образование сульфида свинца.
- РЕАКЦИЯ НА ПРИСУТСТВИЕ СЕРОСОДЕРЖАЩИХ a -АМИНОКИСЛОТ В БЕЛКЕ
Качественной реакцией на серосодержащие a -аминокислоты является реакция Фоля. Белки, содержащие остатки цистеина или цистина, также дают эту реакцию.
Описание опыта. В пробирку наливают 10 капель раствора яичного белка и вдвое больший объем 20%-го раствора гидроксида натрия. Содержимое пробирки нагревают до кипения (1–2 мин). К полученному щелочному раствору добавляют 5 капель раствора ацетата свинца(II) и вновь кипятят реакционную смесь. Наблюдается появление серо-черного осадка.
- РЕАКЦИЯ НА ТРИПТОФАН
Триптофан, реагируя в кислой среде с альдегидами, образует окрашенные продукты конденсации. Например, с глиоксиловой кислотой (являющейся примесью к концентрированной уксусной кислоте) реакция протекает по уравнению:
По аналогичной схеме протекает и реакция триптофана с формальдегидом.
В ходе проведенного исследования мы выявили по литературным источникам имеющуюся информацию о цветных качественных реакциях на белковые аминокислоты; выполнили ряд перечисленных реакций и составили базу данных. Эта база может быть использована в школьной практике как в теоретическом плане, так и в практическом, т. к. мы приводим краткие, но подробные описания выполнения всех опытов.
Из предложенных 18 качественных реакций каждая практически осуществима в школьном курсе химии и имеет важное практическое значение. Сопровождение реакций химическими уравнениями конкретизирует и углубляет знания по биологической и органической химии, особенно знания учащихся специализированных биологических и химических классов.
Использованная литература
Ермаков А.Н., Арасимович В.В., Смирнова-Иконникова М.И., Мирри И.К. Методы биохимического исследования растений. М.,1952, 520 с.
Полянская А.С., Шевелева А.О. Методическая разработка по лабораторным работам: «Аминокислоты» и «Белки». Л., 1976, 37 с.
Пустовалова Л.М. Практикум по биохимии. 1999, 541 с.
Руководство к практическим занятиям по органической химии. Под ред. В.М.Родионова. М., 1954, 111 с.
Соловьев Н.А. Лабораторные работы по биологической химии. Методическая разработка. СПб., 1996, 70 с.
Филиппович Ю.Б., Егорова Т.А., Севастьянова Г.А. Практикум по общей биохимии. М., 1982, 311 с.
З.Саитов, С.В.Телешов, Б.Харитонцев,
секция «Юный химик» РХО им. Д.И.Менделеева (г. Тобольск)
Видео:Ксантопротеиновая реакция на белкиСкачать

Ксантопротеиновая реакция на белок: признаки и формула уравнения
Для установления качественного состава многих продуктов питания используется ксантопротеиновая реакция на белок. Наличие ароматических аминокислот в соединении даст положительное изменение цвета исследуемого образца.
Видео:Опыты по химии. Цветные реакции белка: биуретовая; ксантопротеиноваяСкачать

Что такое белок
Его еще называют протеином, являющимся строительным материалом для живого организма. Белки поддерживают объем мышц, восстанавливают травмированные и отмершие тканевые структуры различных органов, будь то волосы, кожные покровы или связки. При их участии производятся красные тельца крови, регулируется нормальная работа многих гормонов и клеток иммунной системы.
Это сложная молекула, представляющая собой полипептид с массой больше 6*10 3 дальтон. Белковую структуру образуют остатки аминокислотные в большом количестве, соединенные пептидной связью.
Видео:Ксантопротеиновая реакцияСкачать

Структура протеинов
Отличительной чертой данных веществ по сравнению с низкомолекулярными пептидами является их развитое пространственное трехмерное строение, поддерживаемое влияниями с разной степенью притяжения. Белки обладают четырехуровневой структурой. Для каждого из них присущи свои характеристики.
За основу первичной организации их молекул взята аминокислотная последовательность, строение которых распознает ксантопротеиновая реакция на белок. Такая структура представляет собой периодически повторяющуюся пептидную связь -HN-CH-CO-, а избирательной частью являются радикалы боковой цепочки в аминокарбоновых кислотах. Именно они определяют в дальнейшем свойства вещества в целом.
Первичную белковую структуру считают достаточно прочной, это обусловлено наличием сильных ковалентных взаимодействий в пептидных связях. Образование последующих уровней происходит в зависимости от признаков, установленных на начальном этапе.
Формирование вторичной структуры возможно благодаря скручиванию аминокислотной последовательности в спираль, в которой между витками устанавливаются водородные связи.
Третичный уровень организации молекулы образуется при наложении одной части спирали на другие фрагменты с возникновением между ними всевозможных связей, с водородным, дисульфидным, ковалентным или ионным соединением. В результате получаются ассоциации в виде глобул.
Пространственное расположение третичных структур с образованием химических связей между ними приводит к формированию конечного вида молекулы или четвертичному уровню.
Видео:Биуретовая реакцияСкачать

Аминокислоты
Именно они обуславливают химические свойства белков. Насчитывают около 20 главных аминокислот, входящих в состав полипептидов в разной последовательности. Сюда также причисляют редкие аминокарбоновые кислоты в виде гидроксипролина и гидроксилизина, являющиеся производными основных пептидов.
Как признак ксантопротеиновой реакции распознавания белков, присутствие отдельных аминокислот дает изменение окраски реактивов, что позволяет предполагать о наличии специфических структур в их составе.
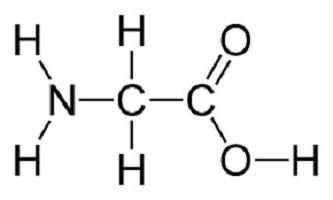
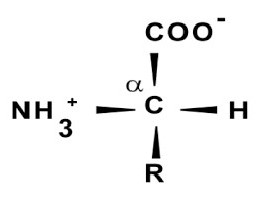
Как оказалось, все они представляют собой карбоновые кислоты, у которых произошло замещение атома водорода на аминогруппу.
Примером строения молекулы может служить структурная формула глицина (HNH− HCH− COOH) как простейшей аминокислоты.
В данном случае один из водородов CH2— углерода может быть заменен более длинным радикалом, включающим бензольное кольцо, амино-, сульфо-, карбоксигруппы.
Видео:Реакция Фоля на цистеин и цистинСкачать

Что означает ксантопротеиновая реакция
Для проведения качественного анализа протеинов используют различные методики. К ним относят реакции:
- биуретовую с появлением фиолетового окрашивания;
- нингидриновую с образованием сине-фиолетового раствора;
- формальдегидную с установлением красного окрашивания;
- Фоля с выпадением осадка серо-черного цвета.
При проведении каждого метода доказывается присутствие протеинов и наличие определенной функциональной группы в их молекуле.
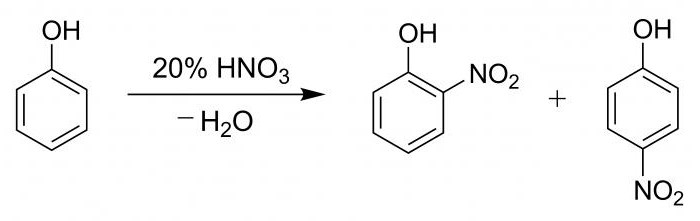
Существует ксантопротеиновая реакция на белок. Ее называют еще пробой Мульдера. Относится она к цветным реакциям на протеины, в которых присутствуют ароматические и гетероциклические аминокислоты.
Особенностью такой пробы является процесс нитрования кислотой азотной циклических аминокислотных остатков, в частности присоединение нитрогруппы к бензольному кольцу.
Результатом такого процесса является образование нитросоединения, которое осаждается. Это основной признак ксантопротеиновой реакции.
Видео:Биуретовая реакция белковСкачать

Какие определяются аминокислоты
Не все аминокарбоновые кислоты можно выявить с помощью такой пробы. Основной признак ксантопротеиновой реакции распознавания белков — наличие бензольного кольца или гетероцикла в составе молекулы аминокислоты.
Из протеиновых аминокарбоновых кислот выделяют две ароматические, в которых имеется фенильная группа (у фенилаланина) и гидроксифенильный радикал (у тирозина).
С помощью ксантопротеиновой реакции определяют гетероциклическую аминокислоту триптофан, имеющую ароматическое индольное ядро. Наличие вышеуказанных соединений в белке дает характерное изменение окраски испытуемой среды.
Видео:Качественные реакции на белкиСкачать

Какие используют реактивы
Для проведения ксантопротеиновой реакции потребуется приготовить 1%-й раствор протеина яичного или растительного происхождения.
Обычно используют куриное яйцо, которое разбивают для дальнейшего отделения белка от желтка. Для получения раствора 1%-й протеин разводят в десятикратном количестве очищенной воды. После растворения белка полученную жидкость необходимо отфильтровать через несколько слоев марли. Такой раствор следует хранить в холодном месте.
Можно проводить реакцию с растительным белком. Для приготовления раствора используют муку пшеничную в количестве 0,04 кг. Добавляют 0,16 л очищенной воды. Ингредиенты смешивают в колбе, которую ставят на 24 часа в холодное место с температурой около +1°С. По истечении суток раствор взбалтывают, после чего проводят его фильтрацию сначала с помощью ваты, а затем − бумажного складчатого фильтра. Полученную жидкость держат в холодном месте. В таком растворе присутствует в основном альбуминовая фракция.
Для проведения ксантопротеиновой реакции в качестве основного реактива используют азотную кислоту концентрированную. Дополнительными реагентами является раствор 10%-го гидроксида натрия или аммиака, желатиновый раствор и неконцентрированный фенол.
Видео:10 класс Качественные реакции на белкиСкачать

Методика проведения
В чистую пробирку вносят 1%-й раствор белка яйца или муки в количестве 2 мл. К нему прибавляют около 9 капель кислоты азотной концентрированной, чтобы прекратилось выпадение хлопьев. Полученную смесь нагревают, в результате осадок желтеет и постепенно исчезает, а его цвет переходит в раствор.
Когда жидкость остынет, в пробирку по стеночке добавляют около 9 капель натрия гидроксида концентрированного, что является избытком для процесса. Реакция среды становится щелочной. Содержимое в пробирке приобретает оранжевую окраску.
Видео:Видеоурок: Практическая работа № 4. Цветные реакции на белкиСкачать

Особенности проведения
Так как ксантопротеиновой называют качественную реакцию на белки под действием азотной кислоты, то пробу проводят под включенным вытяжным шкафом. Соблюдают все меры безопасности при работе с концентрированными едкими веществами.
В процессе нагревания может происходить выброс содержимого из пробирки, что следует учитывать при закреплении ее в держателе и выборе наклона.
Набирать концентрированную азотную кислоту и едкий натрий следует только с помощью стеклянной пипетки и груши резиновой, запрещается набирать ртом.
Видео:Денатурация БЕЛКА. Реакция со СПИРТОМ и АЦЕТОНОМ. Реакции с белком. Опыты по химии дома.Скачать

Сравнительная реакция с фенолом
Для наглядности процесса и подтверждения наличия фенильной группы проводят подобную пробу с гидроксибензолом.
В пробирку вносят 2 мл фенола разведенного, затем постепенно, по стеночке, добавляют 2 мл кислоты азотной концентрированной. Раствор подвергают нагреванию, в результате чего он становится желтым. Данная реакция является качественной на присутствие бензольного кольца.
Процесс нитрования гидроксибензола азотной кислотой сопровождается образованием смеси из паранитрофенола и ортонитрофенола в процентном соотношении 15 к 35.
Видео:НШ | Химия. Химические свойства белков и качественные реакции на белкиСкачать

Сравнительная проба с желатином
Чтобы доказать, что ксантопротеиновая реакция на белок выявляет аминокислоты только с ароматическим строением, используют протеины, не имеющие фенольной группы.
В чистую пробирку вносят 1%-й желатиновый раствор в количестве 2 мл. К нему прибавляют около 9 капель кислоты азотной концентрированной. Полученную смесь нагревают. Раствор не окрашивается в желтый цвет, что доказывает отсутствие аминокислот с ароматической структурой. Иногда наблюдается незначительное пожелтение среды, связанное с наличием протеиновых примесей.
Видео:Качественные реакции на белки в сравнении с реакциями на аминокислоты. Химический опытСкачать

Химические уравнения
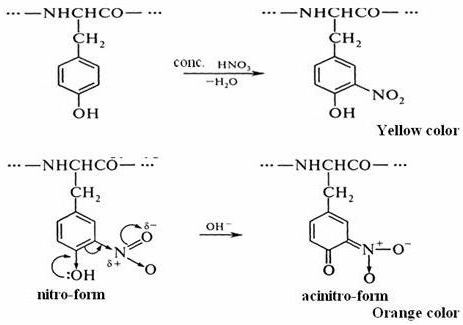
В две стадии проходит ксантопротеиновая реакция на белки. Формула первого этапа описывает процесс нитрования аминокислотной молекулы с помощью кислоты азотной концентрированной.
Примером может служить присоединение нитрогруппы к тирозину с образованием нитротирозина и динитротирозина. В первом случае к бензольному кольцу прикрепляется один NO2-радикал, а во втором соединении уже два атома водорода замещается на NO2. Химическая формула ксантопротеиновой реакции представлена взаимодействием тирозина с азотной кислотой с образованием молекулы нитротирозина.
Процесс нитрования сопровождается переходом бесцветной окраски в желтый тон. При проведении подобной реакции с белками, содержащими аминокислотные остатки триптофана или фенилаланина, цвет раствора также изменяется.
На втором этапе происходит взаимодействие продуктов нитрования молекулы тирозина, в частности нитротирозина, с аммония или натрия гидроксидом. В результате получается натриевая или аммонийная соль, у которых цвет желто-оранжевый. Такая реакция связана с возможностью молекулы нитротирозина переходить в хиноидную форму. В дальнейшем из нее образуется соль нитроновой кислоты, у которой имеется хиноновая система из двойных сопряженных связей.
Так заканчивается ксантопротеиновая реакция на белки. Уравнение второй стадии представлено выше.
Видео:Денатурация белка в спиртеСкачать

Результаты
В процессе анализа жидкостей, содержащихся в трех пробирках, раствором сравнения служит разбавленный фенол. Вещества с бензольным кольцом дают качественную реакцию с кислотой азотной. В результате изменяется окраска раствора.
Как известно, желатин включает коллаген в гидролизованной форме. Данный белок не содержит аминокарбоновых кислот ароматического строения. При взаимодействии с кислотой не происходит изменения окраски среды.
В третьей пробирке наблюдается положительная ксантопротеиновая реакция на белки. Вывод можно сделать следующий: все протеины с ароматической структурой, будь то фенильная группа или индольное кольцо, дают изменение цвета раствора. Это связано с образованием нитросоединений с желтой окраской.
Проведение цветной реакции доказывает наличие разнообразной химической структуры в аминокислотах и белках. Пример с желатином показывает, что в его составе присутствуют аминокарбоновые кислоты, не имеющие фенильной группы или циклического строения.
С помощью ксантопротеиновой реакции можно объяснить пожелтение кожи при нанесении на нее сильной азотной кислоты. Такой же цвет приобретет молочная пенка при проведении с ней подобного анализа.
В медицинской лабораторной практике данную цветную пробу не используют для обнаружения белка в моче. Это связано с желтой окраской самой мочи.
Ксантопротеиновая реакция стала все чаще использоваться для количественного подсчета таких аминокислот, как триптофан и тирозин, в составе различных белков.
Видео:Реакция белка на спирт Reaction of alcohol on the proteinСкачать

Лабораторная работа №1
Лабораторная работа №1
ХИМИЯ ПРОСТЫХ БЕЛКОВ.
ЦВЕТНЫЕ РЕАКЦИИ НА БЕЛКИ И АМИНОКИСЛОТЫ
Белки представляют собой высокомолекулярные полимерные органические соединения, построенные из остатков различных α-аминокислот, соединенных ковалентной пептидной связью.
Присутствие белка в растворах можно обнаружить с помощью цветных реакций, обусловленных наличием в белке аминокислот, их специфических групп и пептидных связей. Существуют универсальные цветные реакции, т. е. на все белки (биуретовая и нингидриновая), и специфические, т. е. на определенные аминокислоты (ксантопротеиновая, Миллона, Фоля и др.).
На основании некоторых цветных реакций разработаны методы количественного определения белков и аминокислот, которые широко используются в биохимических лабораториях.
Цель: Ознакомиться с универсальными цветными реакциями на белки и специфическими реакциями на отдельные аминокислоты, содержащиеся в белковых растворах.
Работа 1. Биуретовая реакция на пептидную связь (Пиотровского)
Биуретовая реакция обусловлена наличием в белке пептидных связей, которые в щелочной среде образуют с сернокислой медью комплексы фиолетового цвета с красным или синим оттенком. Группа, образующая пептидную связь, в щелочной среде присутствует в своей таутомерной енольной форме:
При избытке щелочи происходит диссоциация ОН-группы, появляется отрицательный заряд, с помощью которого кислород взаимодействует с медью. Возникает солеобразная связь. Кроме того, медь образует дополнительные координационные связи с атомами азота, участвующими в пептидной связи, путем использования их электронных пар. Возникающий таким образом комплекс очень стабилен. Интенсивность окраски комплекса зависит от концентрации белка и количества медной соли в растворе.
Биуретовой реакцией обнаруживаются все без исключения белки, а также продукты их неполного гидролиза – пептоны и полипептиды. Для ди — и трипептидов биуретовая реакция ненадежна. Оттенок зависит от длины полипептидной цепочки. Пептоны при этой реакции дают розовое или красное окрашивание. Биуретовая реакция положительна и с веществами небелкового характера, имеющими в составе не менее двух – CO – NH2-групп, к ним относятся, например, оксамид – NH2 – CO – CO – NH2, биурет – N2H – CO – NH – CO – NH2.
Исследуемый материал: раствор яичного белка, раствор растительного белка, 1% раствор желатина.
Реактивы: 10% раствор NaOH, 1% раствор CuSO4.
Оборудование: пробирки, капельницы.
Ход работы. К 5 каплям водного раствора белка добавляют 5 капель 10% раствора NaOH и 2 капли 1% раствора CuSO4. Содержимое перемешивают. Оно приобретает сине-фиолетовый цвет. Нельзя добавлять избыток CuSO4, так как синий осадок маскирует характерное фиолетовое окрашивание биуретового комплекса.
Работа 2. Нингидриновая реакция на α-аминокислоты
Белки, полипептиды и свободные α-аминокислоты дают синее или фиолетовое окрашивание с нингидрином. При нагревании белка с водным раствором нингидрина аминокислоты окисляются и распадаются, образуя СО2, NH3 и соответствующий альдегид. Нингидрин, являясь сильным окислителем, вызывает окислительное дезаминирование α-аминокислоты, приводящее к образованию аммиака, двуокиси углерода, соответствующего альдегида и восстановленной формы нингидрина. Нингидрин восстанавливается и связывается со второй молекулой нингидрина посредством молекулы аммиака, образуя продукты конденсации, окрашенные в синий, фиолетовый, красный, а в случае пролина – в желтый цвет.
📸 Видео
Химические свойства белков | Химия ЕГЭ 10 класс | УмскулСкачать

Реакция ФоляСкачать

Уравнивание реакций горения углеводородовСкачать

Качественная реакция на белкиСкачать

Нингидриновая реакцияСкачать