Кроссворд создан с помощью «Генератора кроссвордов онлайн»
Кроссворд по предмету «химия» на тему «Скорость химической реакции»
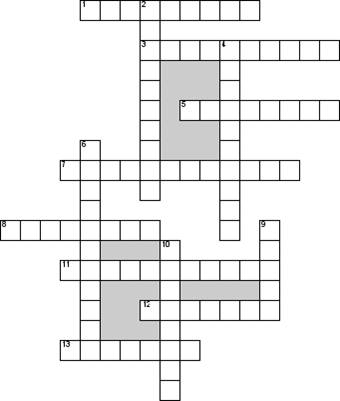
1. Процесс получения минимального избытка энергии частицами вещества в реакции для начала эффективного соударения
3. Катализ, при котором катализатор и реагирующие вещества находятся в одном агрегатном состоянии
5. Изменение концентрации одного из веществ реакции в единицу времени в неизменном объеме или количества вещества в единицу времени на единицу поверхности
7. Катализ, при котором катализатор и реагирующие вещества находятся в разных агрегатных состояниях
8. Биологические катализаторы
11. Вещество, ускоряющее химическую реакцию, но само при этом не расходующееся
12. Автор основного закона химической кинетики
13. Изменение скорости химической реакции или ее направление с помощью катализатора
2. Вещества, замедляющие химические реакции
4. Реакция, происходящая в однородной среде при взаимодействии реагирующих веществ в полном объеме
6. Фактор, оказывающий влияние на скорость реакции
9. Химическая реакция, протекающая с мгновенной скоростью
10. Наука о закономерностях протекания химических реакций во времени
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Расчеты по химическим уравнением
Разделы: Химия
Чему бы ты ни учился, ты
учишься для себя.
Петроний
Цели урока:
- познакомить учащихся с основными способами решения задач по химическим уравнениям:
- находить количество, массу и объём продуктов реакции по количеству, массе или объёму исходных веществ,
- продолжить формирование навыков работы с текстом задачи, умение аргументировано выбирать способ решения учебной задачи, умения составлять уравнения химических реакций.
- развивать умения анализировать, сравнивать, выделять главное, составлять план действия, делать выводы.
- воспитывать терпимость к другим, самостоятельность в принятии решений, умение объективно оценить результаты своего труда.
Формы работы: фронтальная, индивидуальная, парная, групповая.
Тип урока: комбинированный с применением ИКТ
Ход и содержание урока
I Организационный момент.
Здравствуйте ребята. Сегодня, мы с вами научимся решать задачи по уравнениям химических реакций. Слайд 1 (cм. презентацию).
Цели урока Слайд 2.
II.Актуализация знаний, умений, навыков.
Химия очень интересная и в то же время сложная наука. Для того чтобы знать и понимать химию, надо не только усваивать материал, но и уметь применять полученные знания. Вы узнали какие признаки указывают на протекание химических реакций, научились составлять уравнения химических реакций. Я надеюсь, что вы хорошо усвоили эти темы и без труда ответите на мои вопросы
Какое явление не является признаком химических превращений:
а) появление осадка; в) изменение объема;
а) уравнения реакций соединения
б) уравнения реакций замещения
в) уравнения реакций разложения Слайд 4
- Новая тема.
Для того, чтобы научиться решать задачи, необходимо составить алгоритм действий, т.е. определить последовательность действий.
Алгоритм для расчета по химическим уравнениям (у каждого учащегося на столе)
Для того, чтобы решить расчетную задачу по химии, можно воспользоваться следующим алгоритмом – сделать пять шагов:
1. Составить уравнение химической реакции.
2. Над формулами веществ записать известные и неизвестные величины с соответствующими единицами измерения (только для чистых веществ, без примесей). Если по условию задачи в реакцию вступают вещества, содержащие примеси, то сначала нужно определить содержание чистого вещества.
3. Под формулами веществ с известными и неизвестными записать соответствующие значения этих величин, найденные по уравнению реакций.
4. Составить и решить пропорцию.
5. Записать ответ.
Приступаем к решению задач, применяя алгоритм
Вычисление массы вещества по известной массе другого вещества, участвующего в реакции
Вычислите массу кислорода, выделившегося в результате разложения
порции воды массой 9 г.
Найдем молярную массу воды и кислорода:
Запишем уравнение химической реакции:
Над формулой в уравнении реакции запишем найденное
значение количества вещества, а под формулами веществ —
стехиометрические соотношения, отображаемые
Вычислим количество вещества, массу которого требуется найти.
Для этого составляем пропорцию
откуда х = 0,25 моль Слайд 7
Следовательно, n(O2)=0,25 моль
Найдем массу вещества, которую требуется вычислить
m(O2) = 0,25 моль • 32 г/моль = 8 г
Ответ: m(О2) = 8 г Слайд 8
Вычисление объема вещества по известной массе другого вещества, участвующего в реакции
Вычислите объем кислорода (н. у.), выделившегося в результате разложения порции воды массой 9 г.
Vm=22,4л/моль Слайд 9
Запишем уравнение реакции. Расставим коэффициенты
Над формулой в уравнении реакции запишем найденное значение количества вещества, а под формулами веществ — стехиометрические соотношения, отображаемые химическим уравнением
Вычислим количество вещества, массу которого требуется найти. Для этого составим пропорцию
откуда х = 0,25 моль
Найдем объем вещества, который требуется вычислить
Ответ: 5,6 л Слайд 11
III.Закрепление изученного материала.
Задачи для самостоятельного решения:
1.При восстановлении углем оксидов Fe2O3 и SnO2 получили по 20 г Fe и Sn. Сколько граммов каждого оксида было взято?
2.В каком случае образуется больше воды:
а) при восстановлении водородом 10 г оксида меди (I) (Cu2O) или
б) при восстановлении водородом 10 г оксида меди(II) (CuO)? Слайд 12
Проверим решение задачи 1
M(Fe)=56г/моль,
m(Fe2O3)=
Проверим решение задачи 2
4.
х моль = 0,07моль,
m (H2O) = 
n(CuO) = 10г/ 80г/моль = 0,125 моль
х моль = 0,125моль, n(H2O)=0,125 моль
Ответ: 2,25г Слайд 15
Домашнее задание: изучить материал учебника с. 45-47, решить задачу
Какую массу оксида кальция и какой объм углекислого газа (н.у.)
можно получить при разложении карбоната кальция массой 250г?
CaCO3 = CaO + CO Cлайд 16.
1. Габриелян О.С. Программа курса химии для 8-11 классов общеобразовательных учреждений. М. Дрофа 2006г.
2. Габриелян О.С. Химия. 8 класс. Учебник для общеобразовательных учреждений. Дрофа. М. 2005г.
3. Горбунцова С.В. Тесты по основным разделам школьного курса хииии. 8 — 9 классы.ВАКО, Москва,2006г.
4. Горковенко М.Ю.Поурочные разработки по химии. К учебникам О.С.Габриеляна, Л.С.Гузея, В.В.Сорокина, Р.П.Суровцевой и Г.Е.Рудзитиса, Ф.Г.Фельдмана. 8 класс.ВАКО, Москва, 2004г.
5. Габриелян О.С. Химия. 8 класс: Контрольные и проверочные работы. – М.: Дрофа, 2003.
6.Радецкий А.М., Горшкова В.П. Дидактический материал по химии для 8-9 классов: Пособие для учителя. – М.: Просвещение, 2000
Расчеты по химическим уравнениям
Для того, чтобы решить расчетную задачу по химии, можно воспользоваться следующим алгоритмом – сделать пять шагов:
1. Составить уравнение химической реакции.
2. Над формулами веществ записать известные и неизвестные величины с соответствующими единицами измерения (только для чистых веществ, без примесей). Если по условию задачи в реакцию вступают вещества, содержащие примеси, то сначала нужно определить содержание чистого вещества.
3. Под формулами веществ с известными и неизвестными записать соответствующие значения этих величин, найденные по уравнению реакций.
4. Составить и решить пропорцию.
5. Записать ответ.
Соотношение некоторых физико-химических величин и их единиц
Масса (m) : г ; кг ; мг
Кол-во в-ва (n) : моль ; кмоль ; ммоль
Молярная масса (M): г/моль ; кг/кмоль ; мг/ммоль
Объём (V) : л ; м 3 /кмоль; мл
Молярный объём(Vm) : л/моль ; м 3 /кмоль; мл/ммоль
Число частиц (N): 6•1023 (число Авагадро – NA); 6•1026 ; 6•1020
Видео:Химия 8 класс: Расчеты по химическим уравнениямСкачать

Химическая реакция. Кроссворд №14
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
ПО ГОРИЗОНТАЛИ: 6. Помещение для химических опытов и исследований. 13. Вещество, водный раствор которого не проводит электрического тока. 14. Величина, выражающая относительное содержание данного вещества в растворе. 17. Комплексный ион – соединение протона с молекулой воды. 21. Атом, образующий химическую связь за счет своей неподеленной пары электронов и заполнения свободной орбиты акцептора. 22. Вещество, обладающее высокой электро- и теплопроводностью, ковкостью, блеском. 23. Полярная молекула.
ПО ВЕРТИКАЛИ: 1. Распределение вещества в жидкости и образование с ней однородной смеси. 2. Сложное вещество, которое в водном растворе диссоцирует на положительно заряженные ионы металла и отрицательно заряженные ионы кислотного остатка. 3. Отрицательный электрод. 4. Распространенный слабый электролит, степень диссоциации которого 10 -9 . 5. Распад электролита на ионы при растворении его в воде или расплавлении. 7. Сложное вещество, при диссоциации которого в водном растворе в качестве катиона отщепляются только ионы водорода. 8. Химическое взаимодействие между веществами. 9. Жидкость, получившаяся в результате растворения твердого, жидкого или газообразного вещества в жидком веществе. 10. Металл 5-й группы периодической системы. 11. Шведский химик XVIII века, который установил, что воздух состоит из кислорода и азота. 12. Отрицательно заряженный ион. 15. Составная часть атома, в которой сосредоточены его основная масса и положительный электрический заряд. 16. Положительный электрод. 18. Положительно заряженный ион. 19. Реакция обмена между некоторыми солями и водой. 20. Шведский ученый, академик, который создал теорию электролитической диссоциации.
ПО ГОРИЗОНТАЛИ: 6. Лаборатория. 13. Неэлектролит. 14. Концентрация. 17. Гидроксоний. 21. Донор. 22. Металл. 23. Диполь.
ПО ВЕРТИКАЛИ: 1. Растворение. 2. Соль. 3. Катод. 4. Вода. 5. Диссоциация. 7. Кислота. 8. Реакция. 9. Раствор. 10. Ванадий. 11. Шееле. 12. Анион. 15. Ядро. 16. Анод. 18. Катион. 19. Гидролиз. 20. Аррениус.
📸 Видео
Расчеты по уравнениям химических реакций. 1 часть. 8 класс.Скачать

Расчеты по уравнениям химических реакций. 2 часть. 8 класс.Скачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Химия ПростоСкачать

Как решать задачи по химии? Расчет по уравнениям химических реакций | TutorOnlineСкачать

8 класс.Ч.1.Решение задач по уравнению реакций.Скачать

Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Химия 8 класс (Урок№10 - Расчёты по уравнениям химических реакций.)Скачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Решение задач по уравнениям реакций, если одно из реагирующих веществ взято в избытке. 1 ч. 9 класс.Скачать

Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Габриелян О. С. 8 класс §29 "Расчёты по химическим уравнениям"Скачать

Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

8 класс. Составление уравнений химических реакций.Скачать

Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

10 класс § 5 "Расчеты по уравнениям химических реакций"Скачать

ХИМИЧЕСКИЕ УРАВНЕНИЯ | Как составлять уравнения реакций | Химия 8 классСкачать

Как уравнивать коэффициенты (химия)Скачать

Решение задач на термохимические уравнения. 8 класс.Скачать