Содержание
1 Методы очистки органических соединений и определение физико-химических констант веществ. 4
1.1 Перекристаллизация. 4
1.1.1 Перекристаллизация бензойной кислоты из воды.. 6
1.3 Экстракция. 7
1.3.1 Экстрагирование органических веществ из растворов. 7
1.3.2 Экстракция твердых веществ. 9
1.4 Определение температуры плавления. 9
1.5 Определение температуры кипения. 11
2 Определение молекулярной рефракции органических соединений. 13
2.1 Методика измерения с использованием рефрактометра Аббе. 16
3 Контрольные вопросы.. 17
3.1 Перекристаллизация. 17
3.3 Экстракция. 18
3.4 Определение температуры плавления. 18
3.5 Определение температуры кипения. 18
3.6 Определение молекулярной рефракции. 18
Список использованных источников. 19
Введение
Получение органического соединения включает в себя собственно синтез, выделение и очистку интересующего вещества, подтверждение его состава и структуры. Методики проведения синтезов изложены в методических указаниях к лабораторным занятиям по курсу органической химии; раздел «Синтезы» (4-й семестр) /1/. Первая же часть лабораторных занятий (3-й семестр) включает в себя описание основных методов выделения и очистки органических соединений, методы качественного элементного и функционального анализа. Логическим завершением первой части лабораторного практикума является задача на идентификацию органического соединения.
В конце методических указаний приводится список литературы, рекомендуемой при подготовке к выполнению лабораторных работ и их защите, и контрольные вопросы по каждой работе.
Письменный отчет по лабораторной работе должен содержать ее название, теоретическую часть, в которой раскрывается сущность метода и возможность его использования, описание проведенного эксперимента и выводы, список использованной литературы. Отчет должен быть оформлен от третьего лица множественного числа в прошедшем времени.
1 Методы очистки органических соединений
и определение физико-химических констант веществ
Продукты реакции, выделенные из реакционной массы, обычно содержат примеси и называются сырыми продуктами. В качестве примесей в них могут быть растворители, исходные вещества, побочные продукты, возникающие в ходе синтеза. Сырые продукты, как правило, подвергаются очистке. Методы очистки зависят от физических и химических свойств веществ, подвергаемых разделению. Одним из методов очистки твердых веществ является перекристаллизация.
Перекристаллизация
Перекристаллизация – один из наиболее широко употребляемых методов разделения смеси твердых веществ и их очистки. Он основан на выделении избытка растворенного вещества при охлаждении насыщенного при повышенной температуре раствора (рисунок 1). Если приготовить насыщенный раствор вещества при температуре t2, а затем охладить его до температуры t1, то из насыщенного он становится пересыщенным, что заставляет выкристаллизоваться Dm = (m2 – m1) граммов вещества. По отношению же к примесям (загрязнениям) раствор при любой температуре остается ненасыщенным, и они остаются в растворе.
Из анализа рисунка 1 можно сделать вывод о требованиях, предъявляемых к растворителю при перекристаллизации:
1) чем сильнее зависимость растворимости вещества в данном растворителе от температуры, тем большее его количество удается перекристаллизовать, т.е. растворитель должен как можно меньше растворять вещество при низкой температуре t1 и как можно больше при высокой температуре t2;
2) чем меньше растворимость вещества при низкой температуре (t1), тем меньше потери основного вещества (mп – масса вещества, остающегося в растворе;
3) растворитель не должен реагировать с перекристаллизовываемым веществом;
4) для перекристаллизации необходимо брать минимальное количество растворителя; при необходимости раствор можно концентрировать (упарить часть растворителя).
Если не удается подобрать индивидуальный растворитель, удовлетворяющий перечисленным выше условиям, можно взять их бинарные смеси, например, растворителя и не растворителя (осадителя). Растворители (или их смеси), рекомендуемые для перекристаллизации конкретных веществ и даже отдельных групп (классов), обычно приводятся в справочниках (словарях) /2/ или в методической части оригинальных работ.
Dt – разница в температурах исходного и горячего растворов;
Dm – масса вещества, выделяющегося при охлаждении раствора
Рисунок 1 – Зависимость растворимости твердого вещества от температуры
Процесс перекристаллизации включает в себя:
— приготовление нагретого насыщенного раствора вещества в подходящем растворителе при максимально возможной температуре;
— фильтрование горячего раствора (отделение нерастворимых примесей);
— охлаждение раствора (выпадение кристаллов основного вещества);
— фильтрование холодного раствора (отделение кристаллов от раствора);
Общая методика процесса. Взвешенное количество неочищенного вещества помещают в круглодонную колбу и добавляют растворитель в количестве, недостаточном для полного растворения вещества. Бросив в воду «кипелки» (кусочки пористого неглазурированного фарфора), нагревают до кипения с обратным холодильником. Через холодильник малыми порциями добавляют столько растворителя, чтобы вещество полностью растворилось в кипящем растворителе, при этом могут оставаться нерастворимые примеси.
Горячий раствор фильтруют (при этом нерастворимые примеси удаляются), фильтрату дают охладиться для кристаллизации. Если кристаллизация самопроизвольно не наступила, ее вызывают трением стеклянной палочки о стенки сосуда или внесением «затравки» (кристаллика этого же или изоморфного соединения).
Кристаллы от раствора отфильтровывают, промывают их небольшим количеством холодного растворителя и сушат на воздухе или в вакуум-эксикаторе.
Перекристаллизация бензойной кислоты из воды
В плоскодонной конической колбе объемом 35-50 см 3 растворяют при нагревании 0,5 г загрязненной бензойной кислоты в 25 см 3 воды. После растворения проводят горячее фильтрование. Для этого в другую такую же колбу наливают
2-3 см 3 воды (дно колбы должно быть полностью покрыто водой), вставляют коническую воронку со складчатым фильтром и нагревают до кипения. После того, как пары воды обогреют воронку, на фильтр выливают горячий раствор кислоты. Колбу, в которой производилось растворение, дважды ополаскивают горячей водой (по 2-3 см 3 ) и полученные растворы быстро выливают на тот же фильтр. Фильтрат охлаждают. Выпавшую бензойную кислоту отфильтровывают и высушивают до постоянной массы на воздухе или в вакуум-эксикаторе. Взвешивают очищенный продукт и определяют выход (% масс.) и температуру плавления.
- ВЫДЕЛЕНИЕ И ОЧИСТКА БЕНЗОЙНОЙ КИСЛОТЫ. ОПРЕДЕЛЕНИЕ ТЕМПЕРАТУРЫ ПЛАВЛЕНИЯ
- Бензойная кислота
- Содержание
- История
- Физические свойства
- Получение
- Лабораторный синтез и очистка
- Гидролиз
- Реакция Канниццаро
- Реакция Гриньяра
- Окисление
- История получения
- Применение
- Калориметрия
- Сырьё
- Консервант
- Медицина
- Другие применения
- Биологическое действие и влияние на здоровье человека
- Бензольное кольцо
- Карбоксильная группа
- Производные
- 💥 Видео
Видео:Очистка твердого вещества методом перекристаллизацииСкачать

ВЫДЕЛЕНИЕ И ОЧИСТКА БЕНЗОЙНОЙ КИСЛОТЫ. ОПРЕДЕЛЕНИЕ ТЕМПЕРАТУРЫ ПЛАВЛЕНИЯ
- Лев Могилевский 5 лет назад Просмотров:
1 МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ ВОЛГОГРАДСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ КАФЕДРА «ОРГАНИЧЕСКАЯ ХИМИЯ» А. И. Рахимов, Л. А. Бутковская ВЫДЕЛЕНИЕ И ОЧИСТКА БЕНЗОЙНОЙ КИСЛОТЫ. ОПРЕДЕЛЕНИЕ ТЕМПЕРАТУРЫ ПЛАВЛЕНИЯ Методические указания к лабораторным работам по органической химии для студентов направления «Химическая технология и биотехнология» Волгоград 2011
2 УДК (075) Р е ц е н з е н т канд. хим. наук доцент О. Н. Кутыга Печатается по решению редакционно-издательского совета Волгоградского государственного технического университета Выделение и очистка бензойной кислоты. Определение температуры плавления : метод. указания / сост. А. И. Рахимов, Л. А. Бутковская. Волгоград : ИУНЛ ВолгГТУ, с. В методических указаниях на примере бензойной кислоты рассмотрена кристаллизация как метод очистки органических веществ от примесей, а также определение их температуры плавления. Предназначены для студентов направления «Химическая технология и биотехнология». Волгоградский государственный технический университет,
3 ВВЕДЕНИЕ Синтез органических веществ, кроме проведения самой реакции? включает этапы выделения вещества и его очистки. Кристаллические вещества, плохо растворимые в реакционной среде, обычно отделяют фильтрованием, а затем очищают их перекристаллизацией из растворителя, в котором вещество хорошо растворимо при нагревании и плохо на холоду в отличии от примесей. Цель работы: развитие практических навыков при выполнении операций выделения и очистки кристаллических органических веществ, а также при определении их температур плавления. Кристаллизацией называется процесс образования и роста кристаллов из расплава, раствора или из газовой фазы. Для очистки органического вещества путем кристаллизации его растворяют при нагревании в подходящем растворителе, прибавляя иногда адсорбент (обесцвечивающий уголь) для освобождения, если необходимо, от окрашенных примесей, фильтруют горячий раствор, охлаждают и отделяют от маточного раствора, в котором остаются примеси. Кристаллизация как метод очистки твердых веществ от примесей основывается на различии их растворимости в определенном растворителе. При выборе растворителя следует иметь в виду, что «подобное растворяет подобное». Вещества с неполярными и малополярными молекулами лучше растворяются в неполярных растворителях. Наоборот, вещества, молекулы которых полярны или построены по ионному типу, лучше растворимы в полярных растворителях располагают в порядке снижения полярности в ряд (в скобках указана температура кипения в о С) вода (100) метиловый спирт (64,7) этиловый спирт (78) ацетон (56,4) диэтиловый эфир (34,6) бензол (80,2) четыреххлористый углерод (76,5) бензин (70 90). В связи с этим кристаллические соединения перекристаллизовываются из эфира, бензина, бензола, толуола; соединения, содержащие гидроксильные группы (спирты, простейшие сахара, алифатические и ароматические оксикислоты ) из воды или спирта ; кислоты из ледяной уксусной кислоты; аминосоединения амины, аминокислоты, амиды кислот и др.) из воды или спирта и т. д. Выбранный для перекристаллизации растворитель должен либо хорошо растворять примеси, либо совсем не растворять их и не должен взаимодействовать с очищенным веществом. В отдельных случаях для перекристаллизации можно использовать смеси растворителей (например, вода спирт, вода ацетон, спирт бензол, бензол бензин и др.). Кристаллизация из смеси двух растворителей производится при температуре, лежащей ниже температуры кипения растворителей. 3
4 ОЧИСТКА БЕНЗОЙНОЙ КИСЛОТЫ Перед проведением перекристаллизации необходимо приготовить чистый стакан емкостью 100 мл, коническую воронку, стеклянную палочку с оплавленным концом. По размеру воронки подбирают складчатый фильтр. Преимущества данного фильтра по сравнению с гладким заключается в его более высокой пропускной способности за счет большей поверхности, особенно большого количества фильтрующих центров. В коническую колбочку емкостью мл помещают 1,0 г бензойной кислоты, 50 мл дистиллированной воды и нагревают смесь до начала кипения, при этом бензойная кислота полностью растворяется. Горячий раствор быстро фильтруют через маленький складчатый бумажный фильтр (рис. 1) и делят на две части. Рис. 1. Складчатый фильтр: а направления сгибов фильтра (жирные линии); б готовый фильтр, сложенный вчетверо Раствор приливают на фильтр с помощью стеклянной палочки. Фильтрование проводят, как можно быстрее: воронку заполняют почти до края раствором, который перед очередным фильтрованием вновь доводят до кипения (рис. 2). 4
5 Рис. 2 Фильтрование горячего водного раствора Если к моменту окончания фильтрования из фильтрата выпали кристаллы, то их растворяют, нагревая стакан с раствором. Затем одну часть быстро охлаждают, погружая сосуд в холодную воду или лёд; при этом бензойная кислота выпадает в виде мелких кристаллов. Другую часть горячего раствора оставляют медленно охлаждаться на воздухе (20 25 мин.); бензойная кислота выделяется в виде крупных пластинчатых кристаллов. Полученные кристаллы бензойной кислоты отфильтровывают на воронке Бюхнера (рис. 3). Рис. 3 Фильтрование на воронке Бюхнера: 1 Воронка; 2 Колба Бунзена Перед фильтрованием в воронку вставляют кружок фильтровальной бумаги, диаметр которой на 1 мм меньше диаметра дна воронки. Фильтр смачивают небольшим количеством воды и включают водоструйный насос. Жидкость с кристаллами переносят из стакана на фильтр, сливая по стеклянной палочке; при этом не следует заполнять воронку жидкостью до краев. Собранный на фильтре осадок дважды промывают холодной 5
6 дистиллированной водой и хорошо отжимают на воронке плоской стороной стеклянной пробки. После этого осадок переносят на листок фильтровальной бумаги и отжимают досуха. Перекристаллизованную и высушенную бензойную кислоту используют для определения температуры плавления. ОПРЕДЕЛЕНИЕ ТЕМПЕРАТУРЫ ПЛАВЛЕНИЯ БЕНЗОЙНОЙ КИСЛОТЫ Предварительную оценку чистоты кристаллического органического вещества достаточно часто делают по температуре его плавления. Температурой плавления соединения называют температуру, при которой его твердая фаза находится в равновесии с собственным расплавом. Разность между температурой, при которой появляется жидкая фаза, и температурой полного расплавления вещества для чистых соединений не должна превышать 0,5 1 градус. Рис. 4. Прибор для определения температуры плавления Для определения температуры плавления удобно применять прибор, состоящий из колбы с серной кислотой (рис. 4). К пришлифованному горлу колбы 1 присоединяется специальная пробирка 2, снабженная каучуковой пробкой со вставленным в нее термометром 3. На шлифованных частях пробирки и колбы имеются отверстия, которые при сборке прибора следует совместить, чтобы внутренняя часть прибора сообщалась с атмосферой. В таком приборе капилляр прикрепляется к термометру с помощью резинового кольца. Капилляр для определения температуры плавления вытягивается из чистой и сухой стеклянной рубки диаметром 5 10 мм. Капилляр должен быть тонкостенным с внутренним диаметром 0,8 1,0 мм и запаян с одного конца. 6
7 Тщательно высушенную бензойную кислоту легко растирают в ступке или на часовом стекле с помощью стеклянной палочки и помещают в капилляр. Чтобы поместить вещество на дно капилляра и утрамбовать его, капилляр бросают несколько раз через вертикально стоящую на столе трубку диаметром около 10 мм и длиной см. Плотный слой вещества в капилляре должен быть высотой около 2 3 мм. Капилляр помещают в прибор так, чтобы конец его, наполненный веществом, прилегал к середине ртутного шарика термометра. Затем прибор нагревают через сетку пламенем горелки, наблюдая за изменением вещества в капилляре. При определении температуры плавления сначала нагревание ведут со скоростью от 4 до 6 ºС в минуту. Затем, когда показания термометра достигнут величины на 10 15º ниже предполагаемой температуры плавления, скорость нагревания снижают. Нагрев регулируют так, чтобы столбик ртути в термометре поднимался со скоростью не более 1 2º в минуту. При определении температуры плавления обязательно надевать защитные очки! Появление первых капель расплавленного вещества принимают за начало плавления; необходимо также заметить температуру, при которой вещество в капилляре полностью расплавляется. Результаты определения записываются и отмечается температурный интервал плавления. Т.пл. бензойной кислоты ºС. Список рекомендуемой литературы 1. Петров А. А., Бальян Х. В., Трощенко А. Т. Органическая химия.-спб.: «Иван Фёдоров» с. 2. Практикум по органической химии. Синтез и идентификация органических соединений. / Под ред. Гинзбурга О.Ф. и Петрова А.А., М.: «Высшая школа», с. 3. Беккер Х., Домшке Г., Фангхенель Э., Фишер М. Органикум. Т. 1: пер. с нем. М,: «Мир», с. 4. Гиттис С. С., Глаз А. И., ИвановуА. В. Практикум по органической химии. М: «Высшая школа», с. 7
8 У ч е б н о е и з д а н и е Александр Имануилович Рахимов Лариса Арамовна Бутковская ВЫДЕЛЕНИЕ И ОЧИСТКА БЕНЗОЙНОЙ КИСЛОТЫ. ОПРЕДЕЛЕНИЕ ТЕМПЕРАТУРЫ ПЛАВЛЕНИЯ Методические указания к лабораторным работам по органической химии для студентов направления «Химическая технология и биотехнология» Темплан 2011 г. (учебно-методическая литература) Поз. 25. Подписано в печать г. Формат /16. Бумага офсетная. Гарнитура Times. Печать офсетная. Усл. печ. л. 0,47. Тираж 10 экз. Заказ. Волгоградский государственный технический университет , г. Волгоград, пр. Ленина, 28, корп. 1. Отпечатано в типографии ИУНЛ ВолгГТУ , г. Волгоград, пр. Ленина, 28, корп. 7. 8
Видео:Синтез БЕНЗОЙНОЙ КИСЛОТЫ из ТОЛУОЛА. Реакция ПЕРМАНГАНАТА КАЛИЯ и ТОЛУОЛА. Опыты по химии дома.Скачать

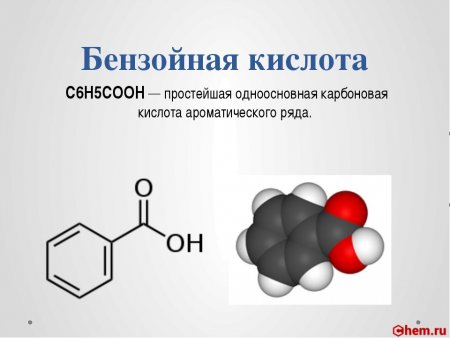
Бензойная кислота
| Бензойная кислота | |
|---|---|
 | |
| Систематическое наименование | бензойная кислота |
| Традиционные названия | бензойная кислота |
| Хим. формула | C6H5COOH |
| Рац. формула | C7H6O2 |
| Состояние | твёрдая, кисловато-горький вкус |
| Молярная масса | 122.12 г/моль |
| Плотность | 1.32 г/см³ |
| Т. плав. | 122.4 °C |
| Т. кип. | 249.2 °C |
| Т. разл. | 370 °C |
| Т. всп. | 121 °C |
| Т. свспл. | 570 °C |
| Удельная теплота испарения | 527 Дж/кг |
| Удельная теплота плавления | 18 Дж/кг |
| pKa | 4.20 |
| Растворимость в воде | 0,29 г/100 мл |
| Показатель преломления | 1,504 |
| Дипольный момент | 1.72 Д |
| ГОСТ | ГОСТ 10521-78 ГОСТ 6413-77 |
| Рег. номер CAS | 65-85-0 |
| PubChem | 243 |
| Рег. номер EINECS | 200-618-2 |
| SMILES | |
| Кодекс Алиментариус | E210 |
| RTECS | DG0875000 |
| ChEBI | 30746 |
| ChemSpider | 238 |
| Токсичность | LD50 500 mg·kg−1 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Бензойная кислота C6H5COOH — простейшая одноосновная карбоновая кислота ароматического ряда.
Видео:Получение бензойной кислоты (synthesis of benzoic acid) C6H5COOHСкачать

Содержание
- 1 История
- 2 Физические свойства
- 3 Получение
- 4 Лабораторный синтез и очистка
- 4.1 Гидролиз
- 4.2 Реакция Канниццаро
- 4.3 Реакция Гриньяра
- 4.4 Окисление
- 5 История получения
- 6 Применение
- 6.1 Калориметрия
- 6.2 Сырьё
- 6.3 Консервант
- 6.4 Медицина
- 6.5 Другие применения
- 7 Биологическое действие и влияние на здоровье человека
- 7.1 Бензольное кольцо
- 7.2 Карбоксильная группа
- 8 Производные
- 8.1 Соли
Видео:Бензойная кислотаСкачать

История
Впервые выделена возгонкой в 16 веке из бензойной смолы (росного ладана), отсюда и получила своё название. Этот процесс был описан у Нострадамуса (1556), а затем у Жироламо Рушелли (1560, под псевдонимом Alexius Pedemontanus) и у Блеза де Виженера (1596).
В 1832 году немецкий химик Юстус фон Либих определил структуру бензойной кислоты. Он также исследовал, как она связана с гиппуровой кислотой.
В 1875 немецкий физиолог Эрнст Леопольд Зальковский исследовал противогрибковые свойства бензойной кислоты, которая долгое время использовалась в консервировании фруктов.
Видео:КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать

Физические свойства
Бензойная кислота — белые кристаллы, плохо растворимые в воде, хорошо — в этаноле, хлороформе и диэтиловом эфире. Бензойная кислота является, подобно большинству других органических кислот, слабой кислотой (pKa 4,21).
Чистая кислота имеет температуру плавления 122,4 °C, температуру кипения 249 °C.
Легко возгоняется; перегоняется с водяным паром, поэтому неэффективно повышать концентрацию водных растворов бензойной кислоты упариванием раствора.
Видео:ПерекристаллизацияСкачать

Получение
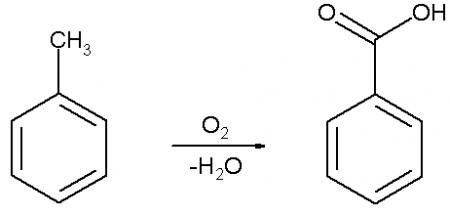
Бензойную кислоту можно получить окислением толуола сильными окислителями, такими, например, как перманганат калия, оксид хрома (VI), азотная или хромовая кислота, а также декарбоксилированием фталевой кислоты.
В промышленных масштабах бензойную кислоту получают окислением толуола кислородом на катализаторе (нафтената марганца или кобальта).
Видео:Перекристаллизация (Как очистить вещество?)Скачать

Лабораторный синтез и очистка
Химический продукт — бензойная кислота — дешёв и легкодоступен. Поэтому к лабораторному синтезу профессиональные химики прибегают редко.
Демонстрационный синтез осуществляется в учебных целях.
Очистку бензойной кислоты удобно проводить перекристаллизацией из растворителя, обычно, из воды. Другие растворители пригодные для перекристаллизации: уксусная кислота (ледяная и водный раствор), бензол, ацетон, петролейный эфир и смесь этанола с водой.
Гидролиз
Бензамид и бензонитрил гидролизуются в воде в присутствии кислоты или основания до бензойной кислоты.
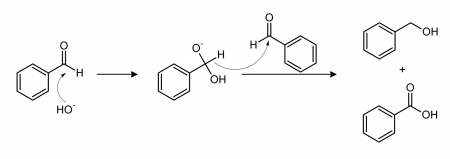
Реакция Канниццаро
Бензальдегид в основной среде претерпевает преобразование по реакции Канниццаро. В итоге получается бензойная кислота и бензиловый спирт.
Реакция Гриньяра
Из бромбензола по реакции карбоксилирования фенилмагнийбромида.
Окисление
Толуол или бензиловый спирт могут быть окислены подкисленным раствором перманганата калия до бензойной кислоты:
Видео:Возгонка бензойной кислотыСкачать

История получения
Первый производственный процесс включал в себя гидролиз бензолтрихлорида под действием гидроксида кальция в воде в присутствии железа или его солей в качестве катализатора. Образующийся бензоат кальция переводили в бензойную кислоту обработкой соляной кислотой. Продукт содержал значительное количество хлорпроизводных бензойной кислоты, поэтому не использовался в качестве пищевой добавки. В настоящее время в пищу используется бензойная кислота, получаемая синтетически.
Видео:Реакция нейтрализации гидроксида натрия соляной (хлороводородной) кислотойСкачать

Применение
Калориметрия
Бензойная кислота используется как вещество в качестве теплового стандарта для калибровки калориметров по температуре и теплоёмкости, так как теплота кристаллизации и плавления хорошо известны и воспроизводимы.
Сырьё
Бензойная кислота служит для получения многих реактивов, наиболее значимые из них:
- Бензоилхлорид, C6H5C(O)Cl, получается обработкой бензойной кислоты тионилхлоридом, фосгеном или хлоридами фосфора PCl3 и PCl5. C6H5C(O)Cl — важное исходное вещество для некоторых производных бензойной кислоты, таких как бензилбензоат, используемый как искусственный ароматизатор и репеллент.
- Бензоатные пластификаторы, такие как гликоль-, диэтиленгликоль- и триэтиленгликолевые эфиры, получаемые переэтерефикацией метилбензоата с соответствующим диолом. Альтернативно эти вещества получаются действием бензоилхлорида на соответствующий диол. Эти пластификаторы используются с соответствующими эфирами терефталевой кислоты.
- Фенол, C6H5OH, получаемый окислительным декарбоксилированием при 300—400 °C. Необходимая температура, может быть понижена до 200 °C добавлением каталитических количеств солей меди (II). Далее фенол может быть конвертирован в циклогексанол, который служит исходным веществом в синтезе нейлона.
Консервант
Бензойную кислоту и её соли используют при консервировании пищевых продуктов (пищевые добавки E210, E211, E212, E213).
Бензойная кислота, блокируя ферменты, замедляет обмен веществ во многих одноклеточных микроорганизмах и грибках. Она подавляет рост плесени, дрожжей и некоторых бактерий.
В пищевые продукты её добавляют в чистом виде или в виде натриевой, калиевой или кальциевой соли.
Губительное действие на микрофлору начинается с абсорбции бензойной кислоты липидной стенкой клетки.
Поскольку через стенку клетки может проникнуть только недиссоциированная кислота, бензойная кислота проявляет антимикробное действие только в кислых пищевых продуктах.
Если внутриклеточный pH 5 или меньше, анаэробная ферментация глюкозы через фосфорфруктокиназу уменьшается на 95 %. Эффективность бензойной кислоты и бензоатов зависит от кислотности (pH) пищи.
Кислая пища, напитки, такие, как фруктовые соки, (содержащие лимонную кислоту), газированные напитки, содержащие в растворе (углекислый газ), безалкогольные напитки с (фосфорной кислотой), соленья (молочная кислота) и другие кислые пищевые продукты консервируются бензойной кислотой и её солями.
Принятые и оптимальные концентрации бензойной кислоты при консервации пищи 0,05—0,1 %.
Медицина
Бензойную кислоту применяют в медицине при кожных заболеваниях, как наружное антисептическое (противомикробное) и фунгицидное (противогрибковое) средства, при трихофитиях и микозах, а её натриевую соль, — бензоат натрия — как отхаркивающее средство.
Другие применения
Эфиры бензойной кислоты (со спиртами от метилового до амилового) обладают сильным и приятным запахом и применяются в парфюмерной промышленности.
Некоторые другие производные бензойной кислоты, такие как, например, хлор- и нитробензойные кислоты, широко применяются для синтеза красителей.
Видео:Бензойная кислота убивает вредных бактерийСкачать

Биологическое действие и влияние на здоровье человека
Бензойная кислота в свободном виде и виде сложных эфиров встречается в составе многих растений и животных. Значительное количество бензойной кислоты находится в ягодах (около 0,05 %). Зрелые плоды некоторых видов вакциниума содержат большое количество свободной бензойной кислоты. Например, в бруснике — до 0,20 % в спелых ягодах, и в клюкве — до 0,063 %. Бензойная кислота также образуется в яблоках после заражения грибком Nectria galligena. Среди животных, бензойная кислота обнаружена в основном во всеядных или фитофагных видах, например, во внутренних органах и мускулах тундряной куропатки (Lagopus muta), также как и в выделениях самцов овцебыка или азиатского слона.
Бензойная смола содержит до 20 % бензойной кислоты и 40 % бензойных эфиров.
Бензойная кислота присутствует, как часть гиппуровой кислоты (N-бензоилглицин) в моче млекопитающих, особенно травоядных животных. Бензойная кислота хорошо всасывается, через коэнзим А связывается с аминокислотой глицином в гиппуровую кислоту и в таком виде выводится через почки. Человек выделяет около 0,44 г/л гиппуровой кислоты в день в моче и больше, если находится в контакте с толуолом или бензойной кислотой. Для человека считается безопасным потребление 5 мг/кг массы тела в день. Кошки имеют гораздо более низкую толерантность к бензойной кислоте, чем мыши и крысы. Летальная доза для кошек — 300 мг/кг массы тела. Оральная ЛД50 для крыс 3040 мг/кг, для мышей 1940—2260 мг/кг.
Бензольное кольцо
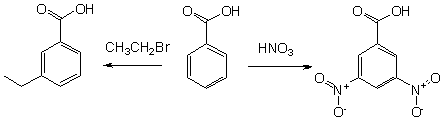
Электрофильное ароматическое присоединение происходит по 3-му положению из-за электроноакцепторных свойств карбоксильной группы. Второе замещение происходит сложнее (правая часть) благодаря деактивации нитрогруппой. Наоборот, при введении электронодонорного заместителя (например, алкила), второе замещение происходит легче.
Карбоксильная группа
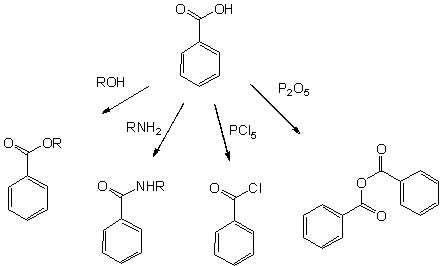
Все реакции, характерные для карбоксильной группы, возможны с бензойной кислотой:
- Эфиры бензойной кислоты — продукты кислотнокатализируемой реакции со спиртами
- Амиды бензойной кислоты легко доступны, используя для их синтеза активированные производные(такие как бензоилхлорид), или сочетающие реагенты используемые в пептидном синтезе такие как ДЦГК и ДМАП.
- Более активный бензойный ангидрид образуется при дегидратации уксусным ангидридом или оксидом фосфора
- Высокоактивные галогенангидриды легко получаются действием хлоридом фосфора(V) или тионилхлорида
- Ортоэфиры могут быть получены в сухих условиях реакцией бензонитрила в кислой среде со спиртами
- Восстановление до бензальдегида или бензилового спирта возможно при использовании LiAlH4 или борогидрида натрия
- Декарбоксилирование серебряной соли может быть проведено при нагревании, бензойная кислота может быть декарбоксилирована при нагревании с сухими щёлочами или гидроксидом кальция.
- Бензойная кислота образует соли
Видео:Химия. 7 класс. Реакции разбавленных кислот с карбонатами /02.02.2021/Скачать

Производные
- 2,3-дигидроксибензойная кислота (пирокатехиновая кислота)
- 2,4-дигидроксибензойная кислота (бета-резорциловая кислота)
- 2,5-дигидроксибензойная кислота (гентизиновая кислота)
- 2,6-дигидроксибензойная кислота (гамма-резорциловая кислота)
- 3,4-дигидроксибензойная кислота (протокатехиновая кислота)
- 3,5-дигидроксибензойная кислота (альфа-резорциловая кислота)
- 3-нитробензойная кислота
- 3,5-динитробензойная кислота
- Толуиловые кислоты
Соли бензойной кислоты называются бензоатами, например:
- Бензоат аммония
- Бензоат лития
- Бензоат натрия
- Бензоат магния
- Бензоат марганца
- Бензоат меди(II)
- Бензоат ртути(II)
- Бензоат свинца(II)
- Бензоат серебра
💥 Видео
Реакция САЛИЦИЛОВОЙ КИСЛОТЫ и ХЛОРИДА ЖЕЛЕЗА. Качественная реакция. Опыты по химии. ЭкспериментыСкачать

Бензойная кислота⚠️ Получение и изучение свойств. C6H5COOH.Скачать

Возгонка бензойной кислотыСкачать

Линия 3. От метана до бензойной кислоты или как решать органические цепочки?Скачать

Органическая химия. Механизмы реакций. Электрофильное замещение: нитрование бензойной кислотыСкачать

Бензойная кислота.Испарение.Новый год.Снег в колбе.Елка или ель?гидроксид натрия.Опыты-реакции.ОгоньСкачать

Химические свойства КИСЛОТ 8 класс | ПРИНЦИП составления ЛЮБОЙ реакции с участием кислотСкачать

Реакция нейтрализации. Урок 26. Химия 7 класс.Скачать

11.3. Карбоновые кислоты и их соли: Химические свойства. ЕГЭ по химииСкачать