Химия | 10 — 11 классы
Написать уравнение диссоциации кремниевой кислоты.
Кремниевая кислота неполностью диссоциирует
К. она нерастворима в воде и в водных растворах подвергается частичнойдиссоциации.
- Написать уравнение диссоциации след?
- Уравнение диссоциации селеноводородной кислоты?
- Напишите уравнение диссоциации кислоты H2CrO4?
- Напишите уравнение диссоциации фосфорной кислоты?
- Написать уровнение диссоциации фосфорной кислоты?
- В чем отличие кремниевой кислоты от других кислот?
- Составьте возможные уравнения диссоциации следующих веществ : карбоната бария, хлорида железа 3, азотной кислоты, оксида углерода 4, кремниевой кислоты?
- HBrO3 — бромноватая кислота ; h2SiO3 — кремниевая кислота Написать формулу её андегрида, то есть 2 кислот?
- Помогите сделать уравнение ?
- Написать ступенчатую диссоциацию серной кислоты?
- Кремниевая кислота электролитическая диссоциация уравнение
- Как написать хороший ответ?
- Кремниевая кислота — формула, физические и химические свойства
- Общая информация
- Особенности силикатов
- Физические и химические свойства
- Способы получения
- Применение в различных отраслях
- 🎥 Видео
Видео:ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ кислот оснований и солей | Как писать УРАВНЕНИЯ ДИССОЦИАЦИЙСкачать

Написать уравнение диссоциации след?
Написать уравнение диссоциации след.
Веществ : серная кислота, хлорид магния, гидроксид калия.
Видео:Электролитическая диссоциация кислот, оснований и солей. 9 класс.Скачать

Уравнение диссоциации селеноводородной кислоты?
Уравнение диссоциации селеноводородной кислоты.
Видео:ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Напишите уравнение диссоциации кислоты H2CrO4?
Напишите уравнение диссоциации кислоты H2CrO4.
Видео:Механизм электролитической диссоциации. 9 класс.Скачать

Напишите уравнение диссоциации фосфорной кислоты?
Напишите уравнение диссоциации фосфорной кислоты.
Видео:Электролитическая диссоциация | Химия ЕГЭ, ЦТСкачать

Написать уровнение диссоциации фосфорной кислоты?
Написать уровнение диссоциации фосфорной кислоты.
Видео:Задание 13: Все про электролитическую диссоциацию на ОГЭСкачать

В чем отличие кремниевой кислоты от других кислот?
В чем отличие кремниевой кислоты от других кислот?
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Составьте возможные уравнения диссоциации следующих веществ : карбоната бария, хлорида железа 3, азотной кислоты, оксида углерода 4, кремниевой кислоты?
Составьте возможные уравнения диссоциации следующих веществ : карбоната бария, хлорида железа 3, азотной кислоты, оксида углерода 4, кремниевой кислоты.
Видео:Задание 13. Диссоциация, как писать уравнения диссоциации? | Химия ОГЭ | УмскулСкачать

HBrO3 — бромноватая кислота ; h2SiO3 — кремниевая кислота Написать формулу её андегрида, то есть 2 кислот?
HBrO3 — бромноватая кислота ; h2SiO3 — кремниевая кислота Написать формулу её андегрида, то есть 2 кислот.
Видео:Основные положения теории электролитической диссоциации. Свойства ионов. 9 класс.Скачать

Помогите сделать уравнение ?
Помогите сделать уравнение .
Написать уравнение реакций диссоциаций уксосной и муравьиной кислоты.
Видео:Электролитическая диссоциация. Видеоурок по химии 9 классСкачать

Написать ступенчатую диссоциацию серной кислоты?
Написать ступенчатую диссоциацию серной кислоты.
Вы открыли страницу вопроса Написать уравнение диссоциации кремниевой кислоты?. Он относится к категории Химия. Уровень сложности вопроса – для учащихся 10 — 11 классов. Удобный и простой интерфейс сайта поможет найти максимально исчерпывающие ответы по интересующей теме. Чтобы получить наиболее развернутый ответ, можно просмотреть другие, похожие вопросы в категории Химия, воспользовавшись поисковой системой, или ознакомиться с ответами других пользователей. Для расширения границ поиска создайте новый вопрос, используя ключевые слова. Введите его в строку, нажав кнопку вверху.
Вода – слабый электролит, диссоциирующий на ионы H + и OH — — анионы. Этому процессу соответствует константа диссоциации воды : д * [H2O] = К H2O = [H + ] [OH — ] – ионное произведение воды, К H2O = 1 * 10 — 14 (при 25° С) К H2O – величина постоянна..
1. Литий — Li + 3 Li )2ē )1ē ē = 3, p = 3, n = 4 Находится в I группе, А подгруппе, II периоде. 2. Металл 3. Li Be 5. Высший оксид — Li2O — основный 6. Высший гидроксид — LiOH — щелочь 7. Летучего водородного соединения не образует..
Нет, там за каждый элемент ставится определенное кол — во баллов. На Решу ОГЭ вариант открой, после внизу страницы нажми «сохранить», далее будет написано, как оценивается каждое задание из 2 части.
2. Дано : ω(Е) = 91, 18% Знайти : Е — ? Ω(Н) = 100% — 91, 18% = 8, 82% Загальна формула сполуки ЕН3 Мг(ЕН3) = 3 / 0, 0882 = 34 Аг(Е) = 34 — 3 = 31⇒Р — Фосфор 2. Дано : m(Me(NO3)3 = 42. 6 r m(Me(OH)3 = 15. 6 r Знайти : Ме — ? Формула солі — ? 42..
Химия — это наука о веществах и их превращениях в другие вещества.
2Fe2O3 + 3C = 4Fe + 3CO2 реакция замещения Fe2O3 + 6HCl = 2FeCl3 + 3H2O реакция обмена H2CO3 = H2O + CO2 реакция разложения 3Mg + N2 = Mg3N2 реакция соединения.
HCl + NH3 = NH4Cl n(HCl) = n(NH4Cl) = 11200 дм3 / 22, 4 дм3 / моль = 500 моль m(NH4Cl) = 500 моль * 56, 5 г / моль = 28250 г = 28, 250 кг.
H2SO3 = H + HSO3 = 2H + SO3 AL(NO3)3 = AL + 3NO3.
Твердое ; желтого или зелено желтого цвета ; запах есть, непластичное и хрупкоев S8моноклинном виде и пластичное в S6 и S4 — пластические виды серы, получаются при нагревании ; в воде нерастворимо ; T кип = + 444 С Т плав = + 112С ; плотность = 2070 ..
A) Li + Cl2 = LiCl2 b)Li + S = v) g)Li + O2 = LiO2 d)Li + 2HCl = LiCl + H2.
Видео:9 класс. Электролитическая диссоциация. Образование ионов.Скачать

Кремниевая кислота электролитическая диссоциация уравнение
Вопрос по химии:
Написать уравнение диссоциации кремниевой кислоты
Трудности с пониманием предмета? Готовишься к экзаменам, ОГЭ или ЕГЭ?
Воспользуйся формой подбора репетитора и занимайся онлайн. Пробный урок — бесплатно!
Ответы и объяснения 1
Кремниевая кислота не полностью диссоциирует
т.к. она нерастворима в воде и в водных растворах подвергается частичной диссоциации.
H₂SiO₃ = H⁺ + HSiO₃⁻
HSiO₃- = H⁺ + SiO₃²⁻
Знаете ответ? Поделитесь им!
Как написать хороший ответ?
Чтобы добавить хороший ответ необходимо:
- Отвечать достоверно на те вопросы, на которые знаете правильный ответ;
- Писать подробно, чтобы ответ был исчерпывающий и не побуждал на дополнительные вопросы к нему;
- Писать без грамматических, орфографических и пунктуационных ошибок.
Этого делать не стоит:
- Копировать ответы со сторонних ресурсов. Хорошо ценятся уникальные и личные объяснения;
- Отвечать не по сути: «Подумай сам(а)», «Легкотня», «Не знаю» и так далее;
- Использовать мат — это неуважительно по отношению к пользователям;
- Писать в ВЕРХНЕМ РЕГИСТРЕ.
Есть сомнения?
Не нашли подходящего ответа на вопрос или ответ отсутствует? Воспользуйтесь поиском по сайту, чтобы найти все ответы на похожие вопросы в разделе Химия.
Трудности с домашними заданиями? Не стесняйтесь попросить о помощи — смело задавайте вопросы!
Химия — одна из важнейших и обширных областей естествознания, наука о веществах, их составе и строении, их свойствах, зависящих от состава и строения, их превращениях, ведущих к изменению состава — химических реакциях, а также о законах и закономерностях, которым эти превращения подчиняются.
Видео:Свойства кислот с точки зрения теории электролитической диссоциации. 9 класс.Скачать

Кремниевая кислота — формула, физические и химические свойства
Видео:Химия 9 класс (Урок№5 - Сущность процесса электролитической диссоциации.)Скачать

Общая информация
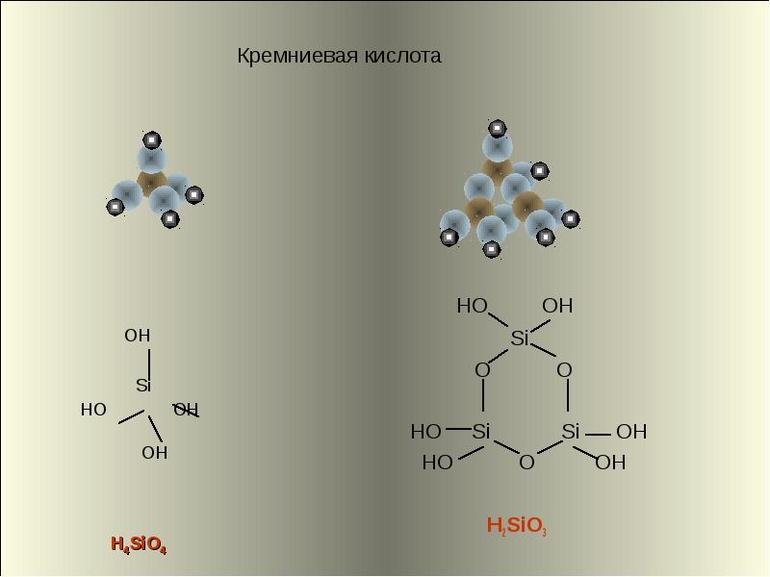
Основная формула кремниевой кислоты — H2SiO3 (так как кислота не имеет постоянного состава, её обозначение иногда принимает вид nSiO2 • mH2O, что соответствует поликремниевым видам). Номенклатура кислоты включает в себя и её подвиды. Условное обозначение их химического состава выглядит следующим образом:
- Ортокремниевая — H4SiO4. Наряду с метакремниевой кислотой, чья формула считается основной, ортокремниевая является наиболее распространённым химическим соединением кислот этого вида.
- Дикремниевая — H2Si2O5, H6Si2O7 и H10Si2O9 (показатель растворимости в воде при t = 20 градусов по цельсию составляет 2,9310 в минус 4 степени моль/л).
- Пирокремниевая — H6Si2O7.
Соли кремниевых кислот обозначаются как силикаты. Поликремниевые кислоты состоят из структурных звеньев, соединяющихся в сложные линейные и разветвлённые цепи. Несмотря на различие в формулах и отдельных характеристиках кремниевой кислоты, все виды этих химических соединений имеют тетраэдрическое строение.
Видео:Электролитическая диссоциацияСкачать

Особенности силикатов
В природе широко распространены (в частности, к ним относятся полевые шпаты, асбест, тальк, слюда и различные виды глины). Соли кремниевой кислоты в большинстве своём плохо растворимы в воде (исключения составляют силикаты калия и натрия). Получение солей происходит при сплавлении едких щёлочей или карбонатами натрия и калия с диоксидом кремния. В остатке выходит диоксид углерода с высокой массовой долей вещества или вода. Примерами таких уравнений могут послужить следующие реакции:
- SiO2 + K2CO3 = K2SiO3 + CO2 (образование углекислого газа).
- SiO2 + 2NaOH = Na2SiO3 + H2O.
- SiO2 + Na2CO3 = Na2SiO3 + CO2.
К свойствам солей относится высокая температура плавления: в среднем — от 1000 до 1300 градусов по Цельсию (такая разновидность силикатов, как каолинит, плавится при t = 1800 и выше). Твёрдость этих веществ по шкале Мооса составляет 6−8 баллов, что является высоким показателем.
Несмотря на то что силикаты не реагируют на отдельные соединения и в целом относятся к классу химически пассивных веществ, они способны взаимодействовать со слабыми кислотами и растворимыми солями. Формула гидролиза представляет собой уравнение: Na2SiO3 + H2O = NaHSiO3 + NaOH. Расплавленные силикаты имеют высокие электролитические свойства.
Ещё одной особенностью солей кремниевых соединений является их возможность замещать атомы кремния на атомы алюминия, образуя при этом алюмосиликаты. Они также нерастворимы в воде и обладают абсорбционными, ионообменными, диэлектрическими и термостойкими свойствами.
Видео:Ионные уравнения реакций. Как составлять полные и сокращенные уравненияСкачать

Физические и химические свойства
Неорганическая кислота образуется при действии сильных кислот на растворимые силикаты. Вещество представляет собой белый аморфный и стекловидный полимер, имеющий цепочечную структуру. Не вступает в реакцию с другими кислотами и не гидратом аммиака. Так как все поликремниевые соединения относятся к малорастворимым веществам, они образуют коллоидные растворы при реакции с водой. Молярная масса вещества равна 78 а. е. м. (H2SiO3 — 2 атома водорода = 1 • 2, 1 атом кремния = 28 и 3 атома кислорода = 16 • 3).
Кислотные свойства выражены очень слабо (у молекулы вещества степень окисления кремния равна +4), вещество не имеет кислого вкуса или запаха, а также не изменяет окраску индикатора. Согласно таблице сильных и слабых кислот, кремниевая занимает последнюю строчку). Константа диссоциации для метакремниевых соединений составляет K1 = 1,3•10 -10 , K2 = 1,6•10 -12 , а для ортокремниевой K1 = 2•10 -10 , K2 = K3 = K4 = 2•10 -12 .
Вследствие своей неустойчивости химическое вещество при нагревании либо длительном хранении разлагается на оксид кремния и воду (реакция термического разложения H2SiO3 = H2O + SiO2). Каждый атом кремния в кристаллах (SiO2) окружён 4 атомами кислорода, которые, будучи связаны друг с другом, образуют кристаллическую трёхмерную решётку, что обусловливает твёрдость вещества. Некоторые другие химические свойства кремниевых кислот можно проиллюстрировать следующими уравнениями:
- H2SiO3 + 4KOH = K2SiO3 + 4H2O (растворение студенистого кислотного остатка и образование средней соли метасиликата калия и воды).
- 2H4SiO4 = (HO)3SiOSi (OH)3 + H2O (эта реакция называется поликонденсацией).
- Пример взаимодействия с плавиковой кислотой и образованием газообразного фторида кремния: H2SiO3 + 6HF = H2SiF6 + 3H2O = SiF4 (образование газа) + 2HF (фтороводород) + 3H2O.
- CaCl2 + Na2SiO3 = 2NaCl + CaSiO3 (химическая реакция двух солей с выпадением осадка).
В присутствии щёлочных катализаторов — к примеру, NaOH — ортокремниевая кислота может образовывать эфиры-ортосиликаты. В большинстве своём они имеют вид R1R2R3R4SiO3, где R1−4 являются органическими радикалами. Примером такого эфира является распространённый тетраэтилортосиликат с формулой Si (C2H5O)4.
Видео:Электролитическая диссоциацияСкачать

Способы получения
Основной способ получения кремниевой кислоты — косвенным путём, воздействуя сильной кислотой на силикат калия или натрия (Na2SiO3 + 2HCl = H2SiO3 + 2NaCl). При этом невозможно получить кислоту в чистом виде — в водном растворе образуется золь, который через малый промежуток времени превращается в гель.
Кремниевые соединения также можно получить посредством гидролиза хлорсиланов (SiH2Cl2 + 3H2O = H2SiO3 +2HCl + 2H2); конечным продуктом гидролитического расщепления является H2SiO3. Наконец, для промышленных масштабов, а также для лабораторных экспериментов и отдельных опытов по химии могут использоваться методы электродиализа и ионного обмена. Большое внимание уделяется и получению силикагеля — другое название вещества, образовывающегося от перенасыщенных растворов кремниевых кислот. Технология производства включает в себя несколько стадий:
- Возникновение золя и его застудневание в однородную массу (гидрогель).
- Созревание (последующее гелеобразование и разжижение вещества).
- Очищение и промывка геля от солей.
- Высушивание и превращение вещества в ксерогель.
Опытным путём доказано, что наиболее чистый силикагель получается при гидролизе соединений кремния (SiCl4), а также ортокремниевых соединений. Химическая формула получения геля выглядит так: Na2SiO3 + H2SO4 = nSiO2 • mH2O + Na2SO4, где nSiO2 • mH2O — гидратированный аморфный кремнезём.
Применение в различных отраслях
Благодаря пористой структуре силикагеля его часто применяют в качестве абсорбента для поглощения вредных газов и смесей. Для общественности известны медицинские высокопористые гели, эффективные при различного рода отравлениях и недомоганиях. Помимо этого, вещество используется и для создания технических фильтрационных систем.
Кремниевые соединения являются важным строительным элементом для кожи, волос и ногтей, поэтому эти вещества широко используются для производства косметики и лекарственных препаратов. Препараты на основе кремния обеспечивают гибкость соединительных тканей внутренних органов (в частности, кишечника и желудка) и улучшают усвоение кальция, что способствует восстановлению костной ткани.
В нефтяной промышленности гели на основе кремнийсодержащих веществ используются для очистки углеводородов от смол, а в ядерной отрасли при помощи силикагеля производится не только очистка сточных вод, но и разделение изотопов радиоактивных веществ.
Любопытно, что вещества на основе кремниевых соединений находят массу применений в повседневной жизни. К примеру, процесс сушки обуви займёт куда меньше времени, если в промокшие ботинки положить пакетик с соответствующим абсорбентом. Силикагель позволит избавиться от неприятных запахов в помещении или в сумке с вещами. Столовое серебро можно спасти от почернения, положив в шкаф с ценными приборам гелевые шарики на основе силикагеля.
Если необходимо продлить срок службы бритвенных лезвий, то для спасения от ржавчины нужно положить к ним несколько гранул с силикагелем. Это же относится и к хранению старых фотографий, а также других вещей, которые со временем могут потускнеть или изменить свой внешний вид под воздействием окружающей среды. Автолюбителям могут уменьшить запотевание ветрового стекла, всего лишь положив на приборную панель цветы или пакетик с силикагелем.
🎥 Видео
Задание №13. Диссоциация | Химия ОГЭ 2023 | УмскулСкачать

Степень электролитической диссоциации. Сильные и слабые электролиты. 9 класс.Скачать

Диссоциация кислот.Скачать

Химия, 10-й класс, Электролитическая диссоциация. Диссоциация сильных электролитовСкачать