1. Введение. Обоснование темы.
Наверное, нет человека, который не встречал в своей жизни результат коррозии металлов в виде материального, экономического ущерба или экологических последствий. Я тоже обратил внимание, что ржавые изделия, детали, конструкции могут встречаться не только на улице под открытым небом, но и дома. Так, я увидел ржавчину на дверных шарнирах, на инструментах в гараже (приложение 1).
Что же такое ржавчина? Каковы последствия от нее? Она не добавляет изделиям изящества и красоты. Наоборот, она не только портит внешний вид, но и может привести к непоправимым последствиям. Актуальность проблемы антикоррозионной защиты металлов основывается на необходимости защиты окружающей среды, сохранения природных ресурсов, а также рационального использования и хранения металлических конструкций в условиях производства, а также металлических изделий, инструментов, механизмов, машин в быту человека. Чтобы не испытывать разочарования и убытков от этого неприятного процесса, нужно изучить его и научиться, если это возможно, управлять им. Задумавшись всерьез над этой проблемой, я решил узнать, как можно больше об этом процессе, условиях его появления, и о том, как от него избавиться?
Поэтому, цель моей работы: Выяснить и изучить условия появления ржавчины.
Мне так же было интересно выяснить что знают мои одноклассники о ржавчине, условиях ее появления и способах защиты.
На пути достижения цели мне нужно было решить задачи:
Провести анкетирование среди одноклассников по данной проблеме.
Провести лабораторные опыты по наблюдению появления ржавчины в разных условиях.
Изучить основные способы защиты от ржавчины.
Познакомить одноклассников и взрослых с результатами исследования.
Я использовал в своей работе следующие методы:
Работа с первоисточниками, изучение литературы, прессы,
Социологический опрос, анкетирование,
Постановка опытов, анализ,
Гипотеза исследования: Агрессивные вещества и среды ускоряют появление ржавчины.
Объект исследования: ржавчина.
Предмет исследования: условия появления ржавчины.
Коррозия – рыжая крыса,
Грызет металлический лом.
2. Основная часть. Ржавление металлов – проблема цивилизации.
2.1. Изучение понятия «ржавчина».
Поработав с энциклопедией и словарями, я прежде, всего выяснил, что такое ржавчина.
Значение слова Ржавчина по Ефремовой: Ржавчина — 1. Красно-бурый налет на поверхности железа, образующийся вследствие медленного окисления и разрушающе действующий на металл.// Пятна бурого, желтого цвета, появившиеся на чем-л. в результате окисления жира. // перен. Следы чего-л., вредно, разъедающе действующие на кого-л., что-л. 2. перен. Бурая пленка на болоте, образующаяся вследствие присутствия в воде железистых пород. // Место на болоте, покрытое такой пленкой. // Болото, покрытое такой пленкой. 3. перен. Вызываемое ржавчинными грибками заболевание растений, сопровождающееся появлением оранжевых пятен. // Оранжевые пятна на растениях, вызванные таким заболеванием [3].
Значение слова Ржавчина по Ожегову: Ржавчина — Красно-бурый налет на железе, образующийся вследствие окисления и ведущий к разрушению металла. Ржавчина — след на чем-нибудь от такого налета. Ржавчина — бурое пятно на растениях в местах, где развиваются споры паразитных грибков. Ржавчина — бурая пленка на болотной воде [6]/
Ржавчина в Энциклопедическом словаре: Ржавчина — слой частично гидратированных оксидов железа, образующийся на поверхности железа и некоторых его сплавов в результате коррозии, вызванной действием кислорода и влаги. См. также [2].
Значение слова Ржавчина по словарю Ушакова: РЖАВЧИНА ржавчины, мн. нет, ж. 1. Красно-бурый налет на поверхности железа, образующийся вследствие медленного окисления его в воздухе. Ржавчина ест железо. На машинных частях ржавчина недопустима. 2. Места на болотах, покрытые бурой водой. 3. Бурые пятна на поверхности растений, появляющиеся в местах, где развиваются споры паразитных грибков. Хлебная ржавчина понижает [8].
Коррозия (от латинского corrodere- разъедать) – самопроизвольное разрушение металлов и их сплавов под влиянием окружающей среды [1].
На основании проанализированных определений можно сделать вывод: ржавчина – налет на поверхности металла или сплавов, ведущий к их разрушению.
2.2. Причины и значение процесса ржавления.
«Ржа ест железо» — гласит русская народная поговорка. Ржавчина, которая появляется на поверхности стальных и чугунных изделий, — это яркий пример коррозии.
На сегодняшний день проблемы антикоррозионной защиты строительных и других видов конструкций, различной продукции и материалов являются актуальными как в России, так и во многих странах мира.
В промышленно развитых странах коррозия металлов наносит существенный ущерб экономике каждого государства, поэтому данные вопросы играют немаловажную роль как в быту, так и в государственных масштабах.
В процессе изучения литературы я выяснил причины появления ржавчины, а также, значение процесса ржавления в производстве и быту человека.
Причины ржавления
Если железо, содержащее какие-либо добавки и примеси (например, углерод), находится в контакте с водой, кислородом или другим сильным окислителем и (или) кислотой, то оно начинает ржаветь. Если при этом присутствует соль, например, имеется контакт с солёной водой, коррозия происходит быстрее в результате электрохимических реакций. Чистое железо относительно устойчиво к воздействию чистой воды и сухого кислорода. Как и у других металлов, например, у алюминия, плотно приставшее оксидное покрытие на железе защищает основную массу железа от дальнейшего окисления.
Другими разрушающими факторами являются диоксид серы и углекислый газ в воде. В этих агрессивных условиях образуются различные виды гидроксида железа. В отличие от оксидов железа, гидроксиды не защищают основную массу металла. Поскольку гидроксид формируется и отслаивается от поверхности, воздействию подвергается следующий слой железа, и процесс коррозии продолжается до тех пор, пока всё железо не будет уничтожено, или в системе закончится весь кислород, вода, диоксид углерода или диоксид серы.
Скорость коррозии железав щелочных растворах по сравнению со скоростью коррозии в нейтральных и кислых растворах меньше [1].
Экономический эффект коррозии
Человечество несет огромные материальные потери в результате коррозии трубопроводов, деталей машин, судов, мостов, морских конструкций и технологического оборудования. Коррозия приводит к уменьшению надежности работы оборудования: аппаратов высокого давления, паровых котлов, металлических контейнеров для токсичных и радиоактивных веществ, лопастей и роторов турбин, деталей самолетов и т.д.
По оценкам специалистов, от 5 до10 процентов транспортных строительных конструкций, зданий и сооружений ежегодно выходит из строя или требует ремонта из-за коррозионных повреждений. Так, наиболее повреждаемыми инженерными сооружениями на транспорте являются железобетонные фундаменты и опоры контактной сети и линий электропередачи. мосты, виадуки и путепроводы, подземные пешеходные переходы, коллекторы сточных вод. градирни, сети водоснабжения. Ежегодно в различные трубопроводы закачивается около 70000 млрд. литров воды, каждый третий из которых не доходит до потребителя. В деньгах это примерно 600 млрд. рублей убытка, не считая моральных и материальных издержек от аварий, Проблема заключается в высоком уровне изношенности труб, о чем неоднократно сообщала «Строительная газета» [4].
Ржавчина вызывает деградацию инструментов и конструкций, изготовленных из материалов на основе железа. Поскольку ржавчина имеет гораздо больший объём, чем исходное железо, её нарост ведёт к быстрому разрушению конструкции, усиливая коррозию на прилегающих к нему участках — явление, называемое «поеданием ржавчиной». Это явление стало причиной разрушения моста через реку Мианус(штат Коннектикут, США) в 1983 году, когда подшипники подъёмного механизма полностью проржавели изнутри. В результате этот механизм зацепил за угол одной из дорожных плит и сдвинул её с опор. Ржавчина была также главным фактором разрушения Серебряного моста в Западной Вирджинии в 1967 году, когда стальной висячий мост рухнул меньше, чем за минуту (приложение 2). Погибли 46 водителей и пассажиров, находившихся в то время на мосту.
Мост Кинзу в штате Пенсильвания был снесён смерчем в 2003 году в значительной степени потому, что центральные базовые болты, соединяющие конструкцию с землёй, проржавели, предоставив мосту возможность держаться просто под действием силы тяжести.
Кроме того, коррозия покрытых бетоном стали и железа может вызвать раскалывание бетона, что создает серьёзные конструкторские проблемы. Это один из наиболее распространённых отказов железобетонных мостов.
Ржавчина в воде
Любое железо при наличии кислорода и воды образует оксиды и гидрооксиды, то есть окислы железа. Эти продукты в быту и носят название – ржавчина.Ржавчина содержится в питьевой воде по большей части в виде мелких коллоидных частиц, но могут появляться и более крупные – в виде окалины. Появление ржавчины в воде свидетельствует о повышенном содержании железа в воде, либо об усиленной коррозии водопроводных труб из-за применения некоторых методов биологической очистки воды (приложение 3).
Вред ржавой воды для здоровья человека
При употреблении человеком воды, имеющей повышенное содержание железа, о чём свидетельствует наличие в ней ржавчины, его организм получает сверхнормативное количество железа, часто приводящее к негативным последствиям для здоровья. Если в воде, используемой в пищевых целях, содержится более 0,3 мг/л железа, то при этом человек рискует приобрести следующие заболевания:
увеличение риска возникновения инфарктов;
ухудшение репродуктивных функций организма;
повышенная утомляемость, общая слабость, головные боли;
болезни желудка и кишечника;
снижение иммунитета и возникновение аллергии;
повышение риска онкологических заболеваний;
усиление пигментации кожи.
Кроме этого, железо в избыточных количествах откладывается в органах человека, а избавиться от него намного труднее, чем компенсировать его недостаток.
Вред ржавой воды для бытовой техники
Первым признаком наличия ржавчины в воде являются трудновыводимые пятна на поверхности ванны, душевой кабины, умывальника (приложение 4). Но это еще полбеды, куда страшнее вред, приносимый бытовой технике в процессе её эксплуатации:
ухудшается поток воды, в связи с этим отказываются работать газовые колонки;
засоряются насосы и подающие воду шланги в стиральных машинах, что приводит к их износу и необходимости преждевременной замены:
засоряется и портится клапан бачка унитаза, что становится причиной невозможности им пользоваться;
забиваются смесители и душевые головки, отремонтировать их практически невозможно;
бельё после стирки становится неприятного оттенка.
Устранение повреждений бытовой техники, связанной с наличием ржавчины, приводит к немалым материальным расходам при ремонтных работах, а иногда и необходимости приобретения новых устройств.
Вред воды c ржавчиной для коммуникаций
Перед тем, как вода добирается непосредственно до потребителя, она проходит многоступенчатую очистку. Трубы, по которым происходит доставка воды, изготовлены из металла, подверженного коррозии, но это процесс длительный, срок службы коммуникаций рассчитывается с учётом его продолжительности (приложение 5).
Вред ржавления для окружающей среды
Трубопроводы, по которым проходит природный газ или нефть, подвергаясь коррозии, могут прийти в негодность приложение 6). Из-за разрушения целостности конструкций трубопровода в окружающую среду могут попасть вредные для природы вещества (газ, нефть и другие опасные химические продукты). Отравленными могут оказаться не только представители животного мира, но и растения, и почва. Это может привести к экологической угрозе окружающей среды.
На основании вышеизложенного можно сделать вывод: ржавление приносит не только экономический ущерб, но также отрицательно влияет на здоровье человека, приносит ему материальный ущерб и негативно сказывается на состоянии окружающей среды.
Лабораторное исследование условий появления ржавчины.
Исходя из полученных данных по прочитанной литературе, было решено провести практические опыты по выявлению и изучению условий появления ржавчины. Условия старался подобрать разные: от дистиллированной воды, раствора соли до агрессивной среды – щелочи.
Для постановки опытов:
Я взял штатив с пробирками.
Подобрал к ним пробки.
Приготовил железные гвозди.
Закладка опыта (приложение 7):
Во все пробирки аккуратно положил по 2 гвоздя.
Налил реактивы так, чтобы гвозди находились в растворах полностью.
Плотно закрыл каждую пробирку пробкой для изоляции от внешней среды.
Регулярно вел наблюдения, записывая любые изменения в журнале.
Условия опыта:
В пробирке №1 гвозди находились в дистиллированной воде. Дистиллированная вода в отличие от природной не содержит в себе никаких солей. Пробирка закрыта пробкой.
В пробирке № 2 гвозди находились в дистиллированной воде, над которой был налит слой растительного масла. Растительное масло предотвращает поступление в воду каких бы то ни было веществ из воздуха пробирки, в том числе кислорода. Пробирка закрыта пробкой.
В пробирке № 3 гвозди находились в растворе щелочи. Пробирка закрыта пробкой.
В пробирке № 4 гвозди были в контакте с медной проволокой и находились в воде. Пробирка закрыта пробкой.
В пробирке № 5 гвозди находились в растворе поваренной соли. Пробирка закрыта пробкой.
Результаты наблюдения (приложение 8).
Уже на второй день ржавчина появилась на шляпках гвоздей и на дне пробирок № 1 (с дистиллированной водой), № 4 (гвозди находятся в контакте с медной проволокой) и № 5 (гвозди в растворе поваренной соли). В пробирке №2 слой воды у дна стал слегка желтоватым. В пробирке №3 изменений нет, чему я очень удивлен.
На третий день слой ржавчины увеличился в пробирках № 1, 4, 5. В пробирке № 2 новых изменений нет. В пробирке №3 изменений нет, продолжаю удивляться.
На четвертый день увеличение слоя ржавчины наблюдал в пробирках №1, 4, 5. В пробирке №2 появился осадок на донышке. В пробирке №3 изменений нет, почему?
На девятый день в пробирках, где появилась ржавчина № 1,4,5, она стала более рыхлой и осела на дно, в пробирке №2 процесс остановился. В пробирке № 3 изменений не произошло.
На одиннадцатый день продолжается процесс в пробирках № 1,4,5. В пробирках № 2,3 изменений нет.
На шестнадцатый день продолжается процесс в пробирках № 1,4,5. В пробирках № 2,3 изменений нет.
В пробирке №1 в дистиллированной воде мог раствориться находящийся в ней кислород и под его действием начался процесс окисления гвоздя, появилась ржавчина.
В пробирке №4 железные гвозди соприкасаются с менее активным металлом — медью, железо как более активный металл начинает активно окисляться, покрываясь ржавчиной.
В пробирке №5 коррозия гвоздей происходит в результате электрохимических реакций. Соль способствует ускоренному появлению ржавчины.
В пробирке №2 в течение первых дней слабо происходит коррозия, а затем, как будто останавливается. В пробирке находится слой растительного масла. Масло предотвращает попадание кислорода в воду. Железо устойчиво к воздействию чистой воды, поэтому процесс останавливается.
В пробирке №3 находится щелочь. Щелочь довольно агрессивное вещество, способно разъедать бумагу, ткани, кожу. Воздействует ли оно на железо? Отсутствие изменений меня удивляло. А появится ли когда-нибудь ржавчина? В ожидании результата, я поискал ответ на свой вопрос.
В Большой Энциклопедии Нефти и Газа я прочитал: «Скорость коррозии железав щелочных растворах по сравнению со скоростью коррозии в нейтральных и кислых растворах меньше» [1]. Оказывается, щелочь замедляет коррозию!
Защита металлов от коррозии. Проблемы коррозии постоянно обостряются из-за непрерывного роста производства металлов и ужесточения условий их эксплуатации. Среда, в которой используются металлические конструкции, становится все более агрессивной, в том числе и за счет ее загрязнения (приложение 9). Металлические изделия, используемые в технике, работают в условиях все более высоких температур и давлений, мощных потоков газов и жидкостей. Поэтому вопросы защиты металлических материалов от коррозии становятся все более актуальными. Полностью предотвратить коррозию металлов невозможно, поэтому единственным путем борьбы с ней является поиск способов ее замедления.
Проблема защиты металлов от коррозии возникла почти в самом начале их использования. Люди пытались защитить металлы от атмосферного воздействия с помощью жира, масел, а позднее и покрытием другими металлами и, прежде всего, легкоплавким оловом (лужением). В трудах древнегреческого историка Геродота (5 в. до н. э.) и древнеримского ученого Плиния Старшего (1 в. до н. э.) уже есть упоминания о применении олова для предохранения железа от ржавления. В настоящее время борьбу с коррозией ведут сразу в нескольких направлениях – пытаются изменить среду, в которой работает металлическое изделие, повлиять на коррозионную устойчивость самого материала, предотвратить контакт между металлом и агрессивными веществами внешней среды [11].
В нашей стране накоплен некоторый опыт проведения исследований с целью определения скорости коррозионных процессов и методов защиты. Усилена работа в сфере разработки специализированных материалов и технологий, которые обеспечивают высокую степень защиты от коррозии. На основании изученной литературы и проведенных опытов можно сделать вывод: защитить металлы от коррозии можно доступными средствами. Рекомендации по защите металлов от коррозии находятся в приложении 10.
Анализ анкет детей.
Среди учащихся начальных классов я провел анкетирование по вопросам анкетыдля проведения социологического опроса учащихся о ржавчине (приложение 11). Проанализировав, сравнив и обобщив результаты, я пришел к выводу, что 90 % учащихся знают что такое ржавчина (приложение 12).
Проблема ржавления металлов их волнует 64 %.
Думают, что ржавление приносит человеку пользу — 3 %.
Считают, что ржавление приносит человеку вред — 82 %.
Вред ржавления видят в том, что изменяется внешний вид изделий, они становятся «грязными», загрязняют одежду, машины, ржавчина разрушает конструкции из металла.
Знают о том, что существуют способы защиты металлов от коррозии — 27 процентов.
Не знают способы защиты от коррозии — 24 %, не смогли ответить на этот вопрос 49%.
Могут предложить способы защиты от коррозии — 27 % учащихся. Среди предложенных способов: защита металлов от воды протиранием, смазкой, покрытие защитной пленкой, лаком, очистка щетками, хранение техники не под открытым небом, а в сарае, гараже, специальный уход.
Заключение. Выводы. Рекомендации.
Работая над проблемой изучения условий появления ржавчины я пришел к следующим выводам:
Ржавчина – налет на поверхности металла или сплавов, ведущий к их разрушению.
Результаты практических опытов позволяют сказать:
усиливают ржавление: вода, газы (например, кислород), поваренная соль, контакт с менее активным металлом;
замедляют ржавление щелочи и соли, дающие щелочную среду.
Ржавление приносит не только экономический ущерб, но также отрицательно влияет на здоровье человека, приносит ему материальный ущерб и негативно сказывается на состоянии окружающей среды.
Защитить металлы от коррозии можно доступными средствами.
Рекомендации по защите металлов от коррозии находятся в приложении 10.
Список литературы.
Большая Энциклопедия Нефти и газа. http://ru.wikihow.com/очистить-металл-от-ржавчины
Большой энциклопедический словарь. Языкознание / гл.ред. В.Н.
Ярцева. М.: Науч. изд-во «Большая Рос. Энциклопедия», 2000. 688с.: ил.
3.Ефремова Т. Ф. Современный толковый словарь русского языка: В 3 т. — М. : АСТ, Астрель, Харвест, 2006. — ISBN 5-17-029521-9, ISBN 5-17-013734-6, ISBN 5-271-12339-1, ISBN 5-271-12338-3, ISBN 985-13-4715-9.
Коррозия наносит огромный ущерб экономике России. // Строительная газета (Москва).- 12.10.2001 http://www.biohim.ru/library/689.php )
Наумов В.И. Коррозия и защита металлов от коррозии: метод. указания к лабораторным и практическим занятиям по курсу общей химии/ В.И.Наумов, Ж.В.Мацулевич, Ю.В.Батталова.-.Новгород: НГТУ им. Р.Е. Алексеева 2010.-43с.
Ожегов С. И. Словарь русского языка / Под ред. С. П. Обнорского. — М., 1949.
Толковый словарь русского языка: В 4 т. / Под ред. Д. Н. Ушакова. — М. : Сов. энцикл.: ОГИЗ, 1935—1940.
Ушаков, Дмитрий Николаевич [Электронный ресурс] : Материал из Википедии — свободной энциклопедии : Версия 10529869, сохран. в 12:55 UTC 18 августа 2008 / Авторы Википедии // Википедия, свободная энциклопедия. — Электрон. дан. — Сан-Франциско: Фонд Викимедиа, 2008. — Режим доступа: http://ru.wikipedia.org/?oldid=10529869
Шлугер М.А., Ажогин Ф.Ф., Ефимов Е.А. Коррозия и защита металлов / М.А .Шлугер, Ф.Ф.Ажогин, Е.А. Ефимов- М.: «Металлургия»,1981. -216с.
Юхневич Р., Валашковский Е Техника борьбы с коррозией / Р. Юхневич , Е.Валашковский -пер.с польск/Под редакцией Сухотина А.М.- Л: Химия,1978.- 304с.
Приложение 1.
Ржавчина на дверных шарнирах, материалах, инструментах.
Приложение 2.
Мост Кинзу после разрушения.
Приложение 3.
Ржавчина в водопроводной воде
Приложение 4.
Ржавчина на бытовой технике
Приложение 5.
Ржавчина на трубах, батареях
Приложение 6.
Коррозия трубопроводов газа и нефти
Приложение 7.
Закладка опыта
Первый день
Пронумеровал пробирки, положил по 2 гвоздя
Налил реактивы, чтобы гвозди находились в растворах
Пробирки плотно закрыл пробками
Каждый день вел наблюдения, записывая результаты в журнал
Приложение 8.
Фиксирование наблюдений
Второй день
Приложение 8 (продолжение)
Таблица наблюдений за изучением условий ржавления гвоздей
№ пробирки, день
Н2О дистиллированная
Н2О (дист)+ раститель-ное масло
NaOH, щелочь
Контакт с медью
NaCl, поваренная соль
1
2
3
4
5
1 день
2 день
Появление ржавчины оранжевого цвета на шляпках гвоздя и на донышке пробирки, в воде появилось помутнение.
Слой воды у дна пробирки стал слегка желтоватый. Цвет более яркий, чем в пробирке №1.
Я удивлен, что ничего не изменилось.
Появилась ржавчина на шляпке, на дне пробирки. Изменился цвет медной проволоки, она стала более темной.
Появилась ржавчина на шляпке гвоздя и на дне пробирки.3 день
3 день
Слой ржавчины на дне пробирки увеличился
Слой воды у дна имеет окраску, но осадка нет.
Продолжаю удивляться. Ничего не изменилось, но почему?
Слой ржавчины на шляпке гвоздя увеличился, стал более рыхлым.
Слой ржавчины увеличился.
4 день
Слой ржавчины на дне пробирки увеличился
Появился осадок на донышке пробирки
Рыхлый слой увеличился
Слой ржавчины появился на боковой поверхности гвоздей
9 день
Слой ржавчины на дне увеличился. Появился слой ржавчины на пробирке
Верхний слой воды стал желтым
Ржавчина осела на дно. Увеличился слой ржавчины на гвозде, на проволоке.
Ржавчина осела на дно, и появилась на стенках пробирки
11 день
Увеличился слой ржавчины на шляпках гвоздей
Верхний слой воды остается желтым, других изменений не наблюдается
А появится ли ржавчина? Когда?
На шляпке гвоздей горка ржавчины
Темно-коричневого цвета ржавчина оседает на дне пробирки.
16 день
Вода помутнела, слой ржавчины появился на стенках пробирки.
Верхний слой воды остается желтым, как пленка
До сих пор ничего не произошло.
Вода стала желеобразного состояния желтого цвета, на дне скопился осадок ржавчины
Осадок ржавчины на дне и по всей поверхности гвоздей.
Приложение 9.
Методы защиты от коррозии
Приложение 10.
Подручные домашние средства для удаления ржавчины
Подручное средство
Как применять?
1.Рыбий жир
Рыбий жир следует нанести на рыжее пятно и оставить на несколько часов. Благодаря жиру коррозия быстро исчезнет, а он создаст на металле тонкую пленку, которая будет защищать его от повторного появления ржавчины.
2.Картофель + соль или хозяйственное мыло
Если металл поражен коррозией незначительно, то:
разрежьте сырой картофель пополам;
посыпьте свежий срез каменной солью или намазать хозяйственным мылом; хорошенько натрите половинкой ржавое место на противне.
3.Уксус + лимонный сок
Необходимо смешать эти два вещества в равных частях и нанести на ржавчину (для борьбы с ржавчиной на металле и в ванной, с пятнами на одежде).
Для ткани достаточно, чтобы средство воздействовало около 20 минут, а для металла – несколько часов.
По истечении указанного времени потрите «ржавое пятно» на ткани щеткой, а на металле стальной мочалкой. По окончании удаления ржавчины хорошенько промойте пораженную вещь водой, после чего хорошенько высушите.
4.Пищевая сода
Добавьте в соду такое количество воды, чтобы по консистенции она была похожа на кашицу, после чего:
полученной смесью обработайте места, где появилась ржавчина, к примеру, раковину в ванной или смеситель; оставьте на полчаса;
хорошенько потрите поверхность металлическим скребком;
в случае, если ржавчина не до конца удалена, повторите процедуру.
5.Томатный
соус или кетчуп
Для удаления ржавчины обильно нанесите соус или кетчуп на ржавчину;
оставьте его на некоторое время; тщательно промойте металл;
6.Белый уксус + мука
Приготовьте пасту, смешав: 300 мл столового уксуса; одну столовую ложку каменной соли; немного муки , чтобы получилась густая консистенция.
Средством обработайте те участки латуни, которые поражены ржавчиной, и оставьте на полчаса. Возьмите тряпку и уберите пасту с поверхности, после чего промойте холодной водой и тщательно высушите металл.
7. Глицерин + зубной порошок + вода
Это средство поможет удалить пятна ржавчины с цветных тканей:
необходимо смешить все компоненты в равных частях;
нанесите на пятно ржавчины; оставьте на сутки;
на следующий день постирайте вещь.
8.Кока-кола
Отлично удаляет ржавчину с металла, так как содержит фосфорную кислоту.
Не стоит увеличивать время воздействия этих средств, поскольку можно повредить сам металл. Избавляйте от излишней влаги металл, чтобы не спровоцировать появление ржавчины.
Приложение 11.
АНКЕТА
для проведения социологического опроса учащихся о ржавчине.
Знаете ли вы что такое ржавчина?
Волнует ли Вас проблема ржавления металла?
Считаете ли вы, что ржавление приносит пользу человеку?
Считаете ли вы, что ржавление приносит вред человеку?
В чем проявляется вред ржавления металлов? (написать произвольно)
Знаете ли вы способы защиты металлов от ржавления (коррозии)?
Предложите способы защиты металлов от ржавления (коррозии).
Приложение 12.
Результаты
социологического опроса учащихся о ржавчине.
- Учебное пособие: Методические указания При изучении теоретического материала следует учитывать, что коррозия
- ЛАБОРАТОРНАЯ РАБОТА № 8
- Экспериментальная часть
- Коррозия металлов
- Теоретическая часть
- Практическая часть
- Электрохимическая коррозия
- Опыт №5. Ионы Cl как активные стимуляторы коррозии.
- Цель работы: ознакомиться с влиянием ионов Cl на процесс коррозии.
- Вывод: Ионы Cl являются активными стимуляторами коррозии. При добавлении NaCl процесс коррозии усиливается, реакция идёт быстрее.
- Опыт №6. Коррозия железа в различных электролитах
- Защита металлов от коррозии
- Цель работы – ознакомление с основными способами защиты металлов от коррозии.
- Разнообразные способы защиты металлов и сплавов от коррозии можно разделить на три основных вида; нанесение покрытий, обработка среды и электрохимическая защита.
- Практическая часть
- Опыт №1. Коррозия оцинкованного и лужёного железа в кислом растворе.
- Лабораторная работа по химии №4
- 📽️ Видео
Видео:Коррозия металлов и меры по ее предупреждению. 8 класс.Скачать

Учебное пособие: Методические указания При изучении теоретического материала следует учитывать, что коррозия
| Название: Методические указания При изучении теоретического материала следует учитывать, что коррозия Раздел: Остальные рефераты Тип: учебное пособие Добавлен 08:12:52 28 августа 2011 Похожие работы Просмотров: 1566 Комментариев: 13 Оценило: 0 человек Средний балл: 0 Оценка: неизвестно Скачать |
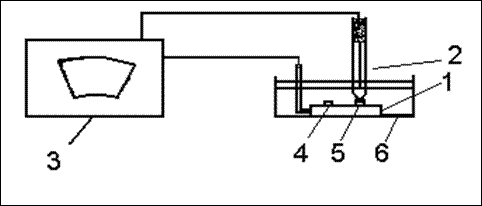 |
Рис. 1. Схема установки для изучения электрохимической гетерогенности модели металлических конструкций.
I — модель металлической конструкции (стальная пластина с медной и алюминиевой заклепками); 2 — хлорсеребряный электрод сравнения; 3 — катодный вольтметр; 4 — медная заклепка; 5 — алюминиевая заклепка; 6 — ячейка с раствором электролита.
По узкому диапазону катодного вольтметра, прикасаясь кончиком электрода сравнения к соответствующим участкам рабочего электрода, определите величину нестационарного неравновесного электродного потенциала на поверхности стали, меди и алюминия по насыщенному хлорсеребряному электроду.
На основании полученных значений электродных потенциалов, определите анодные и катодные участки металлической конструкции и сделайте вывод о коррозионных процессах, протекающих на данных металлах при контакте друг с другом.
Напишите уравнения реакций анодных и катодных процессов.
Чем объясняются близкие значения электродных потенциалов катода и анода в работающем гальваническом элементе?
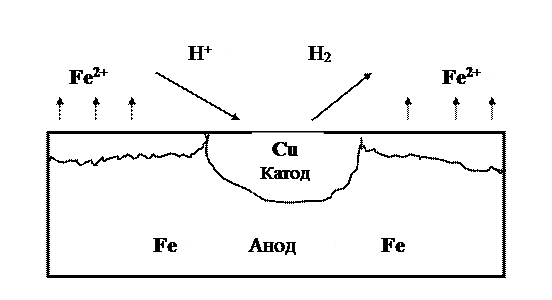
2. Коррозия под каплей электролита
На хорошо зачищенную стальную пластинку нанести крупную каплю заранее приготовленного раствора, представляющего собой смесь 3%-го раствора хлорида натрия, раствора гексацианоферрата (III) калия 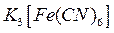
Через 5-10 минут наблюдать появление синей окраски в центре капли и розовой окраски по периферии капли. Зная, что при взаимодействии ионов железа 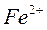
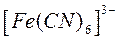
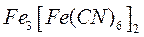
Розовая окраска фенолфталеина по краям капли указывает на повышенную концентрацию в растворе ионов 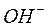
Чем обусловлена электрохимическая гетерогенность поверхности металла?
Нарисуйте схему процесса коррозии металла под каплей электролита, вызванной неравномерной аэрацией. Напишите уравнения анодной реакции (в центре капли) и катодной реакции (по краям капли).
3. Защитное действие оксидных пленок на поверхности металла
а) Пассивирование железа в концентрированном растворе азотной кислоты (демонстрационный опыт выполняется лаборантом).
Зачищенный и обезжиренный железный стержень опускают в не сильно разбавленный раствор азотной кислоты. Обратите внимание на активное взаимодействие металла с кислотой, протекающее по схеме:
Этот же стержень промывают водой и погружают в концентрированный раствор азотной кислоты. Начавшееся сразу взаимодействие железа и кислоты прекращается вследствие образования на поверхности металла защитной оксидной пленки.
Очень осторожно, не касаясь стенок сосуда, перенесите стержень в стакан с разбавленной азотной кислотой, в которую добавлено несколько капель раствора 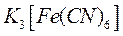
Потрите поверхность металла о стенки сосуда. Отметить появление синего окрашивания и объяснить наблюдаемое явление. Напишите уравнения реакции растворения железа в разбавленной азотной кислоте и уравнение реакции образования турнбулевой сини.
б) Активация алюминия в растворе соляной кислоты
Налейте в пробирку 1-2 мл раствора сульфата меди и опустите в нее на 1-2 минуты свернутую в шарик алюминиевую фольгу. Отметьте, что выделение меди происходит в виде отдельных точек лишь на некоторых участках. Другой шарик из алюминиевой фольги обработайте сначала раствором соляной кислоты. После этого фольгу промойте дистиллированной водой и так же погрузите в раствор сульфата меди. Наблюдайте выделение меди на алюминии в виде сплошного слоя.
Объясните наблюдаемые явления и напишите уравнения реакций:
· Растворения оксидной пленки на алюминии в растворе соляной кислоты.
· Взаимодействия алюминия с раствором соли меди.
Какую роль играет оксидная пленка на поверхности алюминия?
б) Активация алюминия в растворе соли ртути.
(демонстрационный опыт выполняется лаборантом)
При взаимодействии алюминия с раствором соли ртути вначале выделяется ртуть. Образовавшаяся ртуть на поверхности металла образует амальгаму алюминия. (Амальгамы — сплавы ртути с другими металлами.) Вследствие этого нарушается плотная структура защитной пленки, что дает возможность алюминию проявить свою химическую активность. Алюминий начинает энергично взаимодействовать с водой. При этом образуется гидроксид алюминия и выделяется водород.
На кусочек алюминиевой фольги нанесите несколько капель раствора нитрата ртути (П) и потрите поверхность смоченной солью ртути фольги стеклянной палочкой. Подождите 2-3 минуты. Что наблюдается?
Напишите уравнения реакций:
· взаимодействия нитрата ртути с алюминием
· взаимодействия лишенного защитной пленки (амальгамированного) алюминия с водой.
4 . Гальваническая (протекторная) защита
В две пробирки налейте по 1-2 мл 2 н. серной кислоты и по 2-3 капли гексацианоферрата (III) калия. В одну пробирку поместите стальную скрепку с зажатым в ней кусочком цинка, а в другую — скрепку с кусочком олова. Наблюдайте окрашивание раствора в первой пробирке в желтоватый цвет, вследствие образования труднорастворимой соли цинка 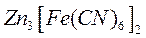
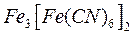
В первом случае мы имеем дело с гальваническим элементом железо — цинк :
а во втором – железо – олово:
Запишите значения величин стандартных электродных потенциалов для железа, цинка и олова (таблица 10 приложения):
Что является анодом, а что катодом в каждом из рассмотренных гальванических элементов?
Напишите схемы процессов, происходящих на катоде и аноде в кислой среде в этих гальванических элементах.
Напишите уравнения реакций получения окрашенных продуктов.
Какой из металлов разрушается, а какой защищен от разрушения в каждом рассмотренном гальваническом элементе?
По результатам опыта сделайте вывод: какой из металлов — олово или цинк — может быть использован в качестве протектора для защиты железа от коррозии.
5. Влияние ингибиторов на процесс коррозии.
В две пробирки налейте 1-2 мл разбавленного раствора соляной кислоты. В одну из пробирок добавьте 2-3 капли ингибитора (например, уротропина) В каждую пробирку добавьте по кусочку цинка. Через 2-3 минуты сравните интенсивность реакции в каждой пробирке. Объясните эффект действия ингибитора и напишите уравнение реакции растворения цинка в кислоте.
Видео:Электролиз. 10 класс.Скачать

Коррозия металлов
Цель работы — ознакомление с химической и электрохимической коррозией металлов.
Видео:Коррозия металла (часть 2). Химия – ПростоСкачать

Теоретическая часть
Коррозией металлов называется самопроизвольное разрушение металлов, происходящее в результате химического или электрохимического воздействия внешней среды.
По механизму процесса различают коррозию химическую и электрохимическую.
Химическая коррозия не сопровождается возникновением электрического тока и происходит при взаимодействии с металлами сухих газов и жидкостей, не являющихся электролитами.
Практически химическая коррозия проявляется чаще всего как газовая коррозия металлов при высоких температурах. При этом металл химически взаимодействует с газами O2; H2O; CO2;SO2;H2S и др. На поверхности металла образуется пленка продуктов коррозии, которая чаще всего представляет собой оксиды металлов. Если пленка препятствует проникновению коррозионной среды к поверхности металла, её называют защитной. Начальная стадия образования защитной пленки — чисто химический процесс. Дальнейшее течение процесса будет определяться скоростью диффузии атомов кислорода снаружи и ионов металла изнутри через защитную пленку.
При нагревании металлов (железа, меди) на воздухе тонкие, невидимые пленки оксидов начинают расти, и при толщине 400-500 Å становятся видимыми благодаря интерференции в них световых лучей. Вследствие этого возникают так называемые цвета побежалости: желтый, оранжевый, красный, фиолетовый, синий. Цвет пленки определяется её толщиной, а толщина зависит от температуры нагрева и от времени выдержки при данной температуре.
При дальнейшем нагреве железо и обычная углеродистая сталь быстро покрываются продуктами газовой коррозии, так называемой окалиной. Окалина имеет сложное строение. Толщина слоев различных оксидов в окалине зависит от условий коррозии: температуры, продолжительности нагревания и состава коррозионной среды. При температурах, превышающих 575 С, окалина состоит из слоев оксидов: FeO, Fe3O4, Fe2O3 (с промежуточными слоями из твердых растворов, соприкасающихся оксидов). К поверхности железа ближе других примыкает слой монооксида железа FeO, или вюстита. Вюстит имеет решетку с избытком анионов (ионов кислорода) и недостатком катионов (ионов железа). Наличие незанятых катионных узлов облегчает диффузию. Последующие слои представляют собой магнетит Fe3O4 и гематит Fe2O3. Поскольку окалина состоит главным образом из вюстита, она не обладает защитными свойствами.
При нагревании железа в атмосфере водяного пара протекает процесс окисления железа, водород при этом выделяется в свободном состоянии.
На поверхности меди при нагревании её на воздухе также образуется пленка продуктов коррозии, состоящая из различных оксидов. К поверхности металла примыкает слой полуокиси меди Cu2O, имеющий, подобно вюститу, решетку с недостатком катионов. Наружным слоем является слой монооксида меди CuO.
Наиболее распространена электрохимическая коррозия. Она протекает в электролитах и во влажных газах и представляет собой окислительно-восстановительные процессы на границе металл-электролит аналогично процессам, происходящим в гальваническом элементе.
По условиям протекания различают следующие виды электрохимической корро
1) коррозию в электролитах;
2) атмосферную коррозию;
4) коррозию под напряжением и др.
Чаще всего встречается атмосферная коррозия. На поверхности технических металлов и сплавов в атмосферных условиях всегда есть тонная пленка влаги, адсорбированной из воздуха. Эта пленка в результате растворения в ней газов, содержащихся в воздухе (главным образом углекислого газа), становится электропроводной. Это обусловливает работу микрогальванических элементов на поверхности металла, где роль анодов играют структурные составляющие металла, обладающие более отрицательным электродным потенциалом (например, участки феррита), а роль катодов — структурные составляющие или примеси, электродный потенциал которых более электроположителен (например, цементит Fe3C). Коррозионные элементы могут возникнуть при контакте двух различных, а также в результате любой микронеоднородности металлической поверхности: ликвация твердого раствора, различная ориентация отдельных зерен металла, наличие включений, границ зерен и другие факторы. Если на поверхности металла существует электропроводная пленка оксидов, сплошность которой нарушена, т. е. имеются оголенные участки металлической поверхности или поры в пленке, это также может являться причиной возникновения коррозионного элемента; при коррозии пленка будет представлять собой катод, металл-анод.
При электрохимической коррозии разрушению подвергаются лишь анодные участки поверхности. Здесь происходит переход ионов металла в электролит.
При коррозии железа на аноде протекает следующий процесс:
На катодных участках поверхности в нейтральных и щелочных средах осуществляется процесс ионизации кислорода, растворенного в электролите или в тонкой пленке влаги.
В подавляющем большинстве коррозионных процессов происходит именно эта реакция. В кислых средах на катоде разряжаются ионы водорода
Обе приведенные катодные реакции могут протекать совместно в зависимости от характера коррозионной среды и потенциалов электродов. Продукты электродных процессов в толще электролита или на поверхности металла в пленке влаги обычно взаимодействуют с образованием гидроксида железа (II) который в присутствии влаги и кислорода окисляется в гидроксид железа (III)
Состав продуктов коррозии стали (ржавчины) является неопределенным и может быть выражен общей формулой
При работе коррозионного элемента сила тока с течением времени уменьшается в результате изменения потенциалов электродов. Это явление называется поляризацией. Анодная поляризация — это смещение потенциала анода в положительную сторону в результате изменения концентрации ионов и, главным образом, вследствие образования на аноде оксидных пленок (явление пассивности). Катодная поляризация — это смещение потенциала катода в отрицательную сторону в результате затруднений в протекании катодной реакции (перенапряжение) и изменение концентрации кислорода у катода. Исследование процессов поляризации требует применения специальной аппарату ры.
Состав коррозионной среды оказывает больное влияние на скорость коррозии. Коррозия протекает тем более интенсивно, чем выше в растворе концентрация ионов водорода. Иную роль при коррозии железа играют ионы гидроксида. Эти ноны образуют с ионами железа труднорастворимые в щелочных средах гидроксиды. По этой причине железо в щелочных средах не корродирует.
Коррозия металлов может быть вызвана неравномерной концентрацией кислорода в растворе. Участки металлической поверхности, к которым доступ кислорода затруднен, являются анодными и подвергаются разрушению, в то время как участки поверхности, к которым доступ кислорода облегчен, играют роль катодов. Здесь легко протекает процесс ионизации находящегося в растворе кислорода.
Электрохимическая коррозия может быть значительно ускорена в присутствии небольшого количества веществ, называемых в соответствии с характером их действия ускорителями или стимуляторами.
Активными стимуляторами коррозии являются ионы галогенов. На поверхности металла в атмосферных условиях имеется оксидная пленка, которая может обладать защитным характером. Ионы галогена, адсорбируются на пленке и вытесняют кислород, как бы образуя хлорид, который переходит в раствор. В пленке возникают поры, облегчающие коррозию.
Состав коррозионной среды оказывает больное влияние на скорость коррозии. Коррозия протекает тем более интенсивно, чем выше в растворе концентрация ионов водорода. Иную роль при коррозии железа играют ионы гидроксида. Эти ноны образуют с ионами железа труднорастворимые в щелочных средах гидроксиды. По этой причине железо в щелочных средах не корродирует.
Коррозия металлов может быть вызвана неравномерной концентрацией кислорода в растворе. Участки металлической поверхности, к которым доступ кислорода затруднен, являются анодными и подвергаются разрушению, в то время как участки поверхности, к которым доступ кислорода облегчен, играют роль катодов. Здесь легко протекает процесс ионизации находящегося в растворе кислорода.
Электрохимическая коррозия может быть значительно ускорена в присутствии небольшого количества веществ, называемых в соответствии с характером их действия ускорителями или стимуляторами.
Активными стимуляторами коррозии являются ионы галогенов. На поверхности металла в атмосферных условиях имеется оксидная пленка, которая может обладать защитным характером. Ионы галогена, адсорбируются на пленке и вытесняют кислород, как бы образуя хлорид, который переходит в раствор. В пленке возникают поры, облегчающие коррозию.
Видео:Коррозия металловСкачать

Практическая часть
Электрохимическая коррозия
Опыт №1. Коррозия металлов при высоких температурах.
Цель работы: ознакомиться с коррозией металлов при высоких температурах.
Ход работы: С помощью наждачной бумаги хорошо очистить поверхность стальной пластинки. Взять тигельными щипцами стальную пластинку за один конец и нагрейте её с другого конца в бесцветном пламени горелки. При нагревании пластинку держать неподвижно относительно пламени горелки. Аналогичный опыт проделать с медной пластинкой.
Наблюдения: Сначала наблюдаем появление цветов побежалости. При более длительном нагревании поверхность пластинки принимает серый цвет окалины.
При проведении данного опыта с медной пластинкой наблюдаем, как цвета побежалости принимают чёрный цвет вследствие образования толстых слоёв непрозрачных оксидов меди.
Вывод: При высоких температурах процесс коррозии усиливается. Железная окалина имеет серый цвет, медная – чёрный.
Опыт №З. Коррозия при контакте двух различных металлов.
Цель работы: ознакомиться с коррозией при контакте двух различных металлов.
Ход работы: 
В трубку, согнутую под углом, налит разбавленный раствор серной кислоты.
В одно колено трубки вставляется полоса цинка. В другое колено вставляем медную проволоку, не соприкасая её с цинком.
Наблюдения: Выделение водорода на меди не наблюдается. Приводим металлы в соприкосновение. Наблюдаем выделение водорода на меди при контакте металлов. Наблюдаем выделение водорода.
Вывод: При контакте металлов выделяется водород.
Опыт №4. Образование микро коррозийных элементов.
Цель работы: ознакомиться с образованием микро коррозионных элементов.
Ход работы: К кусочку гранулированного цинка прилили несколько миллилитров разбавленной серной кислоты, прилили в пробирку несколько капель раствора сульфата меди
Наблюдения: Сначала началось медленное выделение водорода. После того, как прилили в пробирку несколько капель раствора сульфата меди, увеличилась скорость выделения водорода. Медный купорос (СuSO4) изменяет цвет с глубоко синего на голубой. Zn из белого покрывается плёнкой (Cu).
Вывод: При взаимодействии цинка с серной кислотой и сульфатом меди, цинк покрывается плёнкой из меди.
Опыт №5. Ионы Cl как активные стимуляторы коррозии.
Цель работы: ознакомиться с влиянием ионов Cl на процесс коррозии.
Ход работы: В две пробирки поместить небольшое количество алюминиевых стружек и прилить к ним раствор сульфата меди, слегка подкисленный серной кислотой. В одну пробирку добавить несколько капель раствора NaCl.
Наблюдения: В первый момент ничего не наблюдается. После добавления NaCl начинается реакция. Наблюдается выделение пузырьков. Выделяется медь. В пробирке с NaCl процесс ускорился при выделении меди.
Вывод: Ионы Cl являются активными стимуляторами коррозии. При добавлении NaCl процесс коррозии усиливается, реакция идёт быстрее.
Опыт №6. Коррозия железа в различных электролитах
Цель работы: ознакомиться с коррозией железа в различных электролитах.
Ход работы: Наливаем в пять пробирок до 1/4 объема:
1. дистиллированной воды
2. 10% раствора хлорида натрия
3. 10% раствора хлорида магния
4. 10% раствора едкого натра
В каждую пробирку погружаем одновременно по железному гвоздю или по куску железной проволоки приблизительно одинаковой длины. Добавляем растворы красной или желтой кровяной соли.
Наблюдения: Растворы во всех пробирках сначала прозрачные, бесцветные.
1. Раствор остаётся прозрачным, бесцветным. Практически ничего не наблюдается, т. к. коррозия незначительная.
2. Окрашивание раствора. Интенсивная коррозия.
3. Окрашивание раствора. Интенсивность коррозии повышается.
4. Коррозии нет, т. к. NaOH является ингибитором коррозии.
5. Наиболее сильное окрашивание раствора. Наибольшая интенсивность коррозии, т. к. Cl-окислитель.
Вывод: NaOH является ингибитором коррозии; Cl является окислителем.
Опыт №7. Роль кислорода воздуха в процессе атмосферной коррозии железа.
Цель работы: ознакомиться с ролью кислорода воздуха в процессе коррозии железа.
Ход работы: Собрали прибор по рис. 3. В колбу, смоченную раствором поваренной соли, поместили железные стружки, предварительно промытые и обезжиренные. Закрыли колбу пробкой с газоотводной трубкой. Конец трубки поместили в стакан с подкрашенной водой.
Наблюдения: По истечении некоторого времени подкрашенная вода в стакане начинает подниматься. Процесс протекает медленно.
Fe + O2 +H2O Fe + OH
Вывод: Кислород воздуха влияет на атмосферную коррозию железа, т. к. подкрашенная вода поднимается.
Опыт №8. Коррозия стали в результате неравномерной аэрации.
Цель работы: ознакомиться с коррозией стали в результате неравномерной аэрации.
Ход работы: На поверхность стальной пластинки наносим каплю ферроксил-индикатора, имеющего в 1л:
а) хлорида натрия 15 г;
б) агар-агара 2 г;
в) красной кровяной соли 10 г;
г) спиртового раствора фенолфталеина 1 мл.
Наблюдения: При нанесении капли ферроксил-индикатора на поверхность стальной пластинки она имеет синий цвет. По истечении некоторого времени цвет капли изменяется на розовый. Особо интенсивное окрашивание наблюдается по краю капли.
Fe + O2 +H2O Fe + OH
Вывод: Цвет капли ферроксил-индикатора изменяется на розовый, происходит коррозия стали в результате неравномерной аэрации.
Общий вывод: При высоких температурах процесс коррозии усиливается. Железная окалина имеет серый цвет, медная – чёрный. При контакте металлов выделяется водород. При взаимодействии цинка с серной кислотой и сульфатом меди, цинк покрывается плёнкой из меди. Ионы Cl являются активными стимуляторами коррозии. При добавлении NaCl процесс коррозии усиливается, реакция идёт быстрее. NaOH является ингибитором коррозии; Cl является окислителем. Кислород воздуха влияет на атмосферную коррозию железа, т. к. подкрашенная вода поднимается. Цвет капли ферроксил-индикатора изменяется на розовый, происходит коррозия стали в результате неравномерной аэрации.
1. Почему цинк, содержащий значительное количество примесей, растворяется в кислоте быстрее, чем цинк чистый? На поверхности металла образуется плёнка продуктов коррозии. Если плёнка препятствует проникновению коррозионной среды к поверхности металла, она является защитной. На цинке, сод. примеси образуется незащитная плёнка; на чистом цинке образуется защитная плёнка, препятствующая коррозии.
2. Какие факторы влияют на скорость коррозионных процессов?
Состав коррозионной среды оказывает больное влияние на скорость коррозии. Коррозия протекает тем более интенсивно, чем выше в растворе концентрация ионов водорода. Иную роль при коррозии железа играют ионы гидроксида. Эти ноны образуют с ионами железа труднорастворимые в щелочных средах гидроксиды. По этой причине железо в щелочных средах не корродирует.
Коррозия металлов может быть вызвана неравномерной концентрацией кислорода в растворе. Участки металлической поверхности, к которым доступ кислорода затруднен, являются анодными и подвергаются разрушению, в то время как участки поверхности, к которым доступ кислорода облегчен, играют роль катодов. Здесь легко протекает процесс ионизации находящегося в растворе кислорода.
Электрохимическая коррозия может быть значительно ускорена в присутствии небольшого количества веществ, называемых в соответствии с характером их действия ускорителями или стимуляторами.
Активными стимуляторами коррозии являются ионы галогенов Cl, Br, J. На поверхности металла в атмосферных условиях имеется оксидная пленка, которая может обладать защитным характером. Ионы галогена, например ионы Cl, адсорбируются на пленке и вытесняют кислород, как бы образуя хлорид, который переходит в раствор. В пленке возникают поры, облегчающие коррозию.
Защита металлов от коррозии
Теоретическая часть
Цель работы – ознакомление с основными способами защиты металлов от коррозии.
Разнообразные способы защиты металлов и сплавов от коррозии можно разделить на три основных вида; нанесение покрытий, обработка среды и электрохимическая защита.

Катодными называются такие покрытия, у которых электродный потенциал металла покрытия имеет более положительное значение, чей электродный потенциал основного металла (например, слой олова на железе). При работе коррозионного элемента, составленного из таких металлов, разрушению будет подвергаться основной металл. Следовательно, катодное покрытие защищает металл от коррозии только механически (рис. 2)

При оксидировании стальных деталей на их поверхности образуется оксидная пленка черного цвета, состоящая преимущественно из магнетита Fe3O4.
Среди различных способов оксидирования сталей наибольшее распространение имеет щелочной метод, предложенный доцентом .
Защитные свойства оксидного слоя могут быть повышены путем промасливания только что нанесённого слоя.
Фосфатирование изделий из железа, цинка и сплавов на основе этих металлов осуществляют нагреванием в 3%-ном растворе препарата «Мажеф», который представляет собой смесь дигидрофосфатов марганца и железа. Эти соли в растворе диссоциируют с образованием фосфат — и гидрофосфат-ионов.
Процесс фосфатировання имеет электрохимический характер. На катодных участках металлической поверхности выделяется водород:
На анодных участках ионы металла переходят в раствор:
Ионы металлов образуют с фосфат — и гидрофосфат-ионами труднорастворимые двухзамещенные и нормальные фосфаты, которые кристаллизуются на металлической поверхности в виде темно-серого осадка.
Фосфатные покрытия слабо предохраняют металлы от коррозии и большей частью применяются в качестве грунта под окраску. Защитные свойства их могут быть повышены пропиткой минеральными маслами или раствором K2Cr2O7.
Электрохимическая коррозия может быть в большой мере замедлена в присутствии небольших количеств веществ, называемых в соответствии с характером их действия замедлителями, или ингибиторами.
Ингибиторы коррозии бывают неорганического и органического происхождения. Они широко применяются для защиты металлов. Из неорганических замедлителей часто используются хроматы, нитриты, силикаты и другие вещества. Механизм их действия различен и сводится к образованию защитных пленок. Ионы CrO42+ или Cr2O72- адсорбируются на активных участках металлической поверхности, делая невозможной коррозию.
Аналогичную роль могут играть полярные молекулы ряда органических веществ, в состав которых входят кислород, сера или азот (амины, пиридин, уротропин и др.).
Среди методов защиты металлов от коррозии особое место занимает электрохимическая защита. Этот метод защиты применим только в токопроводящей среде. Сущность метода заключается в том, что вся поверхность подлежащего защите металлического сооружения искусственно делается катодом. На практике это осуществляется в основном двумя способами.
1) Катодная защита. При этом защищаемое сооружение присоединяют к катоду внешнего источника постоянного тока. В качестве анода используют дополнительный электрод (металлический стержень или пластинку), который подвергается разрушению, предохраняя тем самим от коррозии защищаемое сооружение.
2) Протекторная защита. Защищаемый металлический объект приводят в контакт с другим металлом, имеющим болей отрицательный электродный потенциал, чей защищаемый металл. Деталь из более активного металла называется протектором. В образовавшейся гальванической паре протектор является анодом, 8 защищаемый металлический объект — катодом. В этих условиях протектор постепенно разрушается, а коррозия металлической конструкции почти прекращается.
При помощи электрохимической защиты предохраняют от коррозии морские суда, буи, сваи и эстакады, сооруженные в воде, подземные и подводные трубопроводы, силовые кабели, кабели связи, внутренние поверхности резервуаров, химическую и теплообменную аппаратуру и пр.
Практическая часть
Опыт №1. Коррозия оцинкованного и лужёного железа в кислом растворе.
Цель работы: ознакомиться с коррозией оцинкованного и лужёного железа в кислом растворе.
Ход работы: В две пробирки налить по 5 мл воды, прибавить в каждую по две капли 10%-ной серной кислоты и по две капли раствора красной кровяной соли.
В одну пробирку опустить кусочек лужёного железа (от консервной банки), в другую – кусочек оцинкованного железа.
Наблюдения: Железо, покрытое цинком, наблюдается выделение пузырьков, синее окрашивание. В пробирке с железом, покрытым оловом – ничего не наблюдается.
Вывод: В кислом растворе происходит коррозия оцинкованного железа, с лужёным железом – ничего не происходит.
Опыт №5. Хроматирование цинка.
Цель работы: ознакомиться с хроматированием цинка.
Ход работы: Налить в пробирку немного 0,1 н раствора соляной кислоты и опустить кусочек цинка, потом бросить несколько кристаллов бихромата калия.
Наблюдения: При опускании цинка в соляную кислоту наблюдается выделение пузырьков водорода. При добавлении кристаллов бихромата калия K2Cr2O7 прекращается выделение водорода, реакция замедляется. K2Cr2O7 является ингибитором коррозии.
Вывод: K2Cr2O7 является ингибитором коррозии, реакция замедляется.
Опыт №7. Электрохимическая защита.
Цель работы: ознакомиться с электрохимической защитой.
а) Катодная защита.
Ход работы: В два стакана наливаем 3%-ный раствор NaCl. В оба стакана добавляем несколько капель раствора красной кровяной соли K3[Fe(CN)6]. В один из стаканов опускаем в качестве анода уголь, а в качестве катода — железный образец. Соединяем электроды с плюсами источника постоянного тока. Для сравнения другой железный образец опускаем во второй стакан.
Наблюдения: Наблюдаем появление турнбулевой сини.
При включении тока:
A: Cl -2e Cl2
Вывод: При пропускании тока через раствор коррозии железа нет.
б) Протекторная защита.
Ход работы: В два стакана наливаем разбавленного раствора уксусной кислоты (0,5н). В каждый стакан прибавляем несколько капель раствора йодида калия. В один стакан поместим цинковый и свинцовый образцы в контакте друг с другом. Во второй стакан опускаем один свинцовый образец.
Наблюдения: В пробирке с одним свинцом коррозия идёт. В пробирке с цинком и свинцом коррозии нет, т. к. цинк является протектором по сравнению со свинцом. Цинк является анодом, свинец-катодом.
Вывод: Цинк является протектором коррозии по сравнению со свинцом.
Общий вывод: В кислом растворе происходит коррозия оцинкованного железа, с лужёным железом – ничего не происходит. K2Cr2O7 является ингибитором коррозии, реакция замедляется. При пропускании тока через раствор коррозии железа нет. Цинк является протектором коррозии по сравнению со свинцом.
1. Приведите примеры анодных и катодных покрытий.
Катодными называются такие покрытия, у которых электродный потенциал металла покрытия имеет более положительное значение, чей электродный потенциал основного металла (например, слой олова на железе). При работе коррозионного элемента, составленного из таких металлов, разрушению будет подвергаться основной металл. Следовательно, катодное покрытие защищает металл от коррозии только механически.
Анодные: железо, алюминий, цинк.
Катодные: олово, медь.
2. В чём сущность электрохимической защиты металлов от коррозии?
Среди методов защиты металлов от коррозии особое место занимает электрохимическая защита. Этот метод защиты применим только в токопроводящей среде. Сущность метода заключается в том, что вся поверхность подлежащего защите металлического сооружения искусственно делается катодом.
Видео:Гальванические элементы. 1 часть. 10 класс.Скачать

Лабораторная работа по химии №4
«Коррозия металлов. Защита металлов от коррозии.»
📽️ Видео
Электрохимическая коррозия (алюминий — медь)Скачать

Коррозия металлов и способы защиты от нееСкачать

Часть 3-2. Электролиз водных растворов. Примеры решений уравнений (подробно).Скачать

Химия 11 класс (Урок№9 - Коррозия металлов и её предупреждение.)Скачать

§13, 9 кл. Коррозия металловСкачать

Химия 9 Коррозия металловСкачать

Взаимодействие алюминия с водойСкачать

6 способов защиты от коррозииСкачать

Электролиз. Часть 1. Процесс электролиза, основные закономерности.Скачать

Роль кислорода в процессе коррозии железаСкачать

Защитные свойства анодного покрытияСкачать

МЕДНЕНИЕ СТАЛЬНЫХ ДЕТАЛЕЙ ЗА 2 СЕКУНДЫ!!!Скачать

Ускоренное ржавлениеСкачать