- Выход хрома по току. Электролиз сульфата хрома
- Коррозия сплава Sn – Zn
- а) Коррозия пары металлов Zn/Sn в атмосфере влажного газа:
- Коррозия железа. Катодное и анодное покрытие железа
- а) Коррозия железной пластинки покрытой свинцом в растворе серной кислоты
- б) Коррозия железной пластинки покрытой титаном в растворе серной кислоты
- Please wait.
- We are checking your browser. gomolog.ru
- Why do I have to complete a CAPTCHA?
- What can I do to prevent this in the future?
- Электрохимическая коррозия металлов
- 📹 Видео
Видео:Электрохимическая коррозияСкачать

Выход хрома по току. Электролиз сульфата хрома
Задача 153.
Деталь хромируется в водном растворе Сr2(SО4)3. Сила тока – 3 А. Определить продолжительность электролиза, если на поверхности детали необходимо нанести электрокристаллизацией 1,3 г хрома и если выход по току принять равным 40%.
Решение:
Для решения задачи используем уравнение:
Bm = (mf . n . F * 100%)/(М . I . t), где
Bm — выход по току (40%); mf — масса металла на детали при электролизе, 1,3 г; I — сила тока, 3,0 А; t — время проведения электролиза, с; F — число Фарадея, 96500 Кл; М — молярная масса (для хрома М = 52 г/моль); n — заряд иона в единицах e (ионы хрома в растворе сульфата хрома имеют заряд n = +3).
Подставляя полученную формулу в выражение для продолжительность электролиза, получим:
t = (mf . n . F . 100%)/(Bm . M . I).
Приведя заданные значения к одной системе размерностей, проведём вычисление:
t = (3,25 . 3 . 96500 . 100%)/(40% . 52 . 3) = 6031,25 с.
Ответ: t = 6031,25 с.
Коррозия сплава Sn – Zn
Задача 154.
Составьте электронные уравнения процессов, происходящих при коррозии сплава Sn – Zn в кислой среде и во влажном воздухе. Рассчитайте ЭДС для этого контакта. Какие продукты коррозии будут образовываться в каждой среде?
Решение:
Стандартные электродные потенциалы цинка и олова равны соответственно -0,762 В и -0,136 В. Окисляться, т.е. подвергаться коррозии, будет цинк. Цинк имеет более электроотрицательный стандартный электродный потенциал (-0,763 В), чем олово (-0,180 В), поэтому он является анодом, олово – катодом.
а) Коррозия пары металлов Zn/Sn в атмосфере влажного газа:
Анод Zn 0 – 2 
Катод 1/2O2 + H2O + 2 
Так как ионы Zn 2+ с гидроксид-ионами ОН – образуют малорастворимый гидроксид, то продуктом коррозии будет Zn(OH)2:
б) Коррозия пары металлов Zn/Sn в кислой среде:
Анод Zn 0 – 2 
Катод 2Н + + 2 
Схема коррозии:
Zn + 2H + = Zn 2+ + H2↑
При этом выделяется газообразный водород. Происходит интенсивное разрушение цинка, продуктом коррозии будет газообразный водород и соединение цинка с кислотным остатком (соль).
Таким образом, при контакте цинка и олова коррозии будет подвергаться цинк.
Для определения ЭДС гальванического элемента необходимо из потенциала катода вычесть потенциал анода, т е. при вычислении ЭДС элемента меньший электродный потенциал вычитается из большего (в алгебраическом смысле), получим:
ЭДС = -0,136 — (-0,763) = +0,627 B.
Ответ: +0,627 B.
Коррозия железа. Катодное и анодное покрытие железа
Задача 155.
В раствор серной кислоты поместили две железных пластинки, одна из которых частично покрыта свинцом, а другая титаном. В каком случае процесс коррозии железа протекает менее интенсивно? Ответ мотивируйте с помощью расчета ЭДС. Составьте электронные уравнения анодного и катодного процессов. О каком покрытии идет речь в каждом случае?
Решение:
Стандартные электродные потенциалы железа, свинца и титана равны соответственно -0,440 В, -0,126 В и -1,750 В.
а) Коррозия железной пластинки покрытой свинцом в растворе серной кислоты
Окисляться, т.е. подвергаться коррозии, будет железо. Железо имеет более электроотрицательный стандартный электродный потенциал (-0,440 В), чем свинца (-0,126 В), поэтому оно является анодом, свинец – катодом.
Анод Fе 0 – 2 
Катод 2Н + + 2 
Fe 0 + 2H + = Fe 2+ + H2↑
Так как ионы Fe 2+ с ионами SO4 2- образуют растворимую соль, придающую светло-бурую окраску раствора, то продуктом коррозии будет FeSO4:
Образуется сульфат железа и при этом выделяется газообразный водород. Происходит интенсивное разрушение железной пластинки.
Таким образом, при контакте железа и свинца коррозии в растворе кислоты будет подвергаться железо.
Для определения ЭДС гальванического элемента необходимо из потенциала катода вычесть потенциал анода, т е. при вычислении ЭДС элемента меньший электродный потенциал вычитается из большего (в алгебраическом смысле), получим:
ЭДС = -0,136 — (-0,763) = +0,627 B.
Так как потенциал свинца выше потенциала железа, то покрытие железа свинцом является катодным покрытием.
б) Коррозия железной пластинки покрытой титаном в растворе серной кислоты
Окисляться, т.е. подвергаться коррозии, будет титан. Титан имеет более электроотрицательный стандартный электродный потенциал (-1,750 В), чем железа (-0,440 В), поэтому он является анодом, железо – катодом.
Анод Ti 0 – 2 
Катод 2Н + + 2 
Ti 0 + 2H + = Ti 2+ + Н2↑
Так как ионы Ti 2+ с ионами SO4 2- образуют растворимую соль, то продуктом коррозии будет TiSO4:
Образуется сульфат титана и при этом выделяется газообразный водород. Происходит интенсивное разрушение титанового покрытия.
Таким образом, при контакте железа и титана коррозии в растворе кислоты будет подвергаться титан.
Для определения ЭДС гальванического элемента необходимо из потенциала катода вычесть потенциал анода, т е. при вычислении ЭДС элемента меньший электродный потенциал вычитается из большего (в алгебраическом смысле), получим:
ЭДС = -0,44 — (-1,750) = +1,31 B.
Так как потенциал титана отрицательнее потенциала железа, то покрытие железа титаном является анодным покрытием.
Таким образом, процесс коррозии железа протекает менее интенсивно в случае покрытия железной пластинки титаном.
Видео:Коррозия металла. Химия – ПростоСкачать

Please wait.
Видео:Опыт 1. Электрохимическая коррозия в кислой средеСкачать

We are checking your browser. gomolog.ru
Видео:Химическая коррозияСкачать

Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
Видео:§13, 9 кл. Коррозия металловСкачать

What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6de2183cdc8d973a • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Видео:Гальванические элементы. 1 часть. 10 класс.Скачать

Электрохимическая коррозия металлов
Коррозией металлов называют самопроизвольное разрушение металлов под действием различных окислителей из окружающей среды.
В реальных условиях коррозии обычно подвергаются технические металлы, содержащие примеси других металлов и неметаллических веществ.
Механизм электрохимической коррозии в таких металлах аналогичен механизму процессов, протекающих в короткозамкнутых гальванических элементах, в которых на участках с более отрицательным потенциалом идет процесс окисления (разрушение металлов), а на участках с более положительным потенциалом процесс восстановления окислителя (коррозионной среды).
Наиболее часто встречаются окислители (деполяризаторы):
· ионы водорода (коррозия с водородной деполяризацией)
2Н + + 2 ē = Н 2 (в кислой среде),
2Н2О + 2 ē = Н2 + 2ОН — (в нейтральной и щелочной средах);
O2 + 4 ē + 4Н + = 2Н2О (в кислой среде);
О2 +4 ē + 2Н2О = 4ОН — (в щелочной и нейтральной средах).
Методика рассмотрения работы гальванопары при электрохимической коррозии.
· Составляют схему гальванопары:
· Выписывают стандартные потенциалы металлов и окислителей коррозионной среды (табл.П.7), определяют восстановитель (меньший потенциал), окислитель (больший потенциал).
· Записывают уравнения процессов окисления и восстановления и суммарное уравнение окислительно-восстановительной реакции, протекающей при гальванокоррозии.
· Указывают направление движения электронов.
Пример 1.Гальванопара алюминий —железо в воде (среда нейтральная). В воде растворен кислород.
· Схема гальванопары Al / H2O, O2 / Fe
· Потенциалы 


Восстановитель – Al, окислитель — О2.


· Направление движения электронов от участка с меньшим потенциалом к участку с большим потенциалом:


Пример 2. Определить процессы, протекающие при коррозии луженого железа (среда – влажный воздух, содержащий кислород, пары воды и ионы Н + ), если нарушена сплошность покрытия.
· Потенциалы: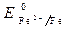


Восстановитель – железо, окислитель – кислород.


2Fe + О2 + 4Н + = 2Fe 2+ + 2Н2О
При нарушении целостности покрытия будет разрушаться Fe.
· Электроны движутся от участка с меньшим потенциалом к участку с большим потенциалом:


Пример 3. Рассмотреть коррозию детали из железа и алюминия в щелочной среде (КОН), если растворенный кислород отсутствует.
· Схема гальванопары: Al / КОН/ Fe
· Потенциалы: 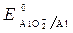


· 
Fe(+): 3 2 H2O + 2 ē = 2 OH — + H2 – процесс восстановления
2 Al + 2 OH — + 2H2O = 2 AlO2 — + 3 H2
· Направление перемещения электронов в системе:


Задание к подразделу 4.4
Рассмотрите коррозию гальванопары, используя потенциалы (табл. П.7), укажите анод и катод соответствующей гальванопары в различной коррозионной среде, рассчитайте ЭДС, напишите уравнения анодного и катодного процессов, молекулярное уравнение реакции коррозии, укажите направление перемещения электронов в системе.
| Номер задания | Коррозионная среда | ||
| а) H2O + O2 | б) NaOH + H2O | в) H2O + Н + | |
| 321. | Fe / Zn | Zn / Al | Pb / Zn |
| 322. | Fe / Ni | Fe / Zn | Al / Cu |
| 323. | Pb / Fe | Cd / Cr | Al / Ni |
| 324. | Cu / Zn | Al / Cu | Sn / Cu |
| 325. | Zn / Fe | Fe / Cr | Co / Al |
| 326. | Zn / Al | Pb / Zn | Cr / Ni |
| 327. | Cr / Cu | Pb / Cr | Bi / Ni |
| 328. | Cu / Al | Cr / Zn | Fe / Mg |
| 329. | Zn / Sn | Mg / Cd | Cr / Bi |
| 330. | Co / Mg | Zn / Fe | Pb / Al |
| 331. | Pb / Zn | Bi / Ni | Cd / Al |
| 332. | Bi / Ni | Cu / Zn | Fe / Ni |
| 333. | Fe / Mg | Fe / Cu | Co / Cd |
| 334. | Sn / Fe | Pb / Zn | Cr / Fe |
| 335. | Cr / Fe | Fe / Mg | Co / Cu |
| 336. | Fe / Cr | Cr / Cu | Cr / Cu |
| 337. | Fe / Cu | Cd/ Zn | Cd/ Zn |
| 338. | Zn / Cu | Cr / Ni | Cr / Cd |
| 339. | Mg / Cu | Cr / Cd | Zn / Al |
| 340. | Sn / Cu | Bi / Ni | Bi / Ni |
Электролиз растворов
Электролиз – это совокупность окислительно-восстановительных процессов, происходящих при прохождении электрического тока через электрохимическую систему, состоящую из двух электродов и электролита.
Электрод, на котором происходит восстановление, называется катодом, он заряжен отрицательно. Электрод, на котором происходит окисление, называется анодом, он заряжен положительно.
При электролизе водных растворов могут протекать процессы, связанные с электролизом воды, т.е. растворителя.
Катодные процессы
На катоде возможно восстановление:
· катионов металла Ме n+ + nē = Me;
· катиона водорода (свободного или в составе молекул воды):
2H + + 2ē = H 2 ( в кислой среде) ;
2H2O + 2 ē =H 2+ 2 OH — ( в нейтральной и щелочной средах).
Для выбора приоритетного процесса следует сравнить стандартные электродные потенциалы металла и водорода (табл. П.6, П.7). Потенциал восстановления катионов водорода необходимо использовать с учетом перенапряжения, 
1. Активные металлы (Li — Al) из-за низкой окислительной способности их ионов на катоде не осаждаются, вместо них идет восстановление ионов водорода.
2. Металлы средней активности (Mn, Zn, Fe, Sn) могут осаждаться на катоде с одновременным выделением водорода.
3. Малоактивные металлы (стоящие в ряду напряжений после водорода) из-за высокой окислительной способности их ионов осаждаются на катоде без выделения водорода.
Анодные процессы
На аноде возможны процессы окисления:
· материала анода Ме — nē = Me n +
Анионы кислородосодержащих кислот, имеющие в своем составе атом
элемента в высшей степени окисления (SO4 2 — , NO3 — и др.), при электролизе водных растворов на аноде не разряжаются.
С учетом перенапряжения величину потенциала выделения кислорода нужно считать равной 1,8 В.
Пример 1. Электролиз водного раствора сульфата калия с инертными электродами:


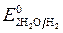
Так как


происходит восстановление воды: 2H2O — 4ē = O2 + 4 H +
среда щелочная среда кислая
Пример 2. Электролиз водного раствора хлорида олова с инертными электродами:
SnCl 2 = Sn 2+ + 2Cl —





Так как


ионов олова: Sn 2+ + 2 ē = S n 2Cl — — 2 ē = Cl 2
Пример 3. Электролиз сульфата меди с медным анодом:

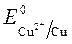



Так как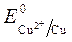

происходит восстановление Так как 
ионов меди:Cu 2+ +2ē = Cu анод растворяется: Cu — 2ē = Cu 2+
Количественные соотношения при электролизе определяют в соответствии с законами, открытыми М. Фарадеем (1834).
Обобщенный закон Фарадея связывает количество вещества, образовавшегося при электролизе, со временем электролиза и силой тока:

где m — масса образовавшегося вещества , г;
М — молярная масса вещества, г/ моль;
n — количество электронов, участвующих в электродном процессе;
t — время электролиза, с;
F — константа Фарадея (96500 Кл/моль).
Для газообразных веществ, выделяющихся при электролизе, формулу использют в виде 
где V— объем газа, выделяющегося на электроде; V 0 — объем 1 моль газообразного вещества при нормальных условиях (22,4 л/моль).
Пример 4. Рассчитать массу олова и объем хлора при нормальных условиях, выделившихся при электролизе раствора хлорида олова с инертными электродами в течение 1 часа при силе тока 4А.
Решение.


Задание к подразделу 4.5
Рассмотрите катодные и анодные процессы при электролизе водных растворов веществ. Процессы на электродах обоснуйте значениями потенциалов (табл. П.6,7,8). Составьте схемы электролиза с инертными электродами водных растворов предложенных соединений (отдельно два раствора) с инертными электродами либо растворимым анодом. Рассчитайте массу или объем (при нормальных условиях для газов) продуктов, выделяющихся на электродах при пропускании через раствор в течение 1 часа тока силой 1 А.
📹 Видео
Коррозия металловСкачать

Электрохимическая коррозия (алюминий — медь)Скачать

Коррозия металлов и способы защиты от нееСкачать

Опыт: электрохимическая коррозияСкачать

Коррозия металлов и меры по ее предупреждению. 8 класс.Скачать

Ингибиторы коррозииСкачать

Химия 11 класс (Урок№9 - Коррозия металлов и её предупреждение.)Скачать

Опыты по химии. Электрохимическая коррозия на примере меди и железаСкачать

Коррозия металлов и её предупреждениеСкачать

Часть 3-2. Электролиз водных растворов. Примеры решений уравнений (подробно).Скачать

Межкристаллитная коррозияСкачать

Химия 9 Коррозия металловСкачать

КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать

Коррозия нефтегазового оборудованияСкачать