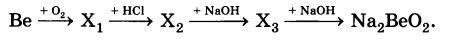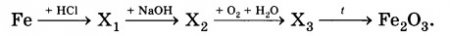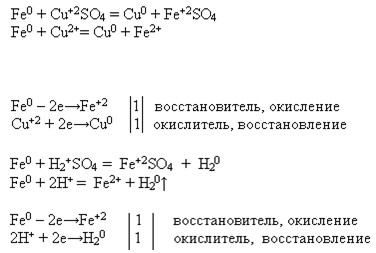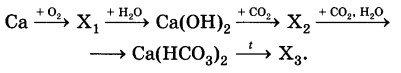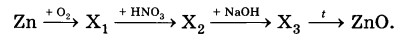- Основные разделы
- Контрольные работы
- Ответы на контрольную работу по теме «Металлы»(Габриелян)
- Дидактический материал. Контрольная работа по теме «Металлы»(9 класс)
- Краткое описание документа:
- Профилактика синдрома «профессионального выгорания» у педагогов
- Педагогические основы деятельности учителя общеобразовательного учреждения в условиях ФГОС
- Педагогические основы деятельности учителя общеобразовательного учреждения в условиях ФГОС
- «Домашнее обучение. Лайфхаки для родителей»
- Дистанционные курсы для педагогов
- Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
- Другие материалы
- Вам будут интересны эти курсы:
- Оставьте свой комментарий
- Автор материала
- Дистанционные курсы для педагогов
- Подарочные сертификаты
- Контрольная работа №1 по теме «Металлы» 9 класс.
- Просмотр содержимого документа «Контрольная работа №1 по теме «Металлы» 9 класс.»
- Контрольная работа по теме «Металлы» 9 класс тест по химии (9 класс)
- Скачать:
- Предварительный просмотр:
- 🎥 Видео
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Основные разделы
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Контрольные работы
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Ответы на контрольную работу по теме «Металлы»(Габриелян)
- Post category:Контрольные работы по химии 9 класс
- Reading time: 12 минут чтения
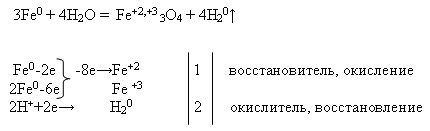
ЗАДАНИЕ 1
Напишите уравнения возможных реакций взаимодействия натрия и цинка с веществами: хлором, водой, соляной кислотой.
Рассмотрите одну из записанных реакций в свете ОВР.
2Nа + 2Н2О = 2NаОН + Н2
2Nа + 2НСl = 2NаСl + Н2
2Nа + Cl2 = 2NаСl
Zn + Cl2 = ZnCl2
Zn0 -2e→Zn2+ окисляется, восстановитель
Cl20+2e→2Cl- восстанавливается, окислитель
Zn + H2O = ZnO + H2.
Zn + 2HCl = ZnCl2 + H2
ЗАДАНИЕ 2
Напишите уравнения реакций, с помощью которых можно осуществить превращения по схеме
Fe →FeCl2 →Fe(N03)2 →Fe(OH)2 →FeO.
Превращение 3 рассмотрите в свете ТЭД.
Fe + 2HCl = FeCl2 + H2
FeCl2 + 2AgNO3 = 2AgCl + Fe(NO3)2
Fe(NO3)2 + 2NaOH = Fe(OH)2 + 2NaNO3
Fе2++ 2NO3-+ 2Na++2OH- =2Na++2NO3-+ Fе(ОН)2
Fе2++ 2OH- = Fе(ОН)2
Fе(ОН)2= FеО+ Н2О
ЗАДАНИЕ 3
При взаимодействии 12 г магния с избытком соляной кислоты выделилось 10 л водорода (н. у.). Вычислите объемную долю выхода продукта реакции.
Mg + 2HCl = MgCl2 + H2
n (Mg) = 12/24 = 0,5 моль
V (H2) = 10/22,4 = 0,446 моль
n (Mg) = n (H2) по уравнению (теор.)
выход = 0,446 /0,5 = 0,89 = 89 %
ЗАДАНИЕ 1
Напишите уравнения возможных реакций лития и меди с веществами: хлором, водой, соляной кислотой.
Рассмотрите одну из записанных реакций в свете ОВР.
2Li + Cl2 = 2LiCl
2Li + 2H2O = 2LiOH + H2
2Li + 2HCl = 2LiCl + H2
Cu + Cl2 = CuCl2
Cu + H2O = не реагирует
Cu + HCl = не реагирует
2Li+CL2= 2LiCL
Li- e—> Li+ восстановитель
CL2+2e—-> 2CL- окислитель
ЗАДАНИЕ 2
Напишите уравнения реакций, с помощью которых можно осуществить превращения по схеме
Са →CaO →Са(ОН)2 →Ca(N03)2 → Са3(Р04)2.
Превращение 3 рассмотрите в свете ТЭД.
2Ca+O2=2CaO
CaO+2NaOH=Ca(OH)2+Na2O
2HNO3 + Ca(OH)2 =Ca(NO3)2 + 2H2O
2H+ +2NO3- + Ca(OH)2 =Ca2+ +2NO3- + 2H2O
2H+ + Ca(OH)2 =Ca2+ +2H2O
3Ca(NO3)2 + 2Н3PO4 = Ca3(PO4)2 + 6HNO3
ЗАДАНИЕ 3
При термическом разложении 10 г известняка было получено 1,68 л углекислого газа (н. у.). Вычислите объемную долю выхода продукта реакции.
CaCO3 = CaO+CO2
n (CaCO3) = 10/100 = 0,1 моль
V (CO2) = 1,68/22,4 = 0,075 моль
n (CaCO3) = n (CO2) по уравнению (теор.)
выход = 0,075/0,1 = 0,75 = 75 %
ЗАДАНИЕ 1
Напишите уравнения возможных реакций кальция и железа с веществами: хлором, водой, соляной кислотой.
Рассмотрите одну из записанных реакций в свете ОВР.
Са + Cl2 = CaCl2
Ca + 2HCl = CaCl2 + H2
Ca + 2H2O = Ca(OH)2 + H2
2Fe + 3Cl2 = 2FeCl3
Fe + 2HCl = FeCl2 + H2
ЗАДАНИЕ 2
Напишите уравнения реакций, с помощью которых можно осуществить превращения по схеме:
Аl →Аl203 →АlСl3 →Аl(ОН)3 →Al(N03)3.
Превращение 3 рассмотрите в свете ТЭД.
4Al + 3O2 = 2 Al2O3
Al2O3 + 6HCl = 2AlCl3 + 3H2O
AlCl3 + 3NH3 + 3H2O = Al(OH)3 + 3NH4Cl
Al3+ +3Cl- + 3NH3 + 3H2O = Al(OH)3 + 3NH4+ +Cl-
Al3+ + 3NH3 + 3H2O = Al(OH)3 + 3NH4+
Аl(ОН)3+3НNО3=Аl(NО3)3+3Н2О.
ЗАДАНИЕ 3
При взаимодействии 23 г натрия с водой было получено 8,96 л водорода (н. у.). Найдите объемную долю выхода продукта реакции (в %).
2Na + 2H2O = 2NaOH + H2 ↑
n (Na) = 23/23= 1 моль
V (H2) = 8,96/22,4 = 0,4 моль
n (Na) : n (H2) = 2:1
n (H2) = 1/ 2 = 0,5 моль по уравнению (теор.)
выход = 0,4/0,5 = 0,8 = 80 %
ЗАДАНИЕ 1
Напишите уравнения возможных реакций металлов калия и магния с хлором, водой, соляной кислотой.
Рассмотрите одну из этих реакций в свете ОВР.
2K + 2H2O = 2KOH + H2.
2К + CI2 = 2КCI
2К + 2HCI = 2КCI + H2
Mg + 2HCl = MgCl2 + H2
Mg + Cl2 = MgCl2
Mg 0 -2e→ Mg 2+ окисляется, восстановитель
Cl20+2e→2Cl- восстанавливается, окислитель
Mg+2H2O=Mg(OH)2+H2
ЗАДАНИЕ 2
Напишите уравнения реакций для данных переходов:
Li →Li20 →LiOH →Li2S04.
Превращение 3 рассмотрите в свете ТЭД.
4Li + O2 = 2Li2O
Li2O + H2O = 2LiOH
2LiOH + Н2SO4 = Li2SO4 + 2Н2О
2Li+ +2OH- + 2Н+ +SO42- = 2Li+ +SO42- + 2Н2О
2OH- + 2Н+ — = 2Н2О
ЗАДАНИЕ 3
При взаимодействии 60 г кальция с водой выделилось 30 л водорода (н. у.). Найдите объемную долю выхода продукта реакции.
Са + 2Н2О = Са(ОН)2 + Н2
n (Са) = 60/40= 1,5 моль
V (H2) = 30/22,4 = 1,34 моль
n (Са) = n (H2) = по уравнению (теор.)
выход = 1,34/1,5 = 0,89 = 89 %
ЗАДАНИЕ 1
Напишите уравнения возможных реакций магния и алюминия с веществами: кислородом, бромом, разбавленной серной кислотой.
Рассмотрите две из этих реакций в свете ОВР, а одну — в свете ТЭД.
2 Мg + O2 = 2 МgО
Мg 0 -2e→ Мg 2+ окисляется, восстановитель
О20+4e→2 О 2- восстанавливается, окислитель
Мg + Br 2 = Мg Br2
Мg 0 -2e→ Мg 2+ окисляется, восстановитель
Br 20+2e→2 Br — восстанавливается, окислитель
Мg + Н2SO4 = МgSО4 + Н2
Мg + 2Н+ = Мg2+ + Н2
4Al + 3O2 = 2Al2O3,
2Al + 3H2SO4 = Al2(SO4)3 + 3H2
2Al + 3Br2 = 2AlBr3
ЗАДАНИЕ 2
Определите формулы веществ Х1 и Х2 в цепочке превращений:
Са →Х1 →Са(ОН)2 →Х2 →Са(НС03)2.
Напишите уравнения реакций, с помощью которых можно осуществить превращения по данной схеме.
2Ca+O2=2CaO
CaO+H2O=Ca(OH)2
Ca(OH)2 + CO2 = CaCO3 ↓ + H2O
CaCO3 + CO2 + H2O ↔ Ca(HCO3)2
ЗАДАНИЕ 3
При взаимодействии 12 г магния с избытком соляной кислоты выделилось 10 л водорода (н. у.). Вычислите объемную долю выхода продукта реакции (в %).
Mg + 2НСl = MgCl2 + Н2
n (Mg) = 12/24= 0,5 моль
n (H2) = n (Mg) по уравнению (теор.)
n (H2) = 10/22,4 = 0,44 моль (пр.)
ŋ = V (H2) (пр.)/ V (H2) (теор.) = n (H2) (пр.)/ n (H2) (теор.) = 0,44/0,5 = 0,89 = 89%
ЗАДАНИЕ 1
Напишите уравнения возможных реакций меди и магния с веществами: кислородом, иодом, разбавленной серной кислотой.
Рассмотрите две из этих реакций в свете ОВР, а одну — в свете ТЭД.
2Cu + O2 = 2CuO
2Cu + I2 = 2CuI
Cu + H2SO4 = не идет
2 Мg + O2 = 2 МgО
Мg 0 -2e→ Мg 2+ окисляется, восстановитель
О20+4e→2 О 2- восстанавливается, окислитель
Мg + Н2SO4 = МgSО4 + Н2
Мg + 2Н+ = Мg2+ + Н2
Мg + I 2 = Мg I 2
Мg 0 -2e→ Мg 2+ окисляется, восстановитель
I 20+2e→2 I — восстанавливается, окислитель
ЗАДАНИЕ 2
Определите формулы веществ X1 и Х2 в цепочке превращений:
Zn →Х1→ ZnS04 →Х2 →ZnO.
Напишите уравнения реакций, с помощью которых можно осуществить превращения по данной схеме.
2Zn + O2 = 2ZnO
ZnO+H2SO4 —>ZnSO4 + H2O
ZnSO4 + 2NaOH (разб.) = Zn(OH)2↓ + Na2SO4
Zn(OH)2= ZnO + H2O
ЗАДАНИЕ 3
При термическом разложении 10 г карбоната кальция было получено 1,68 л углекислого газа (н. у.). Вычислите объемную долю выхода продукта реакции.
CaCO3 → CaO + CO2
n (CaCO3) = 10/100= 0,1 моль
n (CO2) = n (CaCO3) по уравнению (теор.)
n (CO2) = 1,68/22,4 = 0,075 моль (пр.)
ŋ = V (CO2) (пр.)/ V (CO2) (теор.) = n (CO2) (пр.)/ n (CO2) (теор.) = 0,075/0,1 = 0,75 = 75%
ЗАДАНИЕ 1
Напишите уравнения возможных реакций железа и цинка с веществами: кислородом, хлором, разбавленной серной кислотой.
Рассмотрите две из этих реакций в свете ОВР, а одну — в свете ТЭД.
3Fe + 2O2 = Fe2O3 • FeO
Fe + Н2SO4 = FeSO4 + Н2
2Fe + 3Cl2 = 2FeCl3
2Zn + O2 = 2ZnO
Zn 0 -2e→ Zn 2+ окисляется, восстановитель
О20+4e→2 О 2- восстанавливается, окислитель
Zn + Cl2 = ZnCl2
Zn0 -2e→Zn2+ окисляется, восстановитель
Cl20+2e→2Cl- восстанавливается, окислитель
Zn + H2SO4 = ZnSO4 + H2
Zn + 2Н+ = Zn 2+ + Н2
ЗАДАНИЕ 2
Определите формулы веществ Х1 и Х2 в цепочке превращений:
Fe →Х1 →Fe(OH)2 →Х2 →Fe.
Напишите уравнения реакций, с помощью которых можно осуществить превращения по данной схеме.
Fe — 1 —> FeCl2 — 2 —> Fe (OH)2 — 3 —> FeO -4-> Fe
1. Fe + 2HCl —> FeCl2 + H2
2. FeCl2 + 2NaOH —> Fe(OH)2 + 2NaCl
Fe2+ + 2OH- —> Fe (OH)2
3. Fe (OH)2 — t —> FeO + H2O
4. FeO + C = Fe + CO
ЗАДАНИЕ 3
При взаимодействии 23 г натрия с водой было получено 8,96 л водорода (н. у.). Найдите объемную долю выхода продукта реакции.
2Na + 2H2O = 2NaOH + H2 ↑
n (Na) = 23/23= 1 моль
2n (H2) = n (Na) по уравнению (теор.)
n (H2) = 0,5 моль теор.
n (H2) = 8,96/22,4 = 0,4 моль (пр.)
ŋ = V (H2) (пр.)/ V (H2) (теор.) = n (H2) (пр.)/ n (H2) (теор.) = 0,4/0,5 = 0,8 = 80%
ЗАДАНИЕ 1
Напишите уравнения возможных химических реакций бериллия и железа с веществами: кислородом, бромом, разбавленной серной кислотой.
Рассмотрите две из этих реакций в свете ОВР, а одну — в свете ТЭД.
3Fe + 2O2 = Fe2O3 • FeO
Fe + Н2SO4 = FeSO4 + Н2
2Fe + 3Br 2 = 2Fe Br3
2 Ве + O2 = 2 ВеО
Ве0 -2e→ Ве 2+ окисляется, восстановитель
О20+4e→2 О 2- восстанавливается, окислитель
Ве + Br 2 = Ве Br2
Ве 0 -2e→ Ве 2+ окисляется, восстановитель
Br 20+2e→2 Br — восстанавливается, окислитель
Ве + Н2SO4 = Ве SО4 + Н2
Ве + 2Н+ = Ве 2+ + Н2
ЗАДАНИЕ 2
Определите формулы веществ Х1 и Х2 в цепочке превращений:
Fe → Х1 →Fe(OH)3 →Х2 →Fe.
Напишите уравнения реакций, с помощью которых можно осуществить превращения по данной схеме.
Fe 1→FeCl3 2→Fe(OH)3 3→Fe2O3 4→ Fe
1. 2Fe + 3Cl2 t →2FeCl3
2. FeCl3+ 3NaOH → Fe(OH)3 ↓ + 3NaCl
3. 2Fe(OH)3 t → Fe2O3 + H2O
4. 2Fe2O3 + 3C t → 4 Fe + 3CO2
ЗАДАНИЕ 3
При взаимодействии 60 г кальция с водой выделилось 30 л водорода (н. у.). Найдите объемную долю выхода продукта реакции (в %).
Ca + 2H2О = Ca(OH)2 + Н2
n (Ca) = 60/40= 1,5 моль
n (H2) = n (Ca) по уравнению (теор.)
n (H2) = 30/22,4 = 1,34 моль (пр.)
ŋ = V (H2) (пр.)/ V (H2) (теор.) = n (H2) (пр.)/ n (H2) (теор.) = 1,34/1,5 = 0,89 = 89%
ЗАДАНИЕ 1
Напишите уравнения возможных реакций магния, алюминия и серебра с неметаллом, водой, кислотой, раствором соли.
Реакции металлов с растворами кислоты и соли рассмотрите с точки зрения ОВР и ТЭД.
1. Mg + 2HCl = MgCl2 + H2
Mg + 2H+ = Mg2+ + H2
Mg0 — 2e = Mg2+ восстановитель
2H+ + 2e= H2 окислитель
Mg + Cl2 = MgCl2
Mg+2H2O=Mg(OH)2+H2
Mg + CuCl2 = MgCl2 + Cu
Mg0 + Cu2+ = Mg2+ + Cu0
Mg0 — 2e = Mg2+ восстановитель
Cu2+ + 2e= Cu0 окислитель
2. 2Al + 6HCl = 2AlCl3 + 3H2
2Al + 6H+ = 2Al3+ + 3H02
Al 0 — 3e = Al3+ восстановитель
2H+ + 2e= H2 окислитель
2Al + 3Cl2 = 2AlCl3
2Al + 6H2O = 2Al(OH)3 + 3H2
3HgCI2 + 2Al = 2AICI3 + 3Hg
3Hg2+ + 2Al0 = 2AI3+ + 3Hg0
Hg2+ + 2е = Hg0 восстановитель
Al0 – 3е= AI3+ окислитель
3. Ag + 2HCl = не реагирует
2Ag + S = Ag2S
Ag+ H2O = не реагирует
Ag + FeCl3 = AgCl + FeCl2
Ag0 + Fe3+= Ag++ Fe2+
Ag0 — 1е= Ag+ восстановитель
Fe3++1е= Fe2+окислитель
ЗАДАНИЕ 2
Определите формулы веществ Х1, Х2 и Х3 в цепочке превращений:
Напишите уравнения реакций, с помощью которых можно осуществить превращения по данной схеме.
2Ве + О2 = 2ВеО
ВеО +2HCl = BeCl2 + H2O
BeCl2 + 2NaOH = Be(OH)2 + 2NaCl
Be(OH)2 + 2NaOH= Na2BeO2 + 2H2O
ЗАДАНИЕ 3
При взаимодействии 12 г технического магния, содержащего 5% примесей, с избытком соляной кислоты, выделилось 10 л водорода (н. у.). Вычислите объемную долю выхода продукта реакции.
Mg + 2HCl = MgCl2 + H2
n(Mg) = 12-12*0,05/24 = 11,4 /24= 0,475 моль
n (H2) (теор.) = n(Mg) =0,475 моль
n (H2) = 10/22,4 = 0,44 моль (пр.)
ŋ = V (H2) (пр.)/ V (H2) (теор.) = n (H2) (пр.)/ n (H2) (теор.) = 0,44/0,475 = 0,92 = 92%
ЗАДАНИЕ 1
Напишите уравнения возможных реакций лития, меди, бария, алюминия с веществами: неметаллом, водой, кислотой, раствором соли.
Реакции металлов с растворами кислоты и соли рассмотрите с точки зрения ОВР и ТЭД.
1. 2Li + Сl2 = 2LiСl
2Li + 2H2O = 2LiOH + H2
2Li + 2НСl = 2LiСl + Н2
2Li0 + 2Н+ = 2Li+ + Н02
Li0 – 1e = Li+ восстановитель
2Н+ + 2e= Н02 окислитель
2Li + CuСl 2= 2LiС1 + Cu
2Li0 + Cu2+ = 2Li+ + Cu0
Li0 – 1e = Li+ восстановитель
Cu2+ + 2e= Cu0 окислитель
2. 2Al + 6HCl = 2AlCl3 + 3H2
2Al + 6H+ = 2Al3+ + 3H02
Al 0 — 3e = Al3+ восстановитель
2H+ + 2e= H2 окислитель
2Al + 3Cl2 = 2AlCl3
2Al + 6H2O = 2Al(OH)3 + 3H2
3HgCI2 + 2Al = 2AICI3 + 3Hg
3Hg2+ + 2Al0 = 2AI3+ + 3Hg0
Hg2+ + 2е = Hg0 восстановитель
Al0 – 3е= AI3+ окислитель
3. Ва + 2HCl = ВаCl2 + H2
Ва + 2H+ = Ва 2+ + H2
Ва 0 — 2e = Ва 2+ восстановитель
2H+ + 2e= H2 окислитель
Ва + Cl2 = ВаCl2
Ва +2H2O= Ва(OH)2+H2
Ва + CuCl2 = ВаCl2 + Cu
Ва + Cu2+ = Ва 2+ + Cu0
Ва 0 — 2e = Ва 2+ восстановитель
Cu2+ + 2e= Cu0 окислитель
4. Cu + Cl2 = CuCl2
Cu + H2O = не реагирует
Cu + HCl = не реагирует
Cu + 2FeCl3 = CuCl2 + 2FeCl2.
Cu 0 + Fe3+= Cu2 ++ Fe2+
Cu 0 — 2е= Cu + восстановитель
Fe3++1е= Fe2+окислитель
ЗАДАНИЕ 2
Определите формулы веществ Х1, Х2 и Х3 в цепочке превращений:
Напишите уравнения реакций, с помощью которых можно осуществить превращения по данной схеме.
Fe + 2HСl → FeCl2 + H2↑
FeCl2+ 2NaOH → Fe(OH)2 + 2NaCl
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3↓
2Fe(OH)3 = Fe2O3 + 3H2O
ЗАДАНИЕ 3
При термическом разложении 20 г известняка, содержащего 10% некарбонатных примесей, было получено 3,23 л углекислого газа (н. у.).
Вычислите объемную долю выхода продукта реакции (в %).
CaCO3 = CaO+CO2
n (CaCO3) = 20-20*0,1/100= 18/100=0,18 моль
V (CO2) = 3,23/22,4 = 0,145 моль (практ.)
n (CaCO3) = n (CO2) по уравнению (теор.)= 0,18 моль
выход = 0,145/0,18 = 0,801 = 80,1 %
ЗАДАНИЕ 1
Напишите уравнения возможных реакций кальция, железа и цинка с неметаллом, водой, кислотой, раствором соли.
Реакции металлов с растворами кислоты и соли рассмотрите с точки зрения ОВР и ТЭД.
1. Са + 2HCl = СаCl2 + H2
Са0 + 2H+ = Са 2+ + H2
Са 0 — 2e = Са 2+ восстановитель
2H+ + 2e= H2 окислитель
Са + Cl2 = СаCl2
Са +2H2O= Са(OH)2+H2
Са + CuCl2 = СаCl2 + Cu
Са + Cu2+ = Са 2+ + Cu0
Са 0 — 2e = Са 2+ восстановитель
Cu2+ + 2e= Cu0 окислитель
2.
2Fe + 3Cl2 t →2FeCl3
3. 2Zn + O2 = 2ZnO
Zn + H2O = ZnO + H2
Zn + H2SO4 = ZnSO4 + H2
Zn + 2Н+ = Zn 2+ + Н2
Zn 0 + 2H+ = Zn 2+ + H02
Zn 0 — 2e = Zn 2+ восстановитель
2H+ + 2e= H2 окислитель
Zn + CuSO4 = Cu + ZnSO4
Zn 0 + Cu2+ = Zn 2+ + Cu0
Zn 0 — 2e = Zn 2+ восстановитель
Cu2+ + 2e= Cu0 окислитель
ЗАДАНИЕ 2
Определите формулы веществ Х1, Х2 и Х3 в цепочке превращений:
Напишите уравнения реакций, с помощью которых можно осуществить превращения по данной схеме.
2Ca+O2=2CaO
CaО+H2O=Ca(OH)2
Ca(OH)2+H2CO3=CaCO3+2H2O
CaCO3 + CO2 + H2O ↔ Ca(HCO3)2
Ca(HCO3)2 t →CaCO3↓ + CO2 + H2O
ЗАДАНИЕ 3
Прй взаимодействии 24,15 г технического натрия, содержащего 5% примесей, было получено 8,96 л водорода (н. у.).
Вычислите объемную долю выхода продукта реакции (в %).
2Na + 2H2O = 2NaOH + H2
n(Na) = 24,15-24,15*0,05/23 =23 /23= 1 моль
n (H2) (теор.) = 0,5 n(Mg) =0,5 моль
n (H2) = 8,96/22,4 = 0,4 моль (пр.)
ŋ = V (H2) (пр.)/ V (H2) (теор.) = n (H2) (пр.)/ n (H2) (теор.) = 0,4/0,5 = 0,8 = 80%
ЗАДАНИЕ 1
Напишите уравнения возможных реакций бериллия, железа и меди с веществами: неметаллом, водой, кислотой, раствором соли.
Реакции металлов с растворами кислоты и соли рассмотрите с точки зрения ОВР и ТЭД.
1. 2 Ве + O2 = 2 ВеО
Ве + Н2SO4 = ВеSО4 + Н2
Ве + 2Н+ = Ве 2+ + Н2
2. Cu + Cl2 = CuCl2
Cu + H2O = не реагирует
Cu + HCl = не реагирует
Cu + 2FeCl3 = CuCl2 + 2FeCl2.
Cu 0 + Fe3+= Cu2 ++ Fe2+
Cu 0 — 2е= Cu + восстановитель
Fe3++1е= Fe2+окислитель
3. 2Fe + 3Cl2 t →2FeCl3
ЗАДАНИЕ 2
Определите формулы веществ Х1, Х2 и Х3 в цепочке превращений:
Напишите уравнения реакций, с помощью которых можно осуществить превращения по данной схеме.
2Zn + O2 = 2ZnO
ZnO + 2HNO3 = Zn(NO3)2 + H2O
Zn(NO3)2 + 2NaOH = 2NaNO3 + Zn(OH)2
Zn(OH)2= ZnO + H2O
ЗАДАНИЕ 3
При взаимодействии 60 г технического кальция, содержащего 2% примесей, с водой было получено 30 л водорода (н. у.). Вычислите объемную долю выхода продукта реакции.
Ca + 2H2О = Ca(OH)2 + Н2
n(Ca) = 60-60*0,02/40 =58,8 /40= 1,47 моль
n (H2) (теор.) = n(Ca) =1,47 моль
n (H2) = 30/22,4 = 1.34 моль (пр.)
ŋ = V (H2) (пр.)/ V (H2) (теор.) = n (H2) (пр.)/ n (H2) (теор.) = 1,34/1,47 = 0,91 = 91%
Видео:химия, 9-й класс, контрольная работа #1Скачать

Дидактический материал. Контрольная работа по теме «Металлы»(9 класс)
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
Рабочие листы и материалы для учителей и воспитателей
Более 2 500 дидактических материалов для школьного и домашнего обучения
311 лекций для учителей,
воспитателей и психологов
Получите свидетельство
о просмотре прямо сейчас!
Контрольная работа № 1 по теме «Металлы». 9 класс.
1.Составьте уравнения реакций ,характеризующих химические свойства металлического Na
( реакции с простыми и сложными веществами). Реакции рассматривать в свете теории ОВР .
2.Составить уравнения реакций для переходов:
Укажите тип химических реакций. Рассмотрите реакцию № 3 в свете ТЭД.
3.Определите объем водорода, который может быть получен при взаимодействии с водой 5 г. кальция, если выход водорода составляет 90% от теоретически возможного?
1.Щелочные металлы относятся
к s – элементам 2)к p – элементам 3)к d – элементам 4)к f — элементам
2.Сколько электронов содержат на внешнем энергетическом уровне атомы щелочных металлов
Один 2) два 3) три 4) четыре
3.В химических реакциях атомы натрия проявляют
Окислительные свойства 2) кислотные свойства
3) восстановительные свойства 4) основные свойства
4.Взаимодействие кальция с водой относится к реакциям
Разложения 2) соединения 3) замещения 4) обмена
5.Объем водорода, который выделится при взаимодействии 0,1 моль натрия с водой равен:
1,12 л 2) 3,36 л 3) 2,24 л 4) 4,48л
Контрольная работа № 1 по теме «Металлы». 9 класс.
1.Составьте уравнения реакций ,характеризующих химические свойства металлического Ca
( реакции с простыми и сложными веществами). Реакции рассматривать в свете теории ОВР.
2.Составить уравнения реакций для переходов:
Укажите тип химических реакций. Рассмотрите реакцию № 2 в свете ТЭД
3.При взаимодействии 5.4 г. алюминия с соляной кислотой было получено 6,384 л. Водорода(н.у.)
Сколько это составляет процентов от теоретически возможного?
1.Щелочноземельные металлы относятся
1.к s – элементам 2.к p – элементам 3.к d – элементам 4. к f — элементам
2.Сколько электронов содержат на внешнем энергетическом уровне атомы щелочноземельных металлов
1)Один 2) два 3) три 4) четыре
3.В химических реакциях атомы алюминия проявляют
1)Окислительные свойства 2) кислотные свойства
3) восстановительные свойства 4) основные свойства
4.Взаимодействие кальция с хлором относится к реакциям
1)Разложения 2) соединения 3) замещения 4) обмена
5.Молекулярная масса гидрокарбоната натрия равна:
1) 84 2) 87 3) 85 4) 86
Контрольная работа № 1 по теме «Металлы». 9 класс.
1.Составьте уравнения реакций ,характеризующих химические свойства металлического K
( реакции с простыми и сложными веществами).Реакции рассматривать в свете теории ОВР.
2.Составить уравнения реакций для переходов:
Mg → MgO → MgSO 4→ Mg ( OH )2 → MgO → Mg
Укажите тип химических реакций. Рассмотрите реакцию № 3 в свете ТЭД 3.Определите объем водорода, который может быть получен при взаимодействии с водой 5 г. кальция, если выход водорода составляет 90% от теоретически воэможного?
1)к s – элементам 2)к p – элементам 3)к d – элементам 4)к f — элементам
2.Сколько электронов содержит на внешнем энергетическом уровне атом кальция
1)Один 2) два 3) три 4) четыре
3.В химических реакциях атомы натрия проявляют
1)Окислительные свойства 2) кислотные свойства
3) восстановительные свойства 4) основные свойства 4.Взаимодействие магния с водой относится к реакциям
1)Разложения 2) соединения 3) замещения 4) обмена
5.Сумма всех коэффициентов в уравнении реакции натрия с водой равна
1) 3 2) 5 3) 7 4) 9
Контрольная работа № 1 по теме «Металлы». 9 класс.
1.Составьте уравнения реакций, характеризующих химические свойства металлического Fe
( реакции с простыми и сложными веществами). Реакции рассматривать в свете теории ОВР.
2.Составить уравнения реакций для переходов:
Укажите тип химических реакций. Рассмотрите реакцию № 4 в свете ТЭД.
3.При взаимодействии 5.4 г. алюминия с соляной кислотой было получено 6,384 л. Водорода(н.у.)
Сколько это составляет процентов от теоретически возможного?
1. Кальций относится
1)к s – элементам 2)к p – элементам 3)к d – элементам 4)к f — элементам
2.Сколько электронов содержит на внешнем энергетическом уровне атом натрия
1)Один 2) два 3) три 4) четыре
3.Какой из данных ЩМ при взаимодействии с кислородом образует оксид
Натрий 2) цезий 3) калий 4) литий
4.Взаимодействие алюминия с соляной кислотой относится к реакциям
Разложения 2) соединения 3) замещения 4) обмена
5.Объем кислорода, который вступил рв реакцию с 0,1 моль лития равен
0,56л 2) 0,25л 3)0,23л 4)0,59л
Контрольная работа № 1 по теме «Металлы». 9 класс.
1.Составьте уравнения реакций, характеризующих химические свойства металлического AI
( реакции с простыми и сложными веществами). Реакции рассматривать в свете теории ОВР.
2.Составить уравнения реакций для переходов:
Na → Х→ Na 2 O → NaOH → Na CI → AgCI
Укажите тип химических реакций. Рассмотрите реакцию № 5 в свете ТЭД
1)к s – элементам 2)к p – элементам 3)к d – элементам 4)к f — элементам
2.Сколько электронов содержит на внешнем энергетическом уровне атом алюминия
1)Один 2) два 3) три 4) четыре
3.При взаимодействии лития с кислородом образуется
1) пероксид лития 2) оксид лития 3) гидроксид лития 4) гидрид лития
4. В молекуле оксида кальция связь
1) ионная 2) ковалентная полярная 3) металлическая 4) ковалентная неполярная
5. Объем кислорода, который вступил в реакцию с 0,1 моль натрия равен:
1) 1,13л 2) 1.12л 3) 1.14л 4) 1.15л
Контрольная работа № 1 по теме «Металлы». 9 класс.
1.Составьте уравнения реакций, характеризующих химические свойства металлического Ba
( реакции с простыми и сложными веществами). Реакции рассматривать в свете теории ОВР.
2.Составить уравнения реакций для переходов:
Ca → CaO → Ca ( OH )2 → CaSO 4 → BaSO 4
Укажите тип химических реакций. Рассмотрите реакцию № 4 в свете ТЭД
1)к s – элементам 2)к p – элементам 3)к d – элементам 4)к f — элементам
2.Сколько электронов содержит на внешнем энергетическом уровне атом бария
1)Один 2) два 3) три 4) четыре
3. При взаимодействии натрия с кислородом образуется
1) пероксид натрия 2) оксид натрия 3) гидроксид натрия 4) гидрид натрия
4.Элементы второй группы главной подгруппы отдают валентные электроны, проявляя степень окисления 1) +1 2) +2 3) -1 4) -2
5.Молекулярная масса гидроксида цезия равна
1) 150 2) 152 3) 154 4) 156
Контрольная работа № 1 по теме «Металлы». 9 класс.
1.Составьте уравнения реакций, характеризующих химические свойства металлического Mg
( реакции с простыми и сложными веществами). Реакции рассматривать в свете теории ОВР.
2.Составить уравнения реакций для переходов:
Zn → ZnO → Zn ( NO 3)2 → Zn ( OH )2 → ZnO → Zn
Укажите тип химических реакций. Рассмотрите реакцию№ 3 — в свете ТЭД
3.Определите объем оксида углерода ( IV ), который может быть получен из 100 гр известняка, содержащего 20 % примесей.
1)к s – элементам 2)к p – элементам 3)к d – элементам 4)к f — элементам
2.Сколько электронов содержит на внешнем энергетическом уровне атом стронция
1)Один 2) два 3) три 4) четыре
3. Какой из этих металлов в лаборатории хранят под слоем керосина
1) железо 2) цинк 3) медь 4) натрий
4.Элементы первой группы главной подгруппы отдают валентные электроны, проявляя степень окисления 1) +1 2) +2 3) -1 4) -2
5. Сумма всех коэффициентов в уравнении реакции бария с водой
1) 3 2) 5 3) 7 4) 9
Контрольная работа № 1 по теме «Металлы». 9 класс.
1.Составьте уравнения реакций, характеризующих химические свойства металлического Li
( реакции с простыми и сложными веществами). Реакции рассматривать в свете теории ОВР.
2.Составить уравнения реакций для переходов:
Укажите тип химических реакций. Рассмотрите реакцию№1 как ОВР, № 3 — в свете ТЭД
1)к s – элементам 2)к p – элементам 3)к d – элементам 4)к f — элементам
2.Сколько электронов содержит на внешнем энергетическом уровне атом цезия
1)Один 2) два 3) три 4) четыре
3. В ряду химических элементов Be — Mg — Ca — Sr — Ba металлические свойства
1) усиливаются 2) ослабевают 3) не изменяются 4) изменяются периодически
4.Элементы второй группы главной подгруппы отдают валентные электроны, проявляя степень окисления 1) +1 2) +2 3) -1 4) -2
5.Объем воздуха, необходимый для сжигания 0,1 моль магния равен
1) 2,13л 2) 2,20л 3) 1.12л 4) 1,97л
Краткое описание документа:
Данный дидактический материал ориентирован на учителей, работающих с УМК О.С.Габриеляна. Контрольная работа состоит из восьми вариантов, задания составлены в соответствии с обязательным минимумом содержания образования. Работа состоит из двух частей, что дает возможность выполнить её в соответствии с уровнем подготовки обучающихся. Задания предусматривают проверку знаний химических свойств металлов, умений составлять не только молекулярные уравнения, но рассматривать соответствующие реакции в свете ОВР и ТЭД, умений решать задачи.
Надеюсь, что данный материал будет полезен для начинающих педагогов и преподавателям со стажем.
«Как закрыть гештальт: практики и упражнения»
Свидетельство и скидка на обучение каждому участнику
Курс повышения квалификации
Профилактика синдрома «профессионального выгорания» у педагогов
Курс повышения квалификации
Педагогические основы деятельности учителя общеобразовательного учреждения в условиях ФГОС
Курс повышения квалификации
Педагогические основы деятельности учителя общеобразовательного учреждения в условиях ФГОС
«Домашнее обучение. Лайфхаки для родителей»
- Для всех учеников 1-11 классов
и дошкольников - Интересные задания
по 16 предметам
«Учись, играя: эффективное обучение иностранным языкам дошкольников»
Свидетельство и скидка на обучение
каждому участнику
Видео:Химические Цепочки — Решение Цепочек Химических Превращений // Химия 8 классСкачать

Дистанционные курсы для педагогов
Самые массовые международные дистанционные
Школьные Инфоконкурсы 2022
33 конкурса для учеников 1–11 классов и дошкольников от проекта «Инфоурок»
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
5 860 060 материалов в базе
Ищем педагогов в команду «Инфоурок»
Другие материалы
- 27.04.2015
- 778
- 0
- 27.04.2015
- 24069
- 355
- 27.04.2015
- 8227
- 46
- 27.04.2015
- 10587
- 55
- 27.04.2015
- 9000
- 4
- 27.04.2015
- 8965
- 6
- 27.04.2015
- 4802
- 5
Вам будут интересны эти курсы:
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
Добавить в избранное
- 27.04.2015 10200
- DOCX 53.5 кбайт
- 11 скачиваний
- Оцените материал:
Настоящий материал опубликован пользователем Моторина Марина Васильевна. Инфоурок является информационным посредником и предоставляет пользователям возможность размещать на сайте методические материалы. Всю ответственность за опубликованные материалы, содержащиеся в них сведения, а также за соблюдение авторских прав несут пользователи, загрузившие материал на сайт
Если Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с сайта, Вы можете оставить жалобу на материал.
Автор материала
- На сайте: 7 лет и 5 месяцев
- Подписчики: 0
- Всего просмотров: 44483
- Всего материалов: 14
Московский институт профессиональной
переподготовки и повышения
квалификации педагогов
Видео:химия 2023 9 класс Контрольная работа "МЕТАЛЛЫ"Скачать

Дистанционные курсы
для педагогов
663 курса от 690 рублей
Выбрать курс со скидкой
Выдаём документы
установленного образца!
«Организация исследовательской деятельности школьников»
«Актуальные вопросы здоровьесбережения участников образовательного процесса в свете внедрения современных образовательных технологий»
«Проблема тревожности у школьников и пути ее коррекции»
Учителя о ЕГЭ: секреты успешной подготовки
Время чтения: 11 минут
Тысячи учителей в Австралии вышли на забастовку
Время чтения: 2 минуты
Минобрнауки выделило более 590 тысяч бюджетных мест на 2023-24 учебный год
Время чтения: 2 минуты
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
Видео:Химические Цепочки — Решение Цепочек Химических Превращений // Химия 8 классСкачать

Контрольная работа №1 по теме «Металлы» 9 класс.
Контрольная работа позволяет проверить знания девятиклассников о свойстве металлов и их соединений, умение составлять уравнения химических реакций, характеризующих их свойства.
Просмотр содержимого документа
«Контрольная работа №1 по теме «Металлы» 9 класс.»
Контрольная работа №1 по теме «Металлы».
1.Напишите уравнения возможных реакций натрия, магния, алюминия с веществами: кислородом, бромом, разбавленной серной кислотой. Для одной их них составьте электронный баланс.
2.Напишите уравнения реакций, с помощью которых можно осуществить превращения по данной схеме:
3. Используя метод электронного баланса, составьте уравнение реакции
Определите окислитель и восстановитель.
4. Рассчитайте массу цинка, необходимого для получения 10 л водорода взаимодействием его с соляной кислотой.
1.Напишите уравнения возможных реакций лития, бария, железа с веществами: кислородом, хлором, соляной кислотой. Для одной их них составьте электронный баланс.
2.Напишите уравнения реакций, с помощью которых можно осуществить превращения по данной схеме:
3. Используя метод электронного баланса, составьте уравнение реакции
Определите окислитель и восстановитель.
4.Какая масса кальция потребуется для получения 15 л водорода при взаимодействии его с серной кислотой?
Видео:8 класс. Составление уравнений химических реакций.Скачать

Контрольная работа по теме «Металлы» 9 класс
тест по химии (9 класс)
Контрольная работа по теме «Металлы» 9 класс в соответствии ФГОС ООО, два варианта с ответами
Видео:Как решать ОРГАНИЧЕСКИЕ ЦЕПОЧКИ? Основные типы химических реакцийСкачать

Скачать:
| Вложение | Размер |
|---|---|
| kr_no_2_metally_fgos.docx | 29.48 КБ |
Видео:Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

Предварительный просмотр:
Контрольная работа № 2 по теме «Металлы».
Часть А . Тестовые задания с выбором одного правильного ответа.
- Электронное строение атома кальция:
- 2, 8, 8, 2 2) 2, 8, 2 3) 2, 8, 8 4) 2, 8, 6
- Группа периодической системы химических элементов, в которой все элементы относятся к металлам:
- I 2) II 3) III 4) IV
- Ряд химических элементов, расположенных в порядке увеличения их атомных радиусов:
- K → Na → Li 2) Al → Na → Mg 3) Li → Na → K 4) Na → Mg → Be
- Валентность 3 в соединениях могут проявлять оба элемента:
- Be и Ga 2) B и C 3) Al и Fe 4) Ag и Al
- Вещество, которое может восстановить медь из её оксида, — это:
- Водород 2) азот 3) соляная кислота 4) оксид углерода (IV)
- Железо взаимодействует с каждым из двух веществ:
- соляная кислота и хлор 3) серная кислота и оксид алюминия
- хлорид лития и гидроксид калия 4) сульфат меди (II) и карбонат кальция
- Оба оксида реагируют с растворами кислот и щелочей:
- CuO и CO 2 2) ZnO и P 2 O 5 3) BeO и Al 2 O 3 4) NO и MgO
- Верны ли следующие суждения о свойствах металлов?
А. С водой при обычных условиях реагируют только щелочные металлы.
Б. Металлы в химических реакциях проявляют только восстановительные свойства.
1) верно только А. 2) верно только Б 3) верны оба 4) неверны оба
- Формула вещества Х в цепочке превращений Fe → X → Fe(OH) 3
- FeO 2) Fe 2 O 3 3) FeCl 3 4) FeCl 2
- Реактивом на ион Ва 2+ является ион:
- Cl — 2) SO 4 2- 3) NO 3 — 4) Br —
Часть В . Тестовые задания с выбором двух правильных ответов (1) и на соотнесение (2).
- В ряду химических элементов Al → Mg → Na
- увеличиваются радиусы атомов химических элементов;
- увеличивается число электронов на внешнем энергетическом уровне;
- увеличиваются заряды ядер атомов;
- усиливаются восстановительные свойства;
- уменьшается число энергетических уровней
- Установите соответствие между исходными веществами и продуктами реакции.