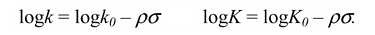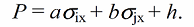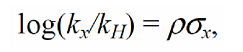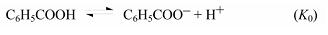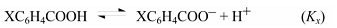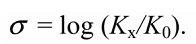| Из за большого объема этот материал размещен на нескольких страницах: 1 2 3 4 5 6 |
Константы Гаммета имеют ограниченное применение, так как они характеризуют суммарное влияние индуктивного и мезомерного эффектов, а на реакционную способность эти эффекты влияют по-разному, особенно при п-положении заместителя.
Константы Гаммета-Брауна. Известны реакции, у которых особенно сильно проявляется действие мезомерного эффекта, и поэтому непригодны обычные константы σп. Это наблюдается в случаях, когда имеется полярное сопряжение между заместителем и центром реакции.
Примером реакции, на протекание которой влияет полярное сопряжение электроноакцепторного заместителя с центром реакции, служит ионизация п-замещенных фенолов:
(здесь R = NO2, СОR’, С≡N, N2+).
В этих случаях необходимо пользоваться так называемыми константами прямого полярного сопряжения 
Прямое полярное сопряжение электронодонорного заместителя с центром реакции проявляется, например, в карбокатионах:
(здесь D = OR, SR, NR2).
В этом случае константы прямого полярного сопряжения электронодонорного заместителя обозначаются σ+ (электрофильные константы Брауна).
По абсолютному значению константы 

Константы Тафта. Для оценки индуктивного влияния заместителей в алифатическом ряду Р. Тафт разработал методику определения индуктивных констант σ*. Для этой цели он изучал скорость гидролиза сложных эфиров X-СООR в кислой и щелочной среде и получил ряд констант σ* для группировок X. В качестве стандартного соединения Тафт выбрал уксусную кислоту, для которой принял 
σ* характеризует величину и направление индуктивного эффекта заместителя. Например: σ*F = +3,1; σ*с6н5 = +0,6; σ*с2н5 = -0,1; σ*(с2н5)3с = -0,3.
Уравнение для констант Тафта имеет вид уравнения Гаммета:

Для реакций соединений алифатического ряда используется также обобщенное многопараметровое корреляционное уравнение Тафта:
Это уравнение учитывает суммарный вклад в относительную реакционную способность соответственно индуктивного, мезомерного эффектов, эффекта сверхсопряжения и стерических факторов. В уравнении ρf, ρr, h и δ – константы, отражающие чувствительность реакционной серии к этим эффектам; NX и N0 – число С-Н-связей, участвующих в сверхсопряжении с реакционным центром замещенного и незамещенного соединений.
В настоящее время применяются различные константы заместителей, например:
σ — константы Гаммета
σ+, 
σ* — константы Тафта
Es – константы, характеризующие стерические факторы
σI — индуктивные константы для производных бензола (σI = 0,16 σ*)
σc – константы, характеризующие мезомерный эффект заместителя (σc =σ — σI ) и др.
В приложении приведены электронные эффекты важнейших функциональных групп и значения различных σ-констант для некоторых заместителей. Надо отметить, что в разных источниках встречаются несколько различающиеся значения.
Пример решения и оформления типового задания
Задание. Какой из двух реакционных серий соответствуют следующие значения констант ρ: — 2,69; + 2,51?
Ответ: Константа ρ в уравнении Гаммета:
Видео:Решение задач на тему: "Нахождение константы равновесия и равновесных концентраций". 1ч. 10 класс.Скачать

Уравнение Гаммета для реакций электрофильного ароматического замещения
Вы будете перенаправлены на Автор24
Уравнение Гаммета описывает линейную зависимость свободной энергии, относительной скорости реакции и константы равновесия реакций с участием многих производных бензола и бензойной кислоты с мета- и пара-заместителями. Это уравнение было разработано и опубликовано Луи Гамметом в $1937$ году на основании анализа проведенных им экспериментов с рядом веществ.
Основная идея заключается в том, что для любых двух реакций с двумя ароматическими разными реагирующими веществами, отличающиеся друг от друга только заместителем, изменение свободной энергии активации пропорционально изменению свободной энергии Гиббса. Эта закономерность не вытекает из элементарной термохимии или химической кинетики и была введена Гамметом экспериментально.
Видео:Лекция 8 (вторая часть)Скачать

Основное уравнение уравнение Гаммета
Основное уравнение уравнение Гаммета описывает влияние мета- или пара-заместителя $X$ на реактивность функциональной группы $Y$ в производных бензола $(XC_6H_4Y).$
Основное уравнение имеет вид:
где $k$ и $K$ — константы скорости и равновесия, соответственно, для данной реакции с $XC_6H_4Y$; $k_0$ и $K_0$ касаются реакции $C_6H_5Y$, то есть при $X = H;sigma$ — характеристическая константа заместителя; $rho$ — характеристическая константа для реакции данного реакционного центра $Υ$.
Это уравнение часто встречается в форме, где $logk_0$ и $logK_0$ выделяются как отдельный член справа уравнения в виде:
Готовые работы на аналогичную тему
В этом случае отрезок, который отсекает на оси ординат линия регрессии $logk_0$ или $logK_0$ от $sigma$ соответствует $X = H$.
Видео:Химическое равновесие. Константа равновесия. 10 класс.Скачать

Расширенное уравнение Гаммета
Расширенное или обобщенное уравнение Гаммета используется для любого много-параметрического расширения уравнения Гаммета. Также так иногда называют специальные двупараметрические уравнения, в которых коррелируются определенные значения величины ρ с константами заместителя $X$, а не со значениями, отнесенными к величине при $X = H.$ Отрезок, отсекаемый на оси, в этом случае соответствует значению $rho$ при $X = H$:
В такие уравнения могут быть введены дополнительные члены, отражающие другие эффекты, например стерические.
Видео:Свободная энергия Гиббса. 10 класс.Скачать

Характеристическая константа $rho$
Характеристическая константа $rho$ определяется мерой чувствительности к воздействию заместителя на константу скорости или равновесия для данной реакции в определенной реакционной серии подобных субстратов. Впервые она была определена Гамметом для эффекта заместителей в мета- и пара-положениях к заместителю в бензольном кольце, который является реакционным центром, по эмпирическим уравнениям, имещим форму:
где $sigma_x$- константа, величина которой зависит от природы заместителя $X$ и его положения в молекуле реактанта.
В общем случае (и не только для ароматических серий) константы $rho$ используются для определения чувствительности реакционных серий ряда различных органических соединений к любым эффектам заместителей. В данном случае пользуются модифицированным набором $sigma$-констант в рамках эмпирической $sigma rho$ -корреляции.
Реакции с положительной константой $rho$ ускоряются заместителями с положительными $sigma$-константами. Поскольку знаки констант $sigma$ были определены так, что заместители с положительными $sigma$ увеличивают кислотность бензойной кислоты, такие заместители характеризуются способностью притягивать электроны из ароматического кольца. Из этого следует, что реакции с положительным значением $rho$ имеют переходное состояние (или продукт реакции) такой, что разница энергии между этим состоянием и реактантом уменьшается при снижении электронной плотности на реактивном центре субстрата.
Видео:Константа нестойкости и диссоциация комплексных соединенийСкачать

$sigma$-Константа
$sigma$-Константа это константа заместителя (константа Гаммета), характеризующая электронный эффект мета- и пара-заместителей по сравнению с водородом в уравнении Гаммета. $sigma$-Константа определяется логарифмом отношения констант равновесия соответствующей замещенной бензойной кислоты к незамещенной, измеренных в воде при $298$ К.
Электроноакцепторные заместители характеризуются положительными значениями $sigma$, а электронодонорные — отрицательными. Большое положительное значение $sigma$ предполагает высокое электроноакцепторное действие вследствие индуктивного и резонансного эффекта по отношению к водороду. Большое отрицательное значение σ предполагает высокое электронодонорное действие.
Константа $sigma$ в уравнении Гаммета для различных реакций имеют разную величину для одного и того же заместителя.
Видео:Лекция 25 (вторая часть)Скачать

Константы гаммета и уравнение гаммета
Источник: Химический ускоритель
Электронная справочно-информационная система
Иркутского государственного университета
| Константы заместителей |
Константы Гаммета (σ пара , σ мета ) являются мерой электронных эффектов (поля и резонансного эффекта) группы Х, связанной с бензольным кольцом. 🔥 ВидеоРешение задач на тему: "Нахождение константы равновесия и равновесных концентраций". 4ч. 10 класс.Скачать  Комплексные соединения. 1 часть. 11 класс.Скачать  Леменовский Д. А. - Неорганическая химия I - Кристаллические решетки и их энергииСкачать  Решение задач на тему: "Нахождение константы равновесия и равновесных концентраций". 2ч. 10 класс.Скачать  25. Схема реакции и химическое уравнениеСкачать  Решение задач на тему: "Нахождение константы равновесия и равновесных концентраций". 3ч. 10 классСкачать  Урок 156. Уравнение состояния идеального газа. Квазистатические процессыСкачать  Чепраков А.В. - Современная органическая химия - 2. Кислотность и электрофильностьСкачать  Уравнение состояния идеального газа. 10 класс.Скачать  Квантовая механика 41 - Уравнение Шредингера. Гамильтониан.Скачать  Химия | Тепловой эффект химической реакции (энтальпия)Скачать  Изомеры, гомологи, органическая химияСкачать  Гальванические элементы. 1 часть. 10 класс.Скачать  Идеальный газ. Основное уравнение молекулярно-кинетической теории газов. 10 класс.Скачать  |