Теоретические представления, развитые Лэнгмюром и Поляни, в значительной степени идеализируют и упрощают истинную картину адсорбции. На самом деле поверхность адсорбента неоднородна, между адсорбированными частицами имеет место взаимодействие, активные центры не являются полностью независимыми друг от друга и т.д. Все это усложняет вид уравнения изотермы. Г.Фрейндлих предположил, что число молей адсорбированного газа или растворенного вещества, приходящееся на единицу массы адсорбента (т.н. удельная адсорбция x/m) должна быть пропорциональна равновесному давлению (для газа) или равновесной концентрации (для веществ, адсорбируемых из раствора) адсорбента, возведенной в некоторую степень, которая всегда меньше единицы:
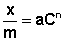
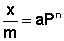
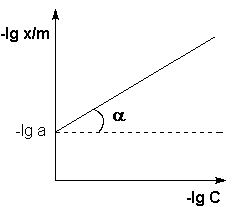
Рис. 4.7. Изотерма адсорбции Фрейндлиха в логарифмических координатах.
Показатель степени n и коэффициент пропорциональности а в уравнении Фрейндлиха определяются экспериментально. Логарифмируя уравнения (IV.15 — IV.16), получаем:
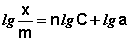
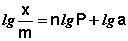
Т.о., зависимость логарифма удельной адсорбции от логарифма концентрации (давления) графически выражается прямой линией, отсекающей на оси ординат отрезок, равный lga, тангенс угла наклона которой к оси абсцисс равен по величине показателю степени при давлении или концентрации (рис. 4.7):
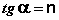
4.1.5 Адсорбция на границе твердое тело – раствор
Видео:5.1. Адсорбция. Классификация адсорбцииСкачать

Лекция №3
План лекции:
1.Поверхностное натяжение — физический смысл.
Видео:Уравнение ЛенгмюраСкачать

АДСОРБЦИЯ
Поверхностная энергия стремится самопроизвольно уменьшиться. Это выражается в уменьшении межфазной поверхности или поверхностного натяжения ( s )
Вследствие этого стремления происходит адсорбция.
Адсорбция — процесс самопроизвольного перераспределения компонентов системы между поверхностным слоем и объемной фазой. Т.е. адсорбция может происходить в многокомпонентных системах, в слой переходит тот компонент, который сильнее уменьшает s .
Адсорбент — фаза определяющая форму поверхности, более плотная, может быть твердой или жидкой.
Адсорбат — вещество которое перераспределяется (газ или жидкость).
Десорбция — переход вещества из поверхностного слоя в объемную фазу.
Количественно адсорбцию описывают величиной Гиббсовской адсорбции (избыток вещества в поверхностном слое по сравнению с его количеством в объемной фазе, отнесенный к единице площади поверхности или единице массы адсорбента)

Г i -Гиббсовская адсорбция,
V -объем системы,
с0 -исходная концентрация адсорбата ,
с i — концентрация адсорбата в объеме,
S — площадь поверхности раздела.
Все величины в (3.1) могут быть установлены экспериментально.
Адсорбцию можно рассматривать как процесс превращения поверхностной энергии в химическую.
Выведем соотношение между поверхностным натяжением и химическими параметрами компонентов.
Если объем поверхностного слоя равен 0, то
т.к. внутр. энергия пропорциональна экстенсивным величинам, то:
полный дифференциал от тех же переменных запишется следующим образом:
dU=T dS + S dT + s dS +S d s + å m i dn i + å n i d m (3.3)
Подставляя dU из 3.2 в 3.3, получим:
3.4 и 3.5 — уравнения Гиббса для межфазной поверхности (поверхностного слоя).
Все экстенсивные величины поверхности зависят от площади поверхности , поэтому удобнее относить эти параметры к единице площади поверхности. Разделив уравнение 3.5 на площадь поверхности, получим:


Г i — поверхностный избыток компонента i в поверхностном слое (по сравнению с его равновесной концентрацией в объемной фазе), то есть величина Гиббсовской адсорбции.
Уравнение 3.6 — фундаментальное адсорбционное уравнение Гиббса. Это строгое термодинамическое соотношение, написанное для многокомпонентной системы. Однако, практиче ское его использование неудобно. Оно, например, не раскрывает зависимость поверхностного натяжения от адсорбции конкретного вещества при постоянных химических потенциалах других веществ.. Единицы величины гиббсовской адсорбции определяются единицами химического потенциала. Если потенциал отнесен к молю вещества, то величина адсорбции выражается в молях на единицу площади.
Адсорбция конкретного вещества при постоянных химических параметрах других веществ:
Принимая во внимание , что m i = m i o + RT ln ai, m i и m i o — равновесное и стандартное значения химического потенциала адсорбата i , а i — термодинамическая активность адсорбата, d m i = RT d ln ai ,получим :
для Гиббсовской адсорбции:

3.7. применяют только тогда, когда можно использовать концентрации вместо активностей и пренебречь изменениями концентраций других веществ при изменении концентрации одного вещества. Этим условиям удовлетворяет разбавленный раствор относительно данного компонента. В таком растворе при изменении концентрации растворенного вещества практически не изменяется концентрация растворителя. Поэтому для растворенного вещества уравнение 3.7 переходит в широко используемые адсорбционные уравнения Гиббса для неэлектролитов и электролитов


Видео:№ 86. Неорганическая химия. Тема 10. Электролитическая диссоциация. Часть 7. Константа диссоциацииСкачать

УРАВНЕНИЕ ГЕНРИ, ФРЕЙНДЛИХА, ЛЕНГМЮРА
Для описания процесса адсорбции, помимо фундаментального уравнения адсорбции Гиббса, применяют ряд других аналитических уравнений, которые называются по имени их авторов.
При незначительном заполнении адсорбента адсорбатом отношение концентрации вещества в адсорбционном слое и в объеме стремится к постоянному значению, равному кГ:
Это уравнение характеризует изотерму адсорбции при малых концентрациях адсорбата (рис.3.1, участок 1) и является аналитическим выражением закона Генри. Коэффициент кГ не зависит от концентрации и представляет собой константу распределения, характеризующую распределение вещества в адсорбционном слое по отношению к его содержанию в объемной фазе. Уравнение Генри соблюдается приближенно, но это приближение достаточно для практики.
В более общем виде зависимость адсорбции от концентрации адсорбата можно определить с помощью уравнения Фрейндлиха.
Видео:Практическое занятие 4. Адсорбция на границе твердое тело – газСкачать

Коллоидная химия (стр. 4 )
 | Из за большого объема этот материал размещен на нескольких страницах: 1 2 3 4 5 6 7 8 9 10 11 12 13 14 |
Следует также помнить и об отрицательном значении адсорбционных явлений. Например, адсорбция влаги и паров агрессивных жидкостей вызывает коррозию различных материалов, в том числе металлических и железобетонных конструкций, промышленного и лабораторного оборудования. Пары летучих веществ, как ароматных, так и дурно пахнущих, адсорбируясь, часто придают соответствующий запах одежде, мебели, стенам и т. п.
В отличие от жидких поверхностей на твёрдых возможна как физическая адсорбция, так и хемосорбция. В данном разделе мы рассмотрим главным образом физическую адсорбцию.
При обычных условиях на гладких поверхностях адсорбция из газовой среды протекает очень быстро, так что адсорбционное равновесие устанавливается иногда за доли секунды. На пористых или порошкообразных адсорбентах адсорбция протекает медленнее, но зато достигаются бóльшие значения величины адсорбции. Экспериментально количество адсорбированного вещества х определяется по разности массы адсорбента до и после адсорбции, а величина адсорбции А — отношением этой разности к первоначальной массе адсорбента m:
В зависимости от того, в чём удобнее выражать относительное содержание адсорбтива в среде, при изучении адсорбции на поверхности раздела «твёрдое тело – газ» (т – г) можно использовать изотермы в координатах А – р или А – С. Различают мономолекулярную и полимолекулярную адсорбцию. При мономолекулярной адсорбат располагается на поверхности адсорбента слоем толщиной в одну молекулу, при полимолекулярной – в несколько таких слоёв.
3.4.1. Мономолекулярная адсорбция. Уравнение Лэнгмюра
Фундаментальным вкладом в учение об адсорбции явилась теория И. Лэнгмюра (1914 – 18), основой которой являются следующие положения:
— на поверхности адсорбента имеются энергетически эквивалентные активные адсорбционные центры;
— молекулы адсорбтива адсорбируются на всей поверхности, а только на этих активных центрах (при этом они локализуются, т. е. не перемещаются по поверхности адсорбента);
— каждый активный центр взаимодействует только с одной молекулой адсорбата, так что при адсорбции образуется мономолекулярный слой;
— адсорбированные молекулы, находящиеся на каждом данном центре, не влияют на адсорбцию на других активных центрах, т. е. взаимодействием молекул адсорбата друг с другом можно пренебречь.
Наличие активных центров на твёрдых поверхностях подтверждается экспериментальными данными, полученными, в частности, при изучении гетерогенного катализа. А именно: даже при достижении максимальной адсорбции число молекул, располагающихся на поверхности, намного меньше, чем, если бы они покрывали всю поверхность плотным слоем. Более того, адсорбционные центры занимают, как правило, лишь очень небольшую долю поверхности адсорбента. В качестве адсорбционных центров могут выступать неровности, в особенности микроскопические выступы, а также участки с определённым взаимным расположением атомов в кристаллической решётке.
Исходя из указанных положений, Лэнгмюр вывел уравнение, описывающее изотерму адсорбции. Согласно предложенной им модели, процесс адсорбции — десорбции можно представить в виде обратимой квазихимической реакции между молекулами адсорбата (обозначенными ) и адсорбционными центрами (обозначенными ¡):
(¤ — активный центр с адсорбированной на нём молекулой).
По мере увеличения концентрации адсорбирующегося вещества в соответствии с принципом Ле-Шателье равновесие в этой реакции сдвигается в сторону образования адсорбционного комплекса и свободных адсорбционных центров становится меньше. Константа адсорбционного равновесия К (без учета коэффициентов активности) равна
Переходя от этих условных обозначений к терминам учения об адсорбции, можно принять число активных центров, занятых молекулами адсорбата на единице поверхности, равным величине адсорбции А (т. е. С¤ = А), число оставшихся свободными активных центров С¡ равным разности А¥ — А, где А¥ — ёмкость адсорбционного монослоя или величина предельной адсорбции. Заменим эти эквивалентные величины друг на друга, а также примем, что C = С (С — равновесная концентрация адсорбтива в объёме газа):

Решая это уравнение относительно величины адсорбции, получим уравнение Лэнгмюра:
Так как концентрации газов и паров пропорциональны парциальным давлениям соответствующих компонентов, то уравнение Лэнгмюра может быть выражено и через равновесное парциальное давление адсорбирующегося вещества р:
На практике часто используется другая форма уравнения Лэнгмюра, получаемая из выведенной выше путём деления правой части на К:


Из уравнений (3.1) и (3.2) следует, что адсорбционный коэффициент имеет размерность концентрации или, соответственно, адсорбции. Чтобы выяснить физический смысл этой концентрации, заменим в уравнении (2.1) b на C:
и решим его относительно А:

Таким образом, адсорбционный коэффициент b численно равен такой равновесной концентрации (или равновесного парциального давления) адсорбтива, при которой величина адсорбции составляет половину предельного значения.
Уравнение Лэнгмюра в принципе является строгим в термодинамическом отношении и в принципе может хорошо описывать все участки изотермы адсорбции. Так, при очень малых концентрациях (давлениях) адсорбтива, когда C > b ( или р >> b), в знаменателе можно пренебречь величиной b. При этом уравнения приобретают вид
и, таким образом, соответствуют третьему участку изотермы, когда адсорбция достигает предельного значения и перестаёт зависеть от концентрации (давления) адсорбтива.
Вместе с тем уравнение Лэнгмюра из-за того, что оно основано на идеализированной модели, не всегда соответствует реально наблюдаемым величинам адсорбции. Иными словами, построенная на его основе теоретическая изотерма адсорбции (т. н. изотерма Лэнгмюра) может заметно отличаться от экспериментальной. Лучше всего уравнение Лэнгмюра подходит для описания адсорбции на сравнительно гладких поверхностях.
Интересно отметить, что в полярографии отмечается зависимость высоты так называемых адсорбционных пиков от концентрации, идеально подчиняющаяся уравнению Лэнгмюра. Это говорит о том, что уравнение пригодно для описания адсорбции даже на жидкой поверхности, какой является идеально гладкая поверхность ртутной капли.
В уравнение Лэнгмюра входят две константы: А¥ и К (или b), являющиеся индивидуальными характеристиками процесса адсорбции каждого отдельного вещества на каждом адсорбенте. Для того, чтобы можно было с помощью этого уравнения теоретически рассчитывать величину адсорбции, необходимо заранее вычислять значения констант. Это делается на основе сравнительно небольшого числа экспериментальных данных, полученных при заданной температуре. Вычисление констант обычно проводится графическим путём. При этом используется то обстоятельство, что уравнение Лэнгмюра может быть преобразовано в линейную форму путём деления единицы на обе его части:
или 
Таким образом, оно превращается в уравнение прямой, не проходящей через начало координат (вида y = ax + b).
По нескольким экспериментальным данным строится график зависимости 1/А от 1/С (или от 1/р) (рис. 3.3). Усредняющая прямая, соединяющая точки, экстраполируется на ось ординат. При этом от неё отсекается отрезок OМ, равный 1/А¥. Отсюда следует, что А¥ = 1/0М. Константа b может быть определена различными способами. Так, тангенс угла
 |
Рис. 3.3. Графическое определение констант уравнения Лэнгмюра
наклона графика к оси абсцисс равен b/A¥ . Значит, определяя тангенс, можно с помощью уже известной А¥ вычислить и b.
Можно также с учётом уравнения (3.3) сделать дополнительное построение – отложить на оси ординат отрезок МК, равный 0М. Тогда отрезок 0К окажется равным 2/А¥. Интерполяцией находится соответствующая ему точка L, а отрезок 0L при этом равен 1/b. Значит, b = 1/0L.
Константы А¥ и b можно легко определить и по экспериментальной изотерме адсорбции (рис. 3.4).
А¥ определяется по положению горизонтального участка изотермы. А затем с учётом уравнения (3.3) на оси ординат откладывается отрезок 0К, равный 1/А¥. Затем на оси абсцисс интерполяцией находится точка, соответствующая значению b. Однако такой способ определения констант возможен лишь при наличии данных для построения полной изотермы адсорбции.
 |
Рис. 3.4. Определение константы b уравнения Лэнгмюра
с помощью изотермы адсорбции
3.4.2. Уравнение Фрёйндлиха
Существует еще одно уравнение, описывающее изотерму адсорбции, называемое уравнением Г. Фрёйндлиха (1906):

где k и 1/n – константы. (Константа, являющаяся показателем степени, обычно записывается в виде 1/n, а не n, чтобы подчеркнуть, что равновесная концентрация или равновесное давление возводится в степень, которая всегда бывает меньше единицы).
Уравнение Фрёйндлиха является эмпирическим, т. е. за ним не стоит строгой теории. Оно было выбрано среди других уравнений как уравнение параболы, по виду напоминающей изотерму адсорбции. Потому теоретическая изотерма, построенная с его помощью, совпадает с экспериментальной только в области средних концентраций. В области же малых и, в особенности, очень больших концентраций (давлений) наблюдаются значительные расхождения между экспериментом и теоретически предсказанными величинами адсорбции. Однако в практической деятельности редко приходится иметь дело с такими областями концентраций. Поэтому уравнение Фрёйндлиха в силу его простоты и лёгкости определения констант, используется очень широко. Особенно часто его используют при исследовании адсорбции на пористых и порошкообразных адсорбентах.
Уравнение Фрейндлиха линеаризуется с помощью логарифмирования:
или 
С учётом этого для графического определения констант по нескольким экспериментальным данным строится логарифмическая изотерма адсорбции в координатах lg A — lg C или, соответственно lg A — lg р (рис. 3.5). В этом случае график при экстраполяции отсекает от оси ординат отрезок ОМ, равный lg k (т. е. k = 100М), а тангенс угла наклона его к оси абсцисс равен 1/n.
 |
Рис. 3.5. Графическое определение констант уравнения Фрёйндлиха
3.4.3. Полимолекулярная адсорбция. Капиллярная конденсация
При адсорбции на пористых и порошкообразных адсорбентах (в фармации — активированный уголь, силикагель, другие сорбенты, применяемые, например, в газовой хроматографии, а также любые таблетки и лекарственные порошки), вид экспериментальной изотермы часто отличается от рассмотренной ранее, т. н. «лэнгмюровской». Наиболее часто имеет место так называемая S-изотерма, характерная для полимолекулярной адсорбции, при которой процесс не заканчивается образованием мономолекулярного слоя, а продолжается и после этого (рис. 3,6):
 |
Рис. 3.6. S-изотерма для адсорбции газов на твёрдых адсорбентах
Кроме S-изотермы нередко получаются изотермы и других, более сложных конфигураций, например, ступенчатые.
Изучением полимолекулярной адсорбции на неоднородных поверхностях начал заниматься ещё И. Лэнгмюр. Однако ввиду сложности проблемы исчерпывающего решения её до сих пор не найдено. Учение о полимолекулярной адсорбции развивалось преимущественно с использованием двух подходов. Один из них основывался на теории Лэнгмюра с отказом от её второго положения. В соответствии с этим активные адсорбционные центры способны принять более чем одну молекулу. Этот подход развивался в работах
, Я. де Бура и др. исследователей. Особое значение имеет теория полимолекулярной адсорбции, предложенная С. Брунауэром, П. Эмметом и Э. Теллером (теория БЭТ). В ней постулируется, что каждая молекула, адсорбированная в первом слое, является адсорбционным центром для молекул, образующих второй слой и т. д. Теория позволила вывести уравнение, описывающее изотерму полимолекулярной адсорбции (уравнение БЭТ):
Полимолекулярную адсорбцию можно рассматривать как конденсацию пара на поверхности адсорбента с образованием тончайшей (толщиной в несколько молекул) поверхностной плёнки, смачивающей поверхность.
При наличии в теле адсорбента глубоких пор и капилляров, имеющих диаметр, соизмеримый с размерами молекул газов, полимолекулярная адсорбция часто происходит по механизму капиллярной конденсации. Она заключается в слиянии таких псевдоожиженных адсорбционных слоёв на стенках пор и капилляров с последующим заполнением пор продолжающим конденсироваться адсорбатом. Вначале заполняются мелкие поры, затем — более крупные. Интересно, что при этом изотермы, полученные при адсорбции с заполнением пор и при десорбции с их опорожнением, имеют различный вид. При наложении их друг на друга получается изотерма с петлей капиллярно-конденсационного гистерезиса (рис. 3.7):
 |
Видео:Поверхностные явленияСкачать

Рис. 3.7. Капиллярно-конденсационный гистерезис
Видео:Адсорбция на твёрдой поверхностиСкачать

1 – изотерма заполнения пор (адсорбция с конденсацией),
Видео:Дифференциальное уравнение Эйлера. Основное уравнение гидростатикиСкачать

2 – опорожнения пор (десорбция)
Адсорбции с конденсацией соответствует нижняя кривая (1), а десорбции — верхняя (2). Результатом капиллярно-конденсационного гистерезиса является то, что освобождение пор от адсорбата требует создания намного более низкого давления, чем их заполнение. Это связано с образованием внутри пор и капилляров вогнутого мениска жидкости, смачивающей твёрдый адсорбент. Известно, что над вогнутым мениском создается пониженное давление, которое заставляет пору сильно втягивать в себя пары адсорбента.
Наиболее важной в практическом отношении является капиллярная конденсация водяного пара, всегда в том или ином количестве присутствующего в воздухе. Поэтому пористые и порошкообразные адсорбенты, как, например, фармацевтические таблетки и порошки из гидрофильных материалов легко отсыревают и трудно поддаются осушке. Это явление осложняет анализ любых пористых и порошкообразных объектов на содержание адсорбционно-связанной воды, так как требует очень длительного высушивания.
Благодаря капиллярной конденсации влага долгое время сохраняется в почвах, что обеспечивает жизнедеятельность растений, микроорганизмов и мелких животных, обитающих под землёй.
Это же явление служит одной из главных причин выветривания горных пород.
3.5. Адсорбция на поверхности раздела «твёрдое тело – жидкость»
В этом разделе описывается адсорбция на твёрдых адсорбентах из растворов. Данный вид адсорбции имеет особенно большое практическое значение, так как используется в самых различных областях деятельности. Например, адсорбция используется при извлечении веществ из растворов, при очистке растворителей, в промышленной и лабораторной водоочистке, при первой помощи в случае отравлений. На адсорбции основано применение глин и пектиновых веществ в качестве лечебных и профилактических средств. Адсорбция лежит в основе хроматографических методов исследования и анализа.
Если растворённое вещество адсорбируется из него в виде неионизированных молекул, говорят о молекулярной адсорбции. Если же оно ионизировано, т. е. является электролитом, говорят об ионной адсорбции или, иначе, адсорбции электролитов.
Молекулярная и ионная адсорбция на твёрдых адсорбентах из растворов имеют много общего с адсорбцией из газов, но естественно, отличается от неё рядом особенностей. В первую очередь это меньшая скорость достижения адсорбционного равновесия даже на сравнительно гладких поверхностях. Кроме того, при адсорбции из растворов адсорбату приходится вытеснять с поверхности адсорбента молекулы растворителя, связанные с ним адгезионными силами, на что требуется дополнительная энергия. Поэтому адсорбция веществ из растворов будет происходить лишь в том случае, когда теплота адсорбции превышает теплоту адгезии растворителя (см. п. 2.2). Но в общем случае адсорбция на поверхности раздела «твёрдое тело – жидкость» описывается изотермами того же вида, что и газовая адсорбция, и к ней применимы те же уравнения Лэнгмюра и Фрейндлиха, но с соответственно иными константами.
3.5.1. Молекулярная адсорбция
Величина адсорбции 
где С0 — исходная концентрация адсорбирующегося вещества в растворе;
С — равновесная концентрация; V — объём раствора, из которого идет адсорбция; m — масса адсорбента.
Таким образом, если концентрация адсорбтива выражена в моль/л, объём – в литрах, а масса адсорбента – в граммах, то x (количество адсорбированного вещества) будет иметь размерность моль, а величина адсорбции будет выражена в моль/г.
Чаще всего из растворов на твёрдых поверхностях адсорбируются поверхностно-активные вещества. Своим присутствием в адсорбционном слое они уменьшают межфазное поверхностное натяжение. Адсорбция ПАВ из растворов подчиняется правилу уравнивания полярностей (1927 г.):
вещество будет адсорбироваться на поверхности раздела фаз, если в результате его адсорбции уравнивается полярность этих фаз,
то есть полярность этого вещества должна занимать промежуточное положение между полярностями веществ, образующими фазы.
Хорошей иллюстрацией правила является адсорбция органических соединений из водных растворов на активированном угле. Так, например, анилин и фенол, обладая промежуточной между водой и углем полярностью, хорошо адсорбируются, а нитроанилин — соединение с высокой полярностью — практически не адсорбируется. Следствием правила Ребиндера является то, что поверхностно-активные вещества из водных растворов следует извлекать с помощью неполярных адсорбентов (например, активированным углем), а из растворов в бензоле, эфире, ацетоне и других неполярных органических жидкостях – с помощью полярных адсорбентов (например, силикагель или цеолиты).
При адсорбции ПАВ их молекулы ориентируются в адсорбционном слое в соответствии с дифильной природой (рис. 3.8):
Рис. 3.8. Ориентация дифильных молекул ПАВ в адсорбционном слое
Как и в случае адсорбции из газов, адсорбция из растворов уменьшается с ростом температуры.
3.5.2. Адсорбция из водных растворов электролитов
Адсорбция электролитов во многом сложнее рассмотренной ранее молекулярной, что обусловлено влиянием на этот вид адсорбции как природы адсорбента, так и природы ионов, возникавших при диссоциации.
3.5.3. Влияние природы адсорбирующихся ионов
Ионы, способные поляризоваться, обычно адсорбируются на поверхности веществ, состоящих из полярных молекул или из ионов. Поэтому ионную адсорбцию часто называют полярной адсорбцией.
На способность адсорбироваться сильно влияет радиус ионов. Из ионов с одинаковой величиной заряда максимальную адсорбционную способность проявляют ионы с наибольшим радиусом. Причиной этого является, с одной стороны бóльшая поляризуемость, а с другой — меньшая гидратированность крупных ионов. Оба эти фактора сильно ослабляют взаимодействие ионов с поверхностью.
Ряды ионов, составленные в порядке уменьшения их гидратируемости, называются лиотропными рядами или рядами Гофмейстера. Известно, что гидратированность иона тем больше, чем меньше его радиус. Например, для однозарядных катионов металлов первой группы лиотропный ряд выглядит так:
Li+ Na+ K+ Rb+ Cs+
Уменьшение гидратированности

Адсорбируемость этих ионов при прочих равных условиях совпадает с увеличением радиуса и уменьшением толщины гидратной оболочки. Аналогичный ряд имеет место и в случае двухзарядных катионов второй группы:
Mg2+ Ca2+ Sr2+ Ba2+.
Анионы галогенов также могут быть расположены в лиотропный ряд, совпадающий с их положением в группе периодической системы делеева. Однако если к ним добавить другие часто применяемые в лабораторной практике однозарядные анионы, например, нитрат NO3-, ацетат СН3СОО-, тиоцианат SCN — и др., то ряд по адсорбируемости получается более сложным
Адсорбционная способность ионов в большой степени зависит и от величины их заряда. Чей больше заряд иона, тем лучше он адсорбируется. Так, катионы с примерно одинаковыми радиусами располагаются в такой ряд:
Na+ Ba2+ > Ca2+ > Mg2+ > K+ > NH4+ > Na+ > Li+.
3.5.4. Влияние природы адсорбента
Адсорбции электролитов в гораздо более высокой степени, чем молекулярной, свойственна избирательность, особенно проявляющаяся в случае адсорбентов с кристаллической поверхностью. При этом адсорбция приобретает некоторые черты хемосорбции и её можно рассматривать как достройку кристаллической решётки ионами адсорбата. Согласно правилу Ф. А. Пáнета — К. Фáянса (1913)
адсорбироваться на поверхности кристалла в первую очередь будут те ионы, которые способны достроить кристаллическую решётку.
3.5.5. Образование двойного электрического слоя
Ионы являются носителями электрического заряда, поэтому их адсорбция сопровождается возникновением электрического поля в области поверхностного слоя. Например, переход катионов из объёма жидкой фазы на поверхность твёрдой приводит к тому, что последняя заражается положительно и приобретает соответствующий электрический потенциал. Поэтому ионы, непосредственно связанные с твёрдой поверхностью адсорбента (в рассмотренном примере – катионы), называются потенциалобразующими (или потенциалопределяющими) ионами. Для нейтрализации этого заряда к поверхности подходит эквивалентное количество ионов противоположного знака (в данном примере – анионов), называемых противоионами, которые удерживаются у поверхности в основном электростатическими силами («эквивалентная адсорбция«). При этом прилегающая к поверхности область жидкой фазы приобретает отрицательный заряд. В результате такого перераспределения зарядов на поверхности адсорбента возникает двойной электрический слой (ДЭС), подобный конденсатору с двумя противоположно заряженными обкладками.
3.5.6. Обменная адсорбция
Если на поверхности адсорбента уже адсорбирован электролит, то при контакте его с другим электролитом почти всегда в той или иной степени наблюдается обменная адсорбция, или правильнее, ионный обмен между двойным электрическим слоем адсорбента и жидкой средой. Ионный обмен представляет собой обратимый процесс стехиометрического обмена ионами между раствором электролита и твёрдой поверхностью адсорбента. Это явление происходит также и на поверхности веществ, поверхностные атомы или функциональные группы которых при контакте с водой подвергаются диссоциации. Такие вещества называются ионообменниками или ионитами (см. п. 3.5.6.1). При диссоциации ионогенной группы ионита образуется ионная пара, один из ионов которой соединён ковалентной связью с твёрдой основой (матрицей) ионита, а подвижный ион находится вблизи поверхности и играет роль противоиона.
Первые сообщения об ионном обмене были сделаны в 1850 г. независимо друг от друга английскими учеными Томпсоном и Уэем. Изучая способность почв к поглощению удобрений и их вымывание дождём, они обнаружили явление обмена ионов между почвами и водными растворами солей. Впоследствии ионный обмен в почвах исследовал академик . Практический интерес к ионообменной адсорбции обусловил широкие теоретические исследования этого явления и разработку методов синтеза специальных ионообменных сорбентов.
При обменной адсорбции адсорбент, поглощая определённое количество каких либо ионов, одновременно выделяет в раствор другие ионы того же знака, вытесняемые с его поверхности (противоионы). Благодаря эквивалентности обмена ионами в течение всего процесса сохраняется электронейтральность обеих фаз.
Сродство ионитов к ионам возрастает с ростом их заряда, т. е., например, из имеющихся в окружающем растворе одно-, двух — и трехзарядных и ионов ионит в первую очередь «выберет» трёхзарядные. При равных зарядах обменивающихся ионов сродство ионитов возрастает к ионам с бóльшим атомным номером, т. е. в соответствии с их лиотропным рядом. Например, для катионов:
🌟 Видео
Практическое занятие 5. Уравнение БЭТ. Удельная поверхностьСкачать

Форш П. А. - Теоретическая механика - Формализм Лагранжа. Уравнения Лагранжа для материальной точкиСкачать

Переходные процессы | Классический метод расчета переходных процессов. Теория и задачаСкачать

Уравнения Лагранжа второго рода. Задача 1Скачать

Адсорбция на поверхностях растворовСкачать

Поверхностные явления. Адсорбция на подвижных границах раздела фаз.Скачать

Траектория и уравнения движения точки. Задача 1Скачать

№9. Элементы вариационного исчисления. Уравнения Лагранжа-Эйлера.Скачать

Поверхностные явления. Адсорбция на неподвижных границах раздела фаз.Скачать

Якута А. А. - Механика - Гидростатика. Уравнение Бернулли. Формула ПуайзеляСкачать

УМФ. Метод Фурье для параболического уравненияСкачать

Лекция №7 "Уравнение Ван-дер-Ваальса. Гидродинамика" (Булыгин В.С.)Скачать