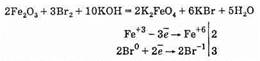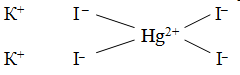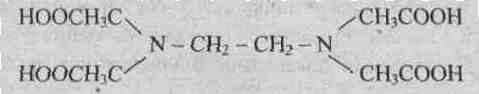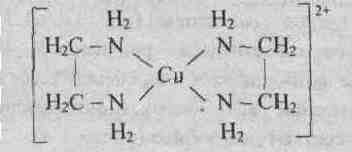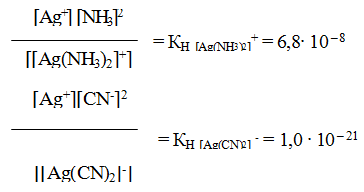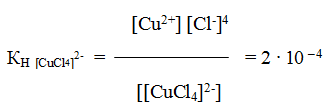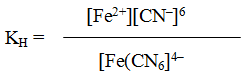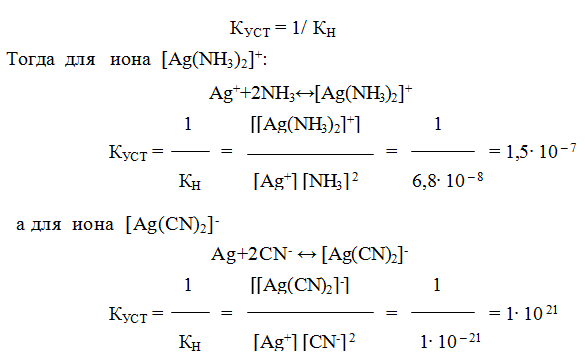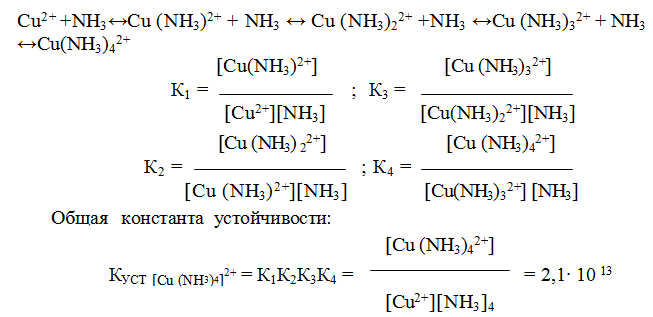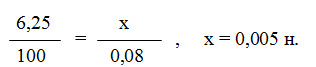Для железа наиболее характерны два ряда соединений: соединения железа (II) и железа (III). Известно также небольшое число соединений железа (VI).
Оксид железа (II) FeO — черный, легко окисляющийся порошок. Получают его восстановлением оксида железа (III) оксидом углерода (II) при 500°С:
FeO проявляет свойства основного оксида: легко растворяется в кислотах, образуя соли железа (II):
Оксид железа (III) Fe2O3 — самое устойчивое природное кислородсодержащее соединение железа.
Является амфотерным оксидом. При сплавлении Fe2O3 с оксидами, гидроксидами или карбонатами металлов образуются ферриты:
Растворяясь в кислотах, оксид железа (III) образует соли железа(III):
Оксид железа (II-III) Fe3O4 встречается в природе в виде минерала магнетита. Он хороший проводник тока, поэтому используется для изготовления электродов.
Получают взаимодействием железа с водяным паром ниже 570°С:
Оксид железа (II-III) Fe3O4 иным образом можно записать как FeO•Fe2O3.
Оксидам соответствуют гидроксиды железа.
Гидроксид железа (II) Fe(OH)2 представляет собой твердое вещество, но в чистом виде его можно получить лишь тогда, когда растворы реагирующих веществ не содержат растворенного кислорода и если реакцию вести в отсутствие кислорода воздуха:
На воздухе гидроксид железа (II) неустойчив, при соприкосновении с ним сначала зеленеет, затем буреет, переходя в гидроксид железа (III):
Гидроксид железа (II) Fe(OH)2 является нерастворимым гидроксидом и проявляет основные свойства, хорошо растворяясь в минеральных кислотах и образуя соли железа (II):
Гидроксид железа (III) Fe(OH)3 в виде красно-бурого осадка может быть получен окислением Fe(OH)2 либо действием щелочей на соли железа (III):
Гидроксид железа (III) трудно растворим, является более слабым основанием, чем гидроксид железа (II). Это объясняется тем, что у Fe 2+ меньше заряд иона и больше его радиус, чем у Fe 3+ , a значит, Fe 2+ слабее удерживает гидроксид-ионы, т.е. Fe(OH)2 более легко диссоциирует. Гидроксид железа (III) обладает слабовыраженной амфотерностью: растворяется в разбавленных кислотах:
а при сплавлении со щелочами или основными оксидами образует ферриты:
Соли двухвалентного железа могут быть получены растворением металлического железа, гидроксида, карбоната или сульфида железа (II) в разбавленных кислотах без доступа воздуха:
Соли железа (II)гидролизуются незначительно: Fe 2+ +Н2О«Fe(OH) + +Н +
Среди солей железа (II) наибольшее значение имеет железный купорос FeSO4•7Н2О, в состав которого входит семь молекул кристаллизационной воды. Железный купорос хорошо растворяется в воде. Его применяют для борьбы с вредителями сельского хозяйства, а также для изготовления красителей.
Соли трехвалентного железа могут быть получены окислением порошка железа галогенами, окислением солей железа (II), растворением оксида или гидроксида железа (III) на воздухе:
Соли железа (III) сильно гидролизуются водой, и их водные растворы имеют кислую реакцию:
Из солей железа (III) наибольшее значение имеют хлорид железа (III) FeCl3, представляющий собой весьма гигроскопические оранжевые кристаллы, которые при хранении поглощают воду и расплываются в коричневую кашицу; ионагидрат сульфата железа (III) Fe2(SO4)3•9Н2О, используемый как коагулянт, а также для травления металлов; ионагидрат нитрата железа (III) Fe(NO3)3•9Н2О, используемый как протрава при крашении хлопчатобумажных тканей и утяжелитель шелка.
Соли железа (II) легко переходят в соли железа (III), например, при нагревании с азотной кислотой или с перманганатом калия в присутствии серной кислоты:
Окисление солей железа (II) в соли железа (III) может происходить под действием кислорода воздуха при хранении этих соединений, но только этот процесс очень длительный.
Кроме того, следует отметить также две важные комплексные соли, в которых железо входит в состав анионов: гексацианоферрат (II) калия K4[Fe(CN)6] и гексацианоферрат (III) калия K3[Fe(CN)6], которые являются реактивами на катионы Fe 3+ и Fe 2+ соответственно.
Гексацианоферрат (II) калия K4[Fe(CN)6] (желтая кровяная кровь) является важным реактивом для обнаружения ионов железа Fe 3+ в растворе:
Получающиеся ионы [Fe(CN)6] 4- могут взаимодействовать с ионами Fe 3+ , образуя характерный темно-синий осадок гексацианоферрата (II) железа (III), называемый часто берлинской лазурью:
Гексацианоферрат (III) калия K3[Fe(CN)6] (красная кровяная соль) является реактивом на катионы Fe 2+ :
и при взаимодействии иона [Fe(CN)6] 3- с катионами Fe 2+ выпадает темно-синий осадок гексацианоферрата (III) железа (II), называемый часто турнбулевой синью:
Катионы Fe 3+ могут быть обнаружены также с помощью бесцветного раствора роданида аммония NH4SCN:
Ионы SCN — образуют с катионом Fe 3+ соединение кроваво-красного цвета — роданит железа Fe(SCN)3 (плохо диссоциирующий):
Известно также небольшое число соединений железа (VI) — ферраты, например феррат калия K2FeO4, феррат бария BaFeO4, которые могут быть получены окислением оксида железа (III) при нагревании с нитратом и гидроксидом калия:
Ферраты в окислительно-восстановительных реакциях могут быть только окислителями.
- Комплексные соединения. Комплексообразователи, лиганды
- 9.8. Комплексонометрия. Жесткость воды. Жесткость воды выражается суммой миллиэквивалентов ионов Са 2+ и Mg 2+ , содержащихся в 1 л воды (ммоль/л). Один миллимоль жесткости отвечает содержанию 20,04 мг/л Са 2+ или 12,16 мг/л Mg 2+ .
- Комплексные соединения
- Состав комплексных соединений
- Номенклатура комплексных соединений
- Реакции образования комплексных соединений
- Реакции разрушения комплексных соединений
- Диссоциация комплексных соединений
- Задачи для самостоятельного решения
- 💡 Видео
Видео:Комплексные соединения. Определяем заряд комплексного иона и валентность комплексообразователя.Скачать

Комплексные соединения. Комплексообразователи, лиганды
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
Комплексные соединения
- 9.1. Определение комплексных соединений
- 9.2. Комплексообразователи
- 9.3.Лиганды
- 9.4. Номенклатура комплексных соединений
- 9.5. Диссоциация комплексных соединений
- 9.6. Константы устойчивости комплексов
- 9.7.Роль комплексных соединений
- 9.8. Комплексонометрия. Жесткость воды
9.1. Определение комплексных соединений. Такие соединения, как оксиды, кислоты, основания, соли образованы из атомов в результате возникновения между ними химической связи. Это соединения обычные, или соединения первого порядка.
Однако имеются вещества, которые образованы в результате соединения друг с другом нейтральных молекул без возникновения новых связующих электронных пар. Например:
Это молекулярные соединения, или соединения высшего порядка. Одни из них диссоциируют в водном растворе на простые ноны, например:
другие — на сложные (комплексные) ионы, состоящие, в свою очередь, из более простых ионов, как, например:
Молекулярные соединения, образующие комплексные ионы, способные к существованию как в растворе, так и в кристалле, называют комплексными. Но такое определение применимо лишь в известных пределах. Оно не охватывает соединений типа неэлектролитов, например карбонилов металлов —Ni(CO)4 и др., а потому не является и полным.
Чтобы объяснить, почему происходит присоединение одних простых молекул к другим, швейцарский химик А. Вернер ввел понятие о главной и побочной валентности. Тогда образование, скажем, K2[HgI4] можho представить так: ион ртути за счет своей главной валентности (обозначается сплошной линией), равной двум, присоединяет два иодид-иона, а за счет побочной – (обозначается пунктиром) — дополнительно еще два иодид-иона. По Вернеру, это может быть изображено формулой
В настоящее время главную валентность надо объяснить ионной или ковалентной связью, а побочную – ковалентной связью, возникшей по донорно-акцепторному механизму (см. раздел 4.8.2.). Исходя из механизма образования комплексных соединений, им можно дать более точное, не имеющее исключений определение: комплексные соединения – это соединения, характеризующиеся наличием хотя бы одной ковалентной связи, возникшей по донорно-акцепторному механизму.
Комплексообразование происходит во всех случаях, когда из менее сложных систем образуются системы более сложные. Согласно координационной теории А. Вернера в структуре комплексного соединения различают координационную (внутреннюю) сферу, состоящую из центральной частицы – комплексообразователя (ион или атом) – и окружающих ее лигандов (ионы противоположного знака или молекулы). Ионы, находящиеся за пределами координационной сферы, образуют внешнюю сферу комплексного соединения. Число лигандов вокруг комплексообразователя называется его координационным числом. Внутренняя сфера (комплекс) может быть анионом, катионом и не иметь заряда. Например, в комплексном соединении K3[Fe(CN)6] внешняя сфера – 3К + , внутренняя сфера [Fe(CN)6] 3- , где Fe 3+ — комплексообразователь, a 6CN – лиганды, причем, 6 – координационное число. Таким образом, комплексное соединение (как правило) в узлах кристаллической решетки содержит комплекс, способный к самостоятельному существованию и в растворе.
9.2. Комплексообразователи. Комплексообразователями служат атомы или ионы, имеющие вакантные орбитали. Способность к комплексообразованию возрастает с увеличением заряда иона и уменьшением его размера. К наиболее распространенным комплексообразователям относятся ионы d-элементов VII, VIII, I и II групп периодической таблицы элементов.
9.3.Лиганды. К числу лигандов относятся простые анионы, такие как F – , СI – , Вr – , I – , S 2- , сложные анионы, например CN – , NCS – , NO2 – ) , молекулы, например Н2О, NH3, C. Ионы или отдельные атомы ионов и молекул лигандов имеют неподеленные пары электронов. В зависимости от того, какое число вакантных орбиталей у комплексообразователя занимают лиганды, они подразделяются на монодентантные (одна орбиталь), например NН3, СI – , бидентантные, например N2H4или En, полидентантные, например этилендиаминтетрауксусная кислота (ЕДТА), являющаяся шестидентантным лигандом
Динатриевая соль ЕДТА и сама кислота относятся к классу соединений, называемых комплексонами. Би- и полидентантные лиганды при взаимодействии с комлексообразователями образуют замкнутые циклы, называемые хелатными, поэтому и комплексы с би- и полидентантными лигандами называют хелатными (или клешневидными), например
Пример 1. Определите заряд комплексного иона, координационное число (к.ч.) и степень окисления комплексообразователя в соединениях: a) K4[Fe(CN)6]; б) Na[Ag(NO2)2]; в) K2[MoF8]; г) [Сr(Н2O)2(NН3)3С1]С12.
Решение. Заряд комплексного иона равен заряду внешней сферы, но противоположен ему по знаку. Координационное число комплексообразователя равно числу лигандов, координированных вокруг него. Степень окисления комплексообразователя определяется так же, как степень окисления атома в любом соединении, исходя из того, что сумма степеней окисления всех атомов в молекуле равна нулю. Заряды нейтральных молекул (H2O, NН3) равны нулю. Заряды кислотных остатков определяют из формул соответствующих кислот. Отсюда:
| Заряд иона | К.ч. | Степень окисления | |
| а) | -4 | 6 | +2 |
| б) | -1 | 2 | +1 |
| в) | -2 | 8 | +6 |
| г) | +2 | 6 | +3 |
9.4. Номенклатура комплексных соединений. Название комплексного катиона записывается одним словом, начинающимся с названия отрицательного лиганда с прибавлением буквы «о», затем приводятся нейтральные молекулы и центральный атом с указанием римской цифрой его степени окисления для металлов переменной валентности. Для молекул Н2О (аква), NН3 (аммин), СО (карбонил), NO (нитрозил) даются особые названия, указанные в скобках.
Число лигандов обозначают греческими приставками (ди-, три-, тетра- и т.д.) или бис-, трис-, тетракис-, пентакис- и гексакис- для 2, 3, 4, 5 и 6 соответственно у сложных лигандов. Например, соединение [Zn(NH3)2Cl]CI называется хлорид хлородиамин цинка (II), а [Ni(En)2]Cl2 – хлорид бис(этилендиамин) никеля (II).
Комплексный анион записывается аналогично названию катиона, но с добавлением суффикса -«am» к названию комплексообразователя, например K2[Zn(CN)4] – тетрацианоцинкат (II) калия. Нейтральный комплекс записывается подобно катиону, например комплекс [Ni(CО)4] называется тетракарбонил никеля (II). Соответственно по типу лигандов комплексы называют аквакомплексы (лиганд Н2О), аминокомплексы (лиганд NH3), ацидокомплексы (лиганды анионы кислот), комплексонатные комплексы (лиганды-комплексоны) и т.д.
9.5. Диссоциация комплексных соединений. Комплексные соединения — неэлектролиты в водных растворах диссоциации не подвергаются. У них отсутствует внешняя сфера комплекса, например: [Zn(NH3)2Cl2], [Co(NH3)3(NO3)3], [Pt (NH3)2C12]. В водной среде такие молекулы гидратируются как единое образование.
Комплексные соединения — электролиты при диссоциации в водных растворах образуют комплексные ионы, например:
Такая диссоциация протекает полностью, ионы гидратируются. Комплексные ионы в свою очередь подвергаются вторичной диссоциации:
Однако эта диссоциация обычно протекает в незначительной степени. Применяя закон действующих масс к обратимым процессам (а) и (б), получаем выражения констант нестойкости комплексных ионов:
Константа нестойкости комплексного иона характеризует прочность (устойчивость) внутренней сферы комплексного соединения. В приведенных примерах комплекс [Ag(CN)2] – более прочен, чем
комплекс [Ag(NH3)2] + , так как имеет меньшее значение КН.
Соединения с малоустойчивой внутренней сферой называют двойными солями. Обозначают их иначе, чем комплексные соединения, а именно — как соединения молекул, например K2SO4∙A12(SO4)3. Принципиальной же разницы между двойными солями и комплексными соединениями нет. В растворе двойной соли имеется некоторое количество комплексных ионов (например, [Al (SO4)2] – ). Двойная соль отличается от комплексной соли лишь диссоциацией комплексного иона: у первой она практически полная, а у второй — незначительная.
Двойные соли — довольно распространенные соединения. К ним относятся соль Мора (NH4)2SO4∙FeSO4∙6H2O, двойной хлорид калия и меди 2КС1 ∙ СuС12 ∙ 2Н2О и многие другие. Если, например, растворить в воде двойной хлорид, то происходит диссоциация
и все образовавшиеся в растворе ионы можно обнаружить с помощью соответствующих реакций. Но если это соединение рассматривать как комплексное, то его формулу надо изобразить как K2[CuС14]∙2H2О. Диссоциация K2[CuС14]∙2H2О протекает по уравнению:
Образующийся комплексный ион устойчив только в концентрированных растворах, и его константа нестойкости при комнатной температуре
Сравним значение КН [CuCl4] 2- со значением константы нестойкости одного из комплексных ионов меди, например КН[Cu(NH3)4] 2+ = 4,6 ∙ 10 – 14 . Тогда мы увидим, что КН [CuCl4] 2- > КН[Cu(NH3)4] 2+ на несколько порядков, а чем меньше константа нестойкости комплекса, тем больше его устойчивость.
Пример 1. Напишите выражение для константы нестойкости комплекса [Fе(СМ)6] 4- .
Решение. Если комплексная соль гексацианоферрат (II) калия, являясь сильным электролитом, в водном растворе необратимо диссоциирует на ионы внешней и внутренней сфер
то комплексный ион диссоциирует обратимо и в незначительной степени на составляющие его частицы:
Обратимый процесс характеризуется своей константой равновесия, которая в данном случае называется константой нестойкости (Кн) комплекса:
Чем меньше KH, тем более прочен данный комплекс.
9.6. Константы устойчивости комплексов. Для характеристики устойчивости (прочности) комплексного иона применяют также величину, обратную константе нестойкости. Ее называют константой устойчивости (КУСТ) или константой образования комплекса. Величины КН и КУСТ взаимосвязаны:
Очевидно, чем выше КУСТ, тем прочнее комплексный ион и тем больше его концентрация при равновесии.
Следует подчеркнуть, что как диссоциация комплексного иона, так и его образование являются процессами обратимыми и протекают ступенчато, как у слабых электролитов. Каждой ступени соответствует определенная величина константы устойчивости – К1, К2 …, Кn. Ион [Ag(NH3)2] + будет иметь две константы устойчивости — K1 и K2:
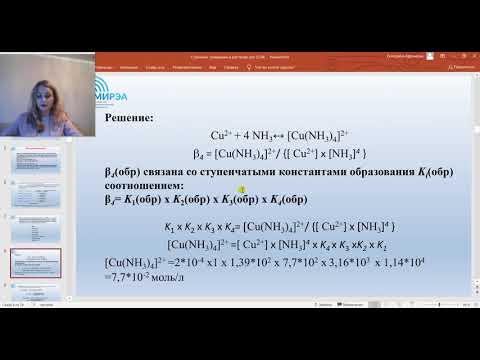
У иона [Cu(NH3)4] 2+ будет четыре константы устойчивости, так как комплексообразователь в четыре стадии присоединяет лиганд NH3
Таким образом, при образовании комплексов в растворе происходит последовательное (стадийное) внедрение лигандов во внутреннюю сферу комплексообразователя с соответствующим отщеплением молекул воды, так как исходный ион Сu 2+ был гидратирован (он имел состав [Cu(H2O)4] 2+ ). При диссоциации комплекса [Cu(NH3)4] 2+ , наоборот, происходит соответствующая замена лигандов на молекулы воды. Поскольку концентрация воды при таких процессах не изменяется, ее не включают в выражение констант устойчивости или констант нестойкости.
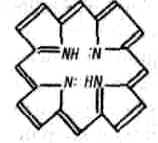
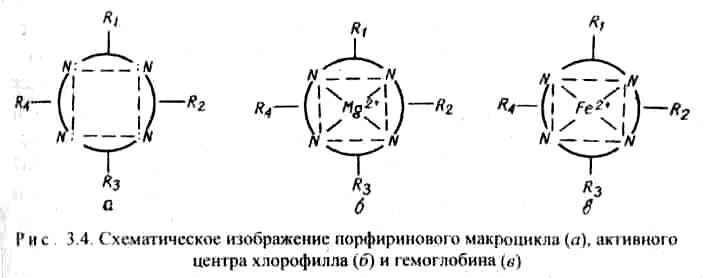
9.7.Роль комплексных соединений. Комплексные соединения широко распространены в природе. В состав многих растений и живых организмов входят соединения с макроциклическими лигандами. В упрощенном виде тетрадентантный макроцикл порфин представлен на рис. 3.3
Рис. 3.3. Структура молекул порфина
Комплексы с участием порфина называются порфи-ринами. Они отличаются друг от друга центральными ионами-комплексообразователями и заместителями, присоединенными к атомам углерода на периферии лиганда. В наиболее простом виде порфиновый цикл представлен четырьмя атомами азота, соединенными углеродными цепями (рис. 3.3). Кроме того, имеются четыре или более заместителей – радикалов R1, R2, R 3, R4. В зеленом катализаторе фотосинтеза – хлорофилле роль комплексообразователя выполняет магний (рис. 3.4). Макроциклический комплекс железа входит в состав гемоглобина (рис. 3.4).
Железо координирует кислород в комплексе гемоглобина и переносит его по организму с кровью. Связь кислорода с железом в комплексе не очень прочная и поэтому кислород в организме легко реагирует с восстановителями. Недостаток железа в организме приводит к болезни – анемии. Макроциклы крови могут взаимодействовать с каталитическими ядами, например, монооксидом углерода СО, что приводит к отравлению организма.
Сложные лиганды-комплексоны широко используются в энергетике для очистки парогенераторов от накипи, в медицине – для очистки почек от камней, для выведения ядов из организма, таких как Hg 2+ Pb 2+ Cd 2+ , в химии – как катализаторы некоторых реакций, например восстановления кислорода, в аналитической химии, в частности, при определении жесткости воды.
Видео:Константа нестойкости и диссоциация комплексных соединенийСкачать

9.8. Комплексонометрия. Жесткость воды. Жесткость воды выражается суммой миллиэквивалентов ионов Са 2+ и Mg 2+ , содержащихся в 1 л воды (ммоль/л). Один миллимоль жесткости отвечает содержанию 20,04 мг/л Са 2+ или 12,16 мг/л Mg 2+ .
Пример 1. Вычислите жесткость воды, зная, что в 500 л ее содержится 202,5 г Са(НСО3)2.
Приведенные примеры решают, применяя формулу Ж = m / (mЭ ∙ V)
где: т – масса вещества, обусловливающего жесткость воды или применяемого для устранения жесткости, мг;
mэ, – молярная масса эквивалента этого вещества;
V – объем воды, л.
Решение. В 1 л воды содержится 202,5 : 500 = 0,405 г Са(НСО3)2, что составляет 0,405 : 81 = 0,005 ммоль/л. 81 г/моль — эквивалентная масса Са(НСО3)2. Следовательно, жесткость воды 5ммоль. (Ж = т / (mэV)= 202 500 / (81 • 500) = 5 ммоль. 81 – эквивалентная масса Са(НСО3)2, равная половине его молярной массы).
Пример 2. Сколько граммов CaSO4 содержится в 1 м 3 воды, если жесткость, обусловленная присутствием этой соли, равна 4 ммоль?
Решение. Молярная масса CaSO4 136,14 г/моль; молярная масса эквивалента равна 136,14:2 = 68,07 г/моль. В 1 м 3 воды жесткостью 4 ммоль содержится 4 · 1000 = 4000 ммоль, или 4000 · 68,07 = 272 280 мг = 272,280 г CaSO4. Из формулы Ж = m / (mэV),m = 468,071000 = 272 280 мг = 272,280 г CaSO4).
Пример 3. Какую массу соды надо добавить к 500 л воды, чтобы устранить ее жесткость, равную 5 ммоль?
Решение. В 500 л воды содержится 500 · 5 = 2500 моль солей, обусловливающих жесткость воды. Для устранения жесткости следует прибавить 2500 · 53 = 132 500 мг = 132,5 г соды (53 г/моль — молярная масса эквивалента Na2CO3).
Пример 4. Вычислите карбонатную жесткость воды, зная, что на титрование 100 см 3 этой воды, содержащей гидрокарбонат кальция, потребовалось 6,25 см 3 0,08 н. раствора НС1.
Решение. Вычисляем молярную концентрацию эквивалентов раствора гидрокарбоната кальция. Обозначив число эквивалентов растворенного вещества в 1 л раствора, через х, составляем пропорцию:
Таким образом, в 1 л исследуемой воды содержится 0,005·1000 = 5 ммоль гидрокарбоната кальция или 5 ммоль Са 2+ -ионов. Карбонатная жесткость воды 5 ммоль.
Видео:Качественная реакция на ион трехвалентного железаСкачать

Комплексные соединения
Материалы портала onx.distant.ru
Состав комплексных соединений
Номенклатура комплексных соединений
Реакции образования комплексных соединений
Реакции разрушения комплексных соединений
Диссоциация комплексных соединений
Примеры решения задач
Задачи для самостоятельного решения
Видео:Понятие о комплексных соединенияхСкачать

Состав комплексных соединений
Рис. 1. Состав комплексного соединения
Комплексное соединение, рисунок 1, состоит из внутренней и внешней сферы. Центральная частица, вокруг которой расположены окружающие ее лиганды, называется комплексообразователем. Число лигандов комплексообразователя называется координационным числом.
Видео:Комплексные соединенияСкачать
Номенклатура комплексных соединений
Комплексное соединение может состоять из комплексного катиона, комплексного аниона или может быть нейтральным.
Соединения с комплексными катионами . Вначале называют внешнесферный анион, затем перечисляют лиганды, затем называют комплексообразователь в родительном падеже (ему дается русское название данного элемента). После названия комплексообразователя в скобках римской цифрой указывается его степень окисления.
К латинскому названию анионного лиганда добавляется окончание “о” (F — — фторо, Cl — -хлоро, ОН — — гидроксо, CN — — циано и т.д). Аммиак обозначают термином “аммин”, СО – карбонил, NO – нитрозил, H2O – аква.
Число одинаковых лигандов называют греческим числительным: 2 –ди, 3 – три, 4 – тетра, 5 – пента, 6 – гекса, 7 – гепта и т.д.
Вначале перечисляют лиганды анионные, затем нейтральные, затем катионные. Например,
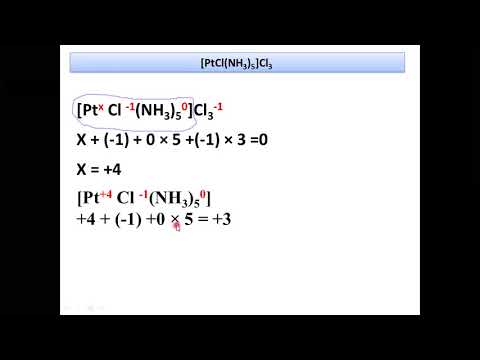
[Pt(NH3)5Cl]Cl3 – хлорид хлоропентаамминплатины (IV) .
Если в комплексе имеются несколько лигандов одинакового знака заряда, то они называются в алфавитном порядке:
Соединения с комплексными анионами. Вначале называют комплексный анион в именительном падеже: перечисляют лиганды, затем комплексообразователь (ему дается латинское название и к названию добавляется окончание “ат”). После названия комплексообразователя указывается его степень окисления. Затем в родительном падеже называется внешнесферный катион.
Na2[Zn(OH)4] – тетрагидроксоцинкат (II) натрия;
K4[Fe(CN)6] – гексацианоферрат (II) калия;
K2[СuCl4] – тетрахлорокупрат (II) калия.
Соединения без внешней сферы. Вначале называют лиганды, затем комплексообразователь в именительном падеже с указанием его степени окисления. Все название пишется слитно.
[Ni(CО)4] – тетракарбонилникель (0);
Видео:Комплексные соединенияСкачать

Реакции образования комплексных соединений
Комплексные соединения обычно получают действием избытка лигандов на содержащее комплексообразователь соединение. Координационное число, как правило, в 2 раза больше степени окисления комплексообразователя. Из этого правила бывают, однако, исключения.
Образование комплексных солей.
Если комплексообразователем является Fe 2+ или Fe 3+ , то координационные числа в обоих случаях равны шести:
Координационные числа ртути и меди, как правило, равны четырем:
Для большинства аква- и амминных комплексов ионов d-элементов координационное число равно шести:
Видео:Комплексные соединения. 1 часть. 11 класс.Скачать

Реакции разрушения комплексных соединений
Разрушение комплексных соединений происходит в результате:
- образования малорастворимого соединения с комплексообразователем:
- образования более прочного комплексного соединения с комплексообразователем или с лигандом:
- действия любой сильной кислоты на гидрокомплексы; в этом случае образуется соль и вода:
Видео:9 класс. Железо. Соединения железа. Ч2Скачать

Диссоциация комплексных соединений
Комплексные соединения в водных растворах практически полностью диссоциируют на внешнюю и внутреннюю сферы. В то же время комплексный ион диссоциирует в незначительной степени как ассоциированный электролит. Количественной характеристикой диссоциации внутренней сферы в растворе является константа нестойкости, представляющая собой константу равновесия процесса диссоциации комплексного иона.
Например , в растворе комплексное соединение [Ni(NH3)6]SO4 диссоциирует следующим образом:
Для комплексного иона [Ni(NH3)6] 2+ , диссоциирующего по уравнению
константа равновесия процесса диссоциации носит название константы нестойкости Кн. Для рассматриваемого процесса Кн равна
Кн = [Ni 2+ ]·[NH3] 6 / [[Ni(NH3)6] 2+ ] (1)
Величина, обратная Кн, называется константой устойчивости:
Она представляет собой константу равновесия процесса образования комплексного иона:
Константа нестойкости Кн связана с изменением энергии Гиббса процесса диссоциации комплекса уравнением:
ΔGT о = — RTln Кн (3)
Примеры решения задач:
Задача 1. Вычислите:
1) Концентрацию ионов NO3 — в 0,01 М растворе [Ag(NH3)2]NO3.
2) Концентрацию Ag + в 0,01 М растворе [Ag(NH3)2]NO3, содержащем 2 моль/л избыточного аммиака,
если Кн[Ag(NH3)2] + = 5,7× 10 — 8 при 298 К.
3) Величину ΔG o 298 процесса диссоциации комплексного иона.
[NO3 — ] = 0,01М, поскольку комплекс диссоциирует как сильный электролит на комплексный ион и ионы внешней сферы.
2) Комплексный ион диссоциирует незначительно:
Положение равновесия комплексного иона в присутствии избытка NH3 еще больше смещено влево.
Пусть продиссоциировало x моль/л комплексного иона, тогда образовалось x моль/л ионов Ag + и 2x моль/л аммиака. Суммарная концентрация аммиака равна (2x+2) моль/л. Концентрация недиссоциированного комплексного иона [Ag(NH3)2] + составляет: (0,01–x) моль/л.
Концентрация аммиака, связанная с диссоциацией комплексного иона, ничтожно мала по сравнению с избытком аммиака. Доля комплексного иона, подвергшегося диссоциации, также ничтожно мала. Значит,
Следовательно, [Ag + ] = 1,43× 10 — 10 моль/л.
Константа нестойкости связана с изменением энергии Гиббса процесса диссоциации [Ag(NH3)2] + уравнением:
Значит, при Т = 298 К получаем:
ΔG о 298 = — 8,314× 298× ln5,7× 10 — 8 = 41326 Дж = 413,3 кДж.
Задача 2. Произойдет ли осаждение AgCl при сливании 0,01М раствора [Ag(NH3)2]NO3, содержащего 2 моль/л избыточного NH3, с равным объемом 0,5М раствора KCl, если при 298 К ПР(AgCl) = 1,73× 10 — 10 , Кн.[Ag(NH3)2] + = 5,7× 10 — 8 .
Решение. Осадок выпадет при условии: [Ag + ][Сl — ] > ПР(AgCl), т.е. если произведение концентраций ионов Ag + и Сl — в растворе будет больше ПР, то раствор окажется пересыщенным и из него будет выпадать осадок.
После смешения равных объемов растворов концентрации [Ag(NH3)2]NO3, NH3 и KCl уменьшатся в 2 раза и станут равными 5× 10 -3 , 1 и 0,25 М соответственно.
Найдем концентрацию [Ag + ] тем же способом, что и в предыдущей задаче,
откуда x = 2,85× 10 — 10 .
Значит, [Ag + ] = 2,85× 10 — 10 моль/л, а [Сl — ] = 0,25 моль/л.
Следовательно, произведение концентраций ионов равно:
[Ag + ][Сl — ] = 2,85× 10 — 10 × 0,25 = 7,1× 10 — 11 (моль/л) 2 .
Поскольку [Ag + ][Сl — ] = 7,1× 10 — 11 — 10 , то осадок не выпадет.
Задача 3. При какой концентрации ионов S 2- начнется выпадение осадка CdS из 0,6М раствора Na2[Cd(CN)4], содержащего 0,04 моль/л избыточного NaCN, если ПР(CdS) = 7,9× 10 — 27 , Кн[Cd(CN)4] 2- = 7,8× 10 — 18 .
Решение. Осадок выпадет при условии: [Cd 2+ ][S 2- ] > ПР(CdS), т.е. если произведение концентраций ионов Cd 2+ и S 2- в растворе будет больше ПР. Следовательно, выпадение осадка начнется при [S 2- ] > ПР(CdS):[Cd 2+ ].
Комплексный ион диссоциирует незначительно:
[Cd(CN)4] 2- → Cd 2+ + 4CN —
Пусть продиссоциировало x моль/л комплексного иона, тогда образовалось x моль/л ионов Cd 2+ и 4x моль/л ионов CN — . Суммарная концентрация ионов CN — равна (4x + 0,04) моль/л. Концентрация недиссоциированного комплексного иона [Cd(CN)4] 2- составляет: (0,6 – x) моль/л.
Кн[Cd(CN)4] 2- = [Cd 2+ ] · [CN — ] 4 / [[Cd(CN)4] 2- ]
Следовательно, [Cd 2+ ] = 1,8·10 — 12 моль/л.
Выпадение осадка начнется при [S 2- ] > 7,9·10 — 27 : 1,8·10 — 12 > 4,39·10 — 15 моль/л.
Видео:Химия 9 класс : Соединения железаСкачать

Задачи для самостоятельного решения
1. Назовите следующие комплексные соединения:
Na2[Pt(CN)4Cl2] – дихлоротетрацианоплатинат (IV) натрия;
2. Назовите следующие комплексные соединения
[Ni(NH3)6][PtCl4] – тетрахлороплатинат (II) гексаамминникеля (II).
3. Составьте уравнение химической реакции:
4. Составьте уравнение химической реакции:
5 . Составьте уравнение химической реакции:
6. Составьте уравнение химической реакции:
7. Составьте уравнение химической реакции:
💡 Видео
Фотоколориметрический метод определения концентрации ионов железаСкачать

лекция 13 Комплексы 1Скачать

Видео поведение комплексных соединений в растворах.Скачать
Cложные ионы (видео 19) | Химия. ВведениеСкачать

Комплексиметрия: комплексонометрия, меркуриметрия.Скачать

Комплексные соединенияСкачать

Свойства комплексных соединений. 11 класс.Скачать

Ерёмин В. В. - Общая химия - Комплексные соединения (Лекция 7)Скачать

Комплексные соединения. Строение и классификация. Теория А. Вернера.Скачать

НШ | Химия. Химические свойства железаСкачать

Получение комплексных соединенийСкачать