Комплексиметрическое титрование. Комплексонометрическое титрование. Меркуриметрическое титрование.
1. Комплексиметрическое титрование. Сущность метода.
Комплексиметрия, или комплексиметрическое титрование (иногда говорят: комплексометрия, или комплексометрическое титрование) ‒ метод титриметрического анализа, основанный на использовании реакций комплексообразования между определяемым компонентом анализируемого раствора и титрантом. Другими словами, комплексиметрия (комплексометрия) ‒ титрование вещества раствором такого соединения, которое образует с титруемым веществом слабо диссоциирующий (т. е. устойчивый) растворимый комплекс.
Метод чаще всего применяется для определения катионов металлов-комплексообразователей.
Реакцию комплексообразования, лежащую в основе метода, можно представить в виде (без указания зарядов реагентов):
где М ‒ катион металла-комплексообразователя ‒ обычно (но не всегда) определяемый компонент X анализируемого раствора; L ‒ лиганд, находящийся в растворе титранта Т; MLn ‒ продукт реакции, представляющий собой комплекс. Окончание титрования фиксируют либо визуально с помощью индикаторов, либо потенциометрически.
Рассмотрим некоторые примеры.
Определение цианид-ионов CN — титрованием анализируемого раствора, содержащего цианид-ионы, стандартным раствором нитрата серебра. После начала прибавления титранта и до ТЭ образуется растворимый цианидный комплекс серебра (I) [Ag(CN)2]- по схеме:
По достижении ТЭ дальнейшее прибавление избыточного титранта приводит к образованию осадка цианида серебра AgCN:
[Ag(CN)2]- + Ag+ = 2AgCN↓
КТТ фиксируется по появлению мути осадка цианида серебра.
Определение катионов кальция Са2+ титрованием анализируемого раствора, содержащего катионы кальция, стандартным раствором комплексона ‒ двунатриевой соли этилендиаминтетрауксусной кислоты (сокращенное обозначение ЭДТА ‒ этилендиаминтетраацетат или Na2H2Y, где символом H4Y обычно обозначают четырехосновную этилендиаминтетрауксусную кислоту, см. ниже) по схеме:
Са2+ + H2Y2- = CaY2- + 2Н+
КТТ фиксируется с помощью индикаторов.
2. Требования к реакциям в комплексиметрии. Классификация методов и их применение.
Реакции, используемые в комплексиметрии, должны отвечать, по крайней мере, следующим основным требованиям.
1)Стехиометричность. В реакции должен образовываться один продукт точно определенного состава. Побочные реакции должны отсутствовать.
2)Полнота протекания реакции. Реакция, лежащая в основе титрования, должна протекать практически до конца, т. е. не менее чем на 99,99%.
Рассмотрим простейшую реакцию образования комплекса ML при взаимодействии катиона металла М и лиганда L (без указания зарядов):
Концентрационная константа устойчивости в комплекса ML, очевидно, равна:
Для того чтобы реакция комплексообразования прошла до конца (на
99,99%), необходимо, чтобы образующийся комплекс ML обладал высокой устойчивостью со значением в ≥ 108.
Действительно, пусть с ‒ начальная концентрация катионов М металла-комплексообразователя. Если в ТЭ реакция комплексообразования дошла практически до конца, то катионы М на 99,99% перешли в комплекс, т. е. равновесная концентрация [ML] комплекса практически равна его начальной концентрации: [ML] = c ‒ 0,0001с ≈ c. Небольшая часть комплекса (0,01%) диссоциирует по схеме:
Очевидно, что равновесные концентрации металла-комплексообразователя и лиганда одинаковы: [М] = [L] = 10-4с, т. е. 0,01% от с, поскольку по условию лишь 0,01% от общего количества металла-комплексообразователя не связано в комплексе. Тогда:
в = с/(10-4с ∙ 10-4с) = 108/с.
Обычно титрование проводят при концентрации с, изменяющейся в пределах от 1 до 10-4 моль/л, т. е. величина в лежит в интервале от 108 до 1012 (в ≥ 108) и lg в ≥ 8.
3)Реакция комплексообразования должна протекать быстро; равновесие должно устанавливаться практически мгновенно.
4)Реакция должна обеспечивать отчетливую фиксацию КТТ.
3. Классификация методов комплексиметрии
Методы комплексиметрии обычно классифицируют, в зависимости от природы реагента или образующихся комплексов. Так, например, выделяют следующие методы.
а)Меркуриметрия, или меркуриметрическое титрование ‒ метод, основанный на использовании реакций образования растворимых, устойчивых, слабо диссоциирующих комплексов ртути (II), формально содержащих катион Hg2+.
б)Цианометрия, или цианометрическое титрование, ‒ метод, основанный на использовании реакций образования растворимых, устойчивых, слабо диссоциирующих цианидных комплексов металлов, содержащих в качестве лигандов цианогруппы CN-, например, серебра, цинка, ртути, кобальта, никеля.
в)Фторометрия, или фторометрическое титрование, ‒ метод, основанный на реакциях образования фторидных соединений металлов, например, алюминия, циркония (IV), тория (IV).
г)Комплексонометрия, или комплексонометрическое титрование, ‒ метод, основанный на использовании реакций образования комплексона — тов ‒ комплексных соединений катионов металлов с комплексонами.
Иногда комплексонометрию называют хелатометрией (хелатомет — рическим титрованием), определяя ее как такое титрование, при котором образуется растворимый хелат. Однако понятие хелатометрия ‒ более широкое, чем понятие комплексонометрия. Так, в хелатометрии используются реакции образования дитизонатов металлов, а дитизон не относится к комплексонам.
Из всех методов комплексиметрического титрования наибольшее распространение получила комплексонометрия, на которой мы остановимся более подробно.
Комплексонометрическое титрование – фармакопейный метод.
При комплексонометрическом титровании в результате реакции между катионом металла и комплексоном образуется комплексонат металла.
Комплексоны ‒ это чаще всего многоосновные аминополикарбоно — вые кислоты и их соли, анионы которых, выступая в роли полидентатных хелатообразующих лигандов, способны образовывать со многими катионами металлов устойчивые растворимые комплексы ‒ комплексонаты.
В большинстве аналитически важных случаев комплексонаты металлов содержат один сложный циклообразующий лиганд, приходящийся на один катион металла-комплексообразователя, или, как говорят, комплекс имеет состав 1:1.
Известно большое число комплексонов, например, комплексоны I‒ IV, перечисленные ниже.
Комплексон I, или нитрилотриуксусная кислота N(CH2COOH)3.
Комплексон II, или этилендиаминтетрауксусная кислота (ЭДТУК)
имеющая бетаиновое строение (два протона связаны с атомами азота):
Эту четырехосновную кислоту, как уже отмечалось выше, часто сокращенно обозначают символом H4Y; такое обозначение мы будем использовать в дальнейшем.
Комплексон III, Na2H2Y∙2Н2O ‒ двунатриевая соль ЭДТУК; этот комплексон часто называют также ЭДТА (этилендиаминтетраацетат), трилон Б, хелатон III и т. д. Комплексонаты металлов, образованные катионами металлов с ЭДТА, называют также «эдетеатами», в отличие от комплексов с другими комплексонами.
Комплексон IV ‒ диаминциклогексантетрауксусная кислота
H2C CH— N(CH2COOH)2
В титриметрическом анализе наиболее широко применяется комплексон III; остальные комплексоны, а их известно несколько десятков, применяются в титриметрии реже.
5. Равновесия в водных растворах ЭДТУК
Комплексон H4Y ‒ четырехосновная кислота. В сильно кислых растворах при pH 10,5
Максимальная относительная концентрация каждой формы соответствует приблизительно середине соответствующего интервала изменений рН.
6. Состав и устойчивость комплексонатов металлов
Анион Y4- ‒ максимально гексадентатный лиганд, т. е. может занимать до шести координационных мест во внутренней сфере комплексоната. Координационные связи образуются за счет двух атомов азота и четырех атомов кислорода всех депротонированных карбоксильных групп.
Как уже отмечалось выше, обычно состав эдетеатов металлов соответствует мольному отношению металл лиганд, равному 1:1; комплексы мономерны (встречаются лишь очень редкие исключения). Если в растворе доминирует форма H2Y2-, то реакции комплексообразования протекают по схеме:
М+ + H2Y2- = MY3- + 2Н+,
М2+ + H2Y2- = MY2- + 2Н+,
М3+ + H2Y2- = MY — + 2Н+,
М4+ + H2Y2- = MY + 2Н+,
где Мn+ ‒ катионы металлов-комплексообразователей.
Возможно также образование комплексов, содержащих HY3-. Однако комплексонаты металлов, содержащие HY3-, значительно менее устойчивы, чем комплексонаты, включающие Y4- .
При образовании комплексоната металла возникают несколько хелатных циклов, поэтому комплексонаты ‒ весьма устойчивые соединения. Величина константы устойчивости комплексоната зависит от природы катиона металла, его заряда, состава комплекса, температуры.
Катионы щелочных металлов образуют малостойкие эдетеаты как с Y4-, так и с HY3-. Поэтому щелочные металлы методом комплексонометрического титрования не определяют.
Двух-, трех — и четырехзарядные катионы металлов образуют весьма стабильные комплексонаты; поэтому катионы таких металлов определяют комплексонометрически. При этом катионы металлов, которые образуют высокоустойчивые эдетеаты, можно оттитровывать в кислой среде. Катионы металлов, дающие менее стойкие эдетеаты (lg в ≈ 9 ‒ 12), определяют комплексонометрически в щелочной среде.
7. Титранты метода
В качестве титрантов метода применяют стандартные водные растворы ЭДТА, обычно с молярной концентрацией 0,1; 0,05; 0,025 и 0,01 моль/л, а также стандартные растворы сульфата магния или цинка.
Раствор титранта — трилона Б — готовят по точной навеске Na2H2Y·2Н2O, а затем стандартизуют по стандартному раствору сульфата магния или сульфата цинка.
Трилон Б — дигидрат C10H14N2Na2O8·2Н2O (молекулярная масса 372,24) двунатриевой соли ЭДТУК — белый кристаллический порошок; растворимость в воде составляет 108 г/л при 22 °С. Устойчив на воздухе.
Для приготовления 0,05 моль/л раствора трилона Б растворяют 18,8 г этой соли в воде в мерной колбе на 1000 мл и доводят водой объем колбы до метки. Раствор фильтруют и затем стандартизуют.
При стандартизации по сульфату цинка растворяют 3,27 г (точная навеска) металлического цинка в 40 мл разбавленной серной кислоты в мерной колбе на 1000 мл. При этом протекает реакция:
Zn + H2SO4 = ZnSO4 + H2↑
После растворения цинка раствор в колбе доводят водой до метки.
В колбу для титрования отбирают аликвоту — 25 мл полученного раствора сульфата цинка, прибавляют 5 мл аммиачного буферного раствора с pH = 9,5—10,0, добавляют
0,1 г индикаторной смеси эриохрома черного Т и 70 мл воды. Раствор перемешивают и титруют стандартизуемым раствором трилона Б, полученного, как описано выше, до изменения окраски титруемого раствора от фиолетовой до ярко-синей.
Поскольку при pH = 9,5—10,0 комплексон присутствует в форме HY3-, то при титровании протекает реакция:
Zn2+ + HY3- = ZnY2- + Н+
Аммиачный буфер с pH = 9,5—10,0 готовят следующим образом. Растворяют 54 г хлорида аммония NH4C1 в 200 мл воды, прибавляют 350 мл водного 25 %-ного раствора аммиака и доводят объем раствора водой до 1000 мл. Срок годности такого раствора при хранении в обычных условиях составляет три месяца.
Стандартные растворы сульфата магния готовят вначале с приблизительной концентрацией, например, 0,025 моль/л, а затем стандартизуют стандартным раствором ЭДТА в присутствии индикатора эриохрома черного Т в аммиачном буфере до перехода цвета раствора из краснофиолетового в синий. При титровании образуется комплексонат магния:
Mg2+ + HY3- = MgY2- + Н+
Индикаторы комплексонометрии (металлохромные индикаторы), принцип их действия; требования, предъявляемые к металлохромным индикаторам; интервал изменения окраски индикаторов; примеры металлохромных индикаторов (эриохром черный Т, ксиленоловый оранжевый, мурексид).
Типы индикаторов. Для визуальной фиксации КТТ применяют два типа индикаторов.
К первому типу индикаторов относятся бесцветные органические вещества, образующие с катионами определяемых металлов окрашенные комплексы. К числу таких индикаторов относятся салициловая, сульфо — салициловая кислоты, тайрон, гидроксамовые кислоты, тиокарбамид и некоторые другие. Индикаторы этого типа применяют в комплексонометрии сравнительно редко.
Ко второму типу индикаторов, наиболее часто применяемых в ком — плексонометрии, относятся металлохромные индикаторы (иногда их называют металлоиндикаторами), представляющие собой органические красители, имеющие собственные хромофорные группы, способные обратимо изменять окраску при образовании комплексов с катионами металлов. Другими словами, металлохромные индикаторы ‒ это слабые протолиты, обратимо образующие с катионами определяемых металлов интенсивно окрашенные комплексы, причем цвет комплексов отличается от цвета свободного индикатора.
Принцип действия металлохромных индикаторов заключается в следующем. Индикатор прибавляется в исходный анализируемый раствор до начала прибавления титранта и образует окрашенный растворимый комплекс с определяемым катионом.
Пусть индикатор ‒ слабая двухосновная кислота, которую сокращенно обозначим H2Ind. В растворе индикатор диссоциирует с образованием аниона Ind2-, обладающего цветом I:
H2Ind = 2Н+ + Ind2-
Пусть титруемые катионы ‒ это двухзарядные катионы металлов М2+. Анионы Ind2- образуют растворимые окрашенные комплексы MInd, обладающие цветом II:
Исходный анализируемый раствор, содержащий определяемые катионы, принимает окраску цвета II.
По ходу титрования образуются бесцветные растворимые комплексонаты MY2-:
М2+ + H2Y2- = MY2- + 2Н+
Необходимое условие использования металлохромного индикатора заключается в том, что комплекс MInd должен быть менее устойчив, чем комплекс MY2-. Поэтому вблизи ТЭ, когда оттитрованы все катионы М2+, прибавляемый титрант взаимодействует с комплексом MInd, разрушая его:
MInd + H2Y2- = MY2- + Ind2- + 2H+
Выделяющиеся анионы Ind2- окрашивают титруемый раствор в цвет I; на этом титрование заканчивают.
Таким образом, по достижении ТЭ происходит изменение окраски раствора:
цвет II → цвет I.
В соответствии с вышеизложенным должно выполняться условие (1.1)
где вMY = [MY2-]/[M2+][Y4-] и вMInd = [MInd]/[M2+][Ind2-] — концентрационные константы устойчивости комплексов катионов M2+ с анионами комплексона и индикатора соответственно.
В табл. 1.1 приведены величины логарифмов концентрационных констант устойчивости lg в комплексов катионов металлов с некоторыми индикаторами в водных растворах.
Таблица 1.1. Значения логарифмов констант устойчивости lg в комплексов
катионов металлов состава 1:1 с некоторыми индикаторами в водных растворах при комнатной температуре
- Комплексонометрическое титрование
- Титратор для комплексонометрического титрования. GT-200
- Сущность комплексонометрического титрования
- Классификация методов комплексонометрического титрования
- Комбинированные методы комплексонометрического титрования
- Виды комплексонометрического титрования
- Индикаторы для комплексонометрического титрования
- Применение комплексонометрического титрования
- 🎬 Видео
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Комплексонометрическое титрование
Видео:Составление ур-й окислительно-восст. реакций методом ионно-электронного баланса. 1ч. 10 класс.Скачать

Титратор для комплексонометрического титрования. GT-200
Чтобы унифицировать получаемые результаты анализа и избежать индикаторной ошибки рекомендуется применять автоматизированные установки. Они позволят выполнять анализ в строго контролируемых одинаковых условиях, фотометрически детектируя смену окраса раствора.
Комплектация автоматического лабораторного титратора для комплексонометрического титрования на примере модели GT-200 от японской компании «Mitsubishi Chemical Analytech Co., Ltd.» (с 2020 года перешла в собственность «Nittoseiko Analytech»):
Основной блок – потенциометрический титратор GT-200 – управляется либо встроенным программным обеспечением, либо с помощью WINDOWS-совместимого ПО. Он производит все расчетные операции и сохраняет необходимые данные (концентрации, объемы, статистику и пр.) в памяти.
Бюретка для титрования GT-200BRT – предназначена для дозирования и титрования растворов. Можно задавать шаг, скорость, последовательность дозирования.
Фотометрический датчик GT-LDII – имеет встроенный детектор, вырабатывающий фототок при определенной длине волны. При смене окраса раствора длина волны меняется, изменяя фототок. В процессе подачи титранта объем поданного раствора можно зафиксировать до смены окраса индикатора и после.
Мешалка GT-200STR – позволяет производить контролируемое и повторяемое перемешивание пробы.
Это основные элементы автоматической системы для фотометрического титрования на базе потенциометрического титратора GT-200. Дополнительно к ним можно добавить устройства для автоматической подачи образцов, принтер для распечатки результатов, весы с возможностью передачи веса образца сразу в прибор и другие полезные модули.
Видео:Комплексонометрическое титрованиеСкачать

Сущность комплексонометрического титрования
Комплексонометрическое титрование – это титриметрический метод анализа, основанный на взаимодействии определяемых ионов металла с комплексонами. Чаще всего в роли комплексообразователя выступает динатриевая соль этилендиаминтетрауксусной кислоты (другие названия: Трилон Б, ЭДТА), которая в большинстве случаев образует комплексы с катионами металлов в молярном соотношении 1:1, что упрощает расчет концентраций определяемых элементов.
Устойчивые комплексы с ЭДТА большинство металлов образуют в щелочной среде, для этого к раствору с анализируемым образцом добавляют аммиачный буфер, но некоторые элементы, например, железо (Fe III), можно титровать и в кислой среде.
Основные требования к комплексообразующему реагенту:
Образования устойчивых комплексов с катионами металлов в известном молярном соотношении.
Хорошая растворимость образуемых комплексов в воде.
Образующиеся комплексы не должны быть окрашены.
Взаимодействие комплексона с противоионом должно происходить быстро и количественно
Всем этим требованиям, в большинстве случаев, удовлетворяет Трилон Б.
Индикатор подбирают в зависимости от титруемого элемента и исходя из типа титрования.
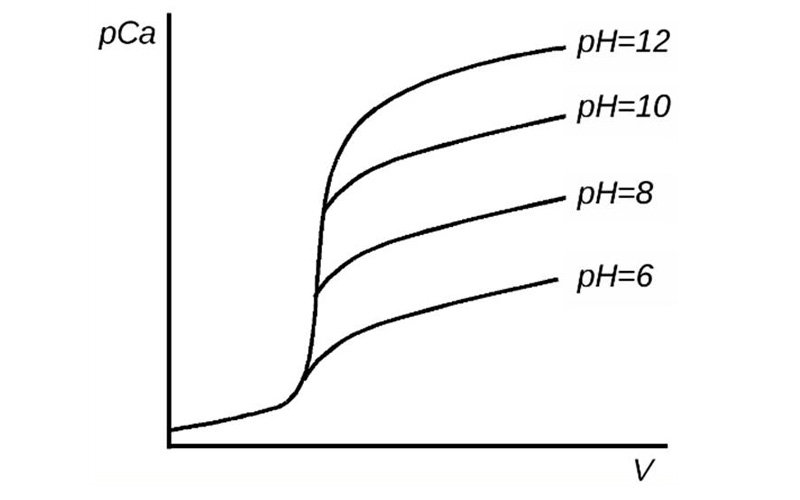
Как уже упоминалось ранее, pH среды существенно влияет на устойчивость образующихся комплексов, что видно при построении кривой комплексонометрического титрования ионов кальция, представленной ниже:
Рис.1 Кривая титрования [Ca 2+ ] трилоном Б при различных значениях pH.
Из кривых титрования видно, что при более высоком pH величина ΔpCa больше (высокий скачок), что позволяет точней идентифицировать точку эквивалентности.
Видео:Введение в титрование (видео 1)| Титриметрический анализ | ХимияСкачать

Классификация методов комплексонометрического титрования
Как и большинство титриметрических методов, комплексонометрию можно проводить прямым, обратным или заместительным титрованием.
В случае прямого титрования первоначальное окрашивание раствора вызвано взаимодействием индикатора с металлом. В дальнейшем сильный комплексообразователь трилон Б вытесняет индикатор, образуя с металлом более устойчивый комплекс. В ходе этого взаимодействия наблюдается смена цветности раствора. Титрант добавляется до получения устойчивого окраса, что говорит о присутствии в растворе свободного Трилона Б.
Обратный метод титрования подразумевает добавление избытка комплексона к раствору. Непрореагировавшую часть ЭДТА оттитровывают солью цинка или магния. Зная первоначально добавленный объем ЭДТА и вычтя из него количество оттитрованного избытка, можно вычислить содержание металла, вступившего во взаимодействие с комплексоном. Этот способ предпочтителен для элементов, которые медленно взаимодействуют с Трилоном Б, для которых сложно подобрать индикатор. Металлы в нерастворимых в воде солях тоже определяют обратным титрованием. Кроме того, если индикатор образует более прочный комплекс с металлом, чем титрант, то обратное комплексонометрическое титрование поможет определить его содержание.
При заместительном титровании к образцу добавляют комплексы металлов, которые легко вытесняются определяемыми металлами в образце. Избыток добавленного раствора оттитровывается стандартным раствором ЭДТА.
Видео:8 класс. ОВР. Окислительно-восстановительные реакции.Скачать

Комбинированные методы комплексонометрического титрования
Комбинацией упомянутых методов можно определять не только катионы, но и анионы, такие как SO4 2- ; PO4 3- ; CrO4 2- . Для этого их сначала осаждают, фильтруют, растворяют в известном количестве ЭДТА. Избыток ЭДТА оттитровывают сульфатом цинка.
Видео:Комплексиметрия: комплексонометрия, меркуриметрия.Скачать

Виды комплексонометрического титрования
Различают комплексонометрические методы в зависимости от используемого хелата:
Трилон Б – трилонометрия. Обычно применяется для определения катионов металлов.
Соединения ртути – меркуриметрия. Применяется для анализа анионов (галогенов, цианидов и пр.).
Фосфорорганические комплексоны. Применяются относительно недавно и позволяют специфично определять катионы металлов даже в смесях.
Можно классифицировать методы комплексонометрического титрования в зависимости от используемого индикатора.
Видео:Решение задач по уравнениям параллельно протекающих реакций. 1 часть. 11 класс.Скачать

Индикаторы для комплексонометрического титрования
Выбор индикатора в первую очередь зависит от условий титрования. Для анализа катионов металлов наиболее универсален индикатор Эриохром черный Т, который применяется для определения Mg + ; Са 2+ ; Zn 2+ ; Cd 2+ ; Pb 2+ ; Мn 2+ .
Широкий спектр элементов можно определять с помощью Ксиленолового оранжевого, в том числе редкоземельные элементы, висмут и Fe 3+ .
Также в комплексонометрическом титровании используют такие индикаторы, как: Пирокатехиновый фиолетовый, Мурексид, кальцес, Хромовый темно¬синий, Бериллон II, Кальцион, Кальцеин и пр.
При индикаторном титровании необходимо четко фиксировать смену окраса индикатора для определения конечной точки титрования. Учитывая особенности индивидуального цветовосприятия, момент перехода окраса у разных лаборантов может отличаться, что влияет на точность получаемых результатов, повторяемость.
Видео:Осадительное титрование.Скачать

Применение комплексонометрического титрования
Методы комплексонометрического титрования особенно важны при определении Ca и Mg при анализе воды на жесткость (ГОСТ 52407-2005, ГОСТ 4151-72, ПНД Ф 14.1:2.98-97 и др. методики). Эти показатели определяют ее целевое назначение и пригодность для бытового и технологического использования. Кроме этого существуют внутренние нормативные документы на предприятиях, которые регулируют качество используемой воды и методы ее анализа.
Методики определения других элементов востребованы в различных отраслях химической промышленности. Эти задачи решаются титрованием. В ГОСТ 10398-2016 представлены методы анализа для широкого перечня элементов в составе реактивов и особо чистых веществ.
🎬 Видео
Лекция Комплексонометрия. Редоксиметрия. СедиметрияСкачать

КомплексонометрияСкачать

Кузьмич Е.С. Комплексонометрическое титрование.Скачать

Решение задач на термохимические уравнения. 8 класс.Скачать

Кузьмич Е.С. Окислительно восстановительное титрование.Скачать

Определение концентрации вещества в растворе методом титриметрииСкачать

Окислительно-восстановительное титрование: перманганатометрия.Скачать

Комплексонометрическое титрование с использованием цифровых датчиковСкачать

Аргентометрия. Методы Мора, Фольгарда, Фаянса-Фишера-Ходакова.Скачать

Шеховцова Т.Н. - Аналитическая химия - Окислительно-восстановительное титрование. Скорость реакцийСкачать

Окислительно-восстановительное титрование: броматометрия, иодатометрия.Скачать

Электролитическая диссоциация. Тема 9. Расчеты по уравнениям химических реакцийСкачать