Работа добавлена на сайт samzan.ru: 2015-07-10
Если у вас возникли сложности с курсовой, контрольной, дипломной, рефератом, отчетом по практике, научно-исследовательской и любой другой работой — мы готовы помочь.
1. Фармакопейный анализ калия и натрия йодидов. Представьте полную характеристику и сравнительную оценку лекарственных средств
Натрия бромид Natrii bromidum
Калия бромид Kalii bromidum
Натрия йодид Natrii iodidum
Калия йодид Kalii iodidum
Описание. Растворимость. Белые кристаллические порошки без запаха, соленого вкуса. Натрия бромид гигроскопичен. Йодиды во влажном воздухе сыреют и разлагаются с выделением йода. Бромиды легко растворимы в воды, йодиды — очень легко растворимы, в спирте йодиды легко растворимы, а бромиды менее растворимы.
Существуют различные способы промышленного получения бромидов. Один них основан на использовании бромида железа ( II ) и ( III ), который является отходом некоторых химических производств или получается при обработке железных стружек бромом:
3 Fe + 4 Br 2 → Fe 3 Br 8
Раствор бромида железа ( II ) и ( III ) нагревают до кипения и прибавляют к нему раствор карбоната натрия или калия до щелочной реакции:
Fe 3 Br 8 + 4 Na 2 CO 3 + 4 H 2 O → 8 NaBr + 2 Fe(OH) 3 ↓+ Fe(OH) 2 ↓ + 4 CO 2 ↑
По такой же схеме синтезируют натрия или калия иодиды из иодида железа ( II ) и ( III ).
После отделения гидроксидов железа ( II ) и ( III ) фильтрат подкисляют соответственно бромоводородной или йодоводородной кислотой и сгущают до кристаллизации.
Для испытания на подлинность так же выполняют качественные реакции на соответствующие катионы и анионы.
1) Катионы натрия и калия обнаруживают по реакциям, приведенным в ОФС ГФ.
2) Бромид- и йодид-ионы можно обнаружить:
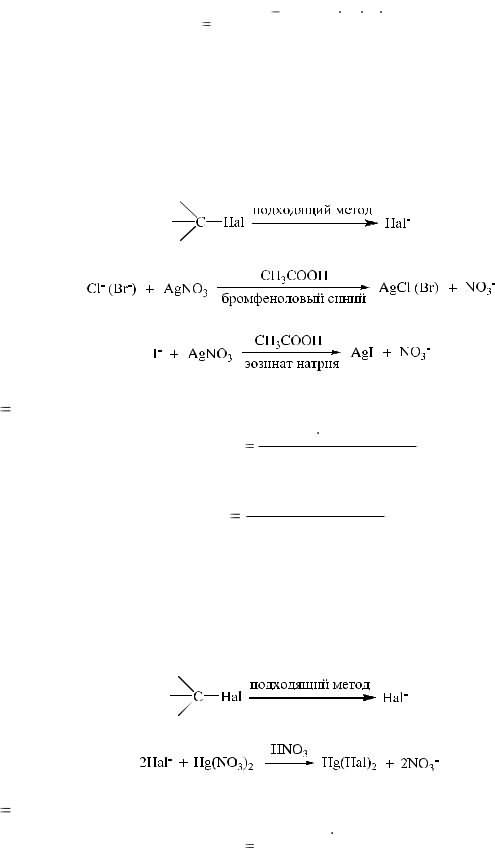
- осадочной реакцией с раствором нитрата серебра в азотнокислой среде. Образуется бромид серебра светло-желтого цвета, мало растворимый в растворе аммиака. Йодид серебра желтого цвета, нерастворимый в аммиаке.
- Бромиды и иодиды обнаруживают также с помощью реакций окисления галогенидов до свободных галогенов, используя различные окислители. Образующиеся галогены извлекают хлороформом и наблюдают окраску хлороформного слоя. Для обнаружения бромид-иона в качестве окислителя используют хлорамин в присутствии хлористоводородной кислоты. Слой хлороформа окрашивается в желто-бурый цвет. Йодид-ион окисляют раствором нитрита натрия в кислой среде. Выделившийся йод окрашивает слой хлороформа в фиолетовый цвет. Слабые окислители выделяют из йодидов молекулярный йод, а сильные окислители могут окислять выделившийся йод до бесцветных гипойодидов или йодатов, поэтому большое значение имеет выбор окислителя и его концентрации.
- Бромиды с сульфатом меди образуют черный осадок: NaBr + CuSO 4 → CuBr 2 ↓ + K 2 SO 4
- Йодиды образуют с ацетатом свинца желтый осадок:
2 NaI + Pb ( CH 3 COO ) 2 → PbI 2 ↓ + 2 CH 3 COONa
- Йодиды так же образуют осадок йодида висмута черного цвета, который в избытке
йодида образует оранжево-желтый раствор: 6 К I + Bi 2 ( SO 4 ) 3 → 2 BiI 3 ↓ + 3 К 2 SO 4
BiI 3 + К I → К[ BiI 4 ]
- Йодиды при нагревании с концентрированной серной кислотой образуют фиолетовые пары.
- К Br и NaBr : допустимы — SO 4 2- , т.м., Fe , As .
недопустимы — йодиды, Ba 2+ , Ca 2+ , броматы, K + и Na + антагонисты.
- KI и NaI : допустимы — SO 4 2- , т.м., Fe , As .
недопустимы — цианиды, Ba 2+ , йодноватая кислота, S 2 O 3 2- , сульфит, нитраты.
- Примеси броматов обнаруживают добавлением серной кислоты:
5 КВ r + КВ r О 3 + 3 H 2 S О 4 → 3 В r 2 + 3 К 2 S О 4 + 3 Н 2 О
При наличии примесей появляется желтое окрашивание.
- Примесь S 2 O 3 2- и сульфит-ионов обнаруживают реакцией с раствором йода в присутствии крахмала: I 2 + Na 2 SO 3 + H 2 O → Na 2 SO 4 + 2 HI
I 2 + 2 Na 2 S 2 O 3 → Na 2 S 4 O 6 + 2 NaI
Синее окрашивание должно появляться после добавления не более одной капли 0,1 н раствора йода, что свидетельствует об отсутствии примеси указанных ионов.
- Нитрат-ионы обнаруживают по реакции с цинковыми или железными опилками в щелочной среде: Zn + 2 NaOH → Na 2 ZnO 2 + H 2 ↑
4 H 2 + NaNO 3 → NH 3 ↑ + NaOH + 2 H 2 O
Выделяющийся аммиак окрашивает при наличии примеси нитратов влажную красную лакмусовую бумагу в синий цвет.
1) Определяют аргентометрическим методом. Йодиды и бромиды определяют методом Фаянса в уксуснокислой среде, используя в качестве титранта 0,1 н раствор нитрата серебра и адсорбционный индикатор — эозинат натрия. После осаждения иодид-ионов образующиеся коллоидные частицы иодида серебра от добавления избытка ионов серебра становятся положительно заряженными. Одновременно с приобретением положительного заряда коллоид притягивает отрицательно заряженный анион индикатора — эозината натрия. В эквивалентной точке окраска поверхности осадка резко изменяется из желтой в розовую.
2) Можно так же определить бромиды и йодиды меркуриметрическим методом. В случае йодидов без индикатора.
Натрия и калия бромиды применяют в качестве седативных средств внутрь и
внутривенно. Выпускают их в виде ампулированных 5, 10 и 20 %-ных растворов. Йодиды применяют при недостатке йода в организме — эндемическом зобе и некоторых воспалительных заболеваниях.
Препараты бромидов и иодидов хранят в сухом месте в плотно укупоренных банках оранжевого стекла, предохраняя от действия света. Калиевые соли бромидов и иодидов отличаются меньшей гигроскопичностью. Они могут содержать лишь до 1 % влаги, в то время как натриевые соли — до 4 5 %.
2. Натрия тиосульфат. Представьте полную характеристику лекарственного средства, используя приведенный алгоритм
;font-family:’Arial’;color:#000000″>Описание. Растворимость ;font-family:’Arial’;color:#000000″>. Бесцветные прозрачные кристаллы, без запаха, солоновато-горького вкуса. Препарат выветриваются в теплом сухом воздухе, а во влажном воздухе слегка расплывается. Очень легко растворим в воде, практически не растворим в спирте.
;font-family:’Arial’;color:#000000″> Впервые натрия тиосульфат получен в 1799 г. кипячением смеси раствора сульфита натрия с серой:
;font-family:’Arial’;color:#000000″>Na2SO3 + S → Na2S2O3
;font-family:’Arial’;color:#000000″>Окончание процесса устанавливают по отрицательной реакции на сульфит ионы с раствором хлорида кальция. Затем отфильтровывают избыток серы и сгущают фильтрат до кристаллизации. Этот способ используется и в настоящее время. Источниками получения препарата могут служить сульфиды (Na2S и CaS) или полисульфиды (CaS2), которые подвергают окислению кислородом или диоксидом серы:
;font-family:’Arial’;color:#000000″ xml:lang=»en-US» lang=»en-US»>2 Na2S + 3 SO2 → 2 Na2S2O3 + S↓
;font-family:’Arial’;color:#000000″>диоксид ;font-family:’Arial’;color:#000000″ xml:lang=»en-US» lang=»en-US»> ;font-family:’Arial’;color:#000000″>серы
;font-family:’Arial’;color:#000000″ xml:lang=»en-US» lang=»en-US»> 2 CaS2 + 3 O2 → 2 Ca2S2O3 Ca2S2O3 + Na2SO4 → Na2S2O3 + CaSO4
;font-family:’Arial’;color:#000000″> Идентифицируют натрия тиосульфат по реакции на ион натрия и тиосульфат ион. на Na+: окрашивание пламени в желтый цвет и реакция с цинк-уранил ацетатом желтый осадок. на S2O32-:
;font-family:’Arial’;color:#000000″> а) Na2S2O3 + 2 HCl → ↑ SO2 + 2NaCl + S↓ + H2O запах опалесценция диоксида серы
;font-family:’Arial’;color:#000000″>б) Na2S2O3 + 2 AgNO3 изб. → Ag2S2O3 ↓ + 2 NaNO3 белый | ↓ ↓ Ag2SO3 + S↓ + H2O → Ag2S↓ + H2SO4 желтеет, буреет черн. ;font-family:’Arial’;color:#000000″>Доброкачественность
;font-family:’Arial’;color:#000000″> ;font-family:’Arial’;color:#000000″>Допустимы ;font-family:’Arial’;color:#000000″>: Cl- , Fe, тяжелые металлы.
;font-family:’Arial’;color:#000000″> ;font-family:’Arial’;color:#000000″>Недопустимы ;font-family:’Arial’;color:#000000″>: 2
;font-family:’Arial’;color:#000000″> SO42- и сульфиты, открывают добавлением 0,1 н раствора I2 до желтого окрашивания и последующим прибавлением раствора Ba (NO3)2; раствор должен быть прозрачным.
;font-family:’Arial’;color:#000000″> S2- открывают раствором нитропруссида натрия в присутствии раствора аммиака; не должно быть фиолетового окрашивания.
;font-family:’Arial’;color:#000000″> недопустимы так жеСa2+, As, селен.
;font-family:’Arial’;color:#000000″>Йодометрия ;font-family:’Arial’;color:#000000″>: метод основан на окислительно-восстановительной реакции тиосульфата натрия с йодом:
;font-family:’Arial’;color:#000000″> I2 + 2 Na2S2O3 → 2 NaI + Na2S4O6
;font-family:’Arial’;color:#000000″>Процесс происходит в присутствии KI, при этом I2 образует сначала комплекс KI3, который затем взаимодействует с тиосульфатом натрия. Индикатор крахмал.
;font-family:’Arial’;color:#000000″>Хранят ;font-family:’Arial’;color:#000000″> в хорошо укупоренной таре, так как в сухом и теплом помещении выветривается, а во влажном расплывается, при 50 0С плавится в своей кристаллизационной воде.
;font-family:’Arial’;color:#000000″>Применяю ;font-family:’Arial’;color:#000000″>т в качестве противотоксического и десенсибилизирующего средства. При отравлениях цианидами используют 10 % раствор тиосульфата натрия для св
;font-family:’Arial’;color:#000000″>язывания CN- и образования менее токсичных тиоцианатов: KCN+ Na2S2O3 → KCNS+ Na2SO3
;font-family:’Arial’;color:#000000″> При отравлении солями тяжелых металлов (Ag, As, Pb) тиосульфат натрия связывает их в мало растворимые сульфиды. Йод восстанавливается до иодид-иона. При аллергии тиосульфат натрия вводят внутривенно в виде 10-30 %-ных растворов. Так же применяют наружно 60 % раствор, как инсектицид в составе жидкости Демьяновича.
3 . Метод количественного определения лекарственных средств аргентометрия метод Мора. Приведите обоснование, достоинства и недостатки метода, способы титрования и установления точки эквивалентности. Ответ подтвердите примерами с уравнениями реакций (10 б).
Титриметрические (объемные) методы
Отличаются значительно меньшей трудоемкостью, чем гравиметрический метод, и достаточно высокой точностью.
Метод основан на использовании реакций осаждения или образования малодиссоциированных соединений.
Метод основан на реакциях осаждения галогенидов раствором нитрата серебра.
KCI + AgNO 3 → AgCI ↓ + KNO 3 Э = М.м.
Прямое титрование: Метод Мора : среда нейтральная, индикатор — хромат калия, определяют Cl — и Br — . Метод Фаянса: среда уксуснокислая, индикатор — флуоресцеин ( Cl — ) и эозинат натрия ( I — , Br — ).
Обратное титрование (роданометрия, тиоцианометрия): Метод Фольгарда: среда азотнокислая, индикатор — железоаммониевые квасцы, титранты — AgNO 3 и NH 4 CNS , в точке эквивалентности появляется красное окрашивание. Косвенный метод Фольгарда: сначала после добавления 0,1 мл 0,1 М раствора NH 4 CNS появляется красное окрашивание от взаимодействия с индикатором, а затем титруют раствором AgNO 3 до обесцвечивания.
Аргентометрически определяют галогениды щелочных металлов, четвертичных аммониевых оснований, соли галогеноводородных кислот органических оснований, сульфамидов.
Например : сульфаниламиды образуют соли серебра в виде белого осадка.
Аргентометрический метод отличается высокой чувствительностью, правильностью и воспроизводимостью, прост в исполнении. Однако значительный расход дорогостоящего серебра настоятельно требует его замены.

Материалы собраны группой SamZan и находятся в свободном доступе
- Количественное определение калия йодида
- / ГОСы Все предметы / Ответы для 5 курса / з3-калия йодид
- / ДЛЯ ГОСОВ / Фарм-химия-прак-11 / ГАК-3-калия йодид
- / АРГЕНТОМЕТРИЯ. остаток лекции
- Количественное определение галогенидов
- Методы идентификации органических соединений, содержащих ковалентно-связанныйатом серы
- Количественное определение
- Ситуационная задача №. 1. При проведении оценки качества калия йодида в образцах одной серии внешний вид не отвечал требованиям НД по разделу «Описание» — порошок был влажным и
- Количественное определение
- ФС.2.2.0008.15 Калия йодид
- ФС.2.2.0008.15 Калия йодид
- Описание
- Растворимость
- Подлинность
- Прозрачность раствора
- Цветность раствора
- Щелочность
- Сульфаты
- Цианиды
- Барий
- Тяжелые металлы
- Железо
- Йодноватая кислота, тиосульфаты, сульфиты
- Нитраты
- Мышьяк
- Потеря в массе при высушивании
- Микробиологическая чистота
- Количественное определение
- Хранение
Видео:8 класс. Составление уравнений химических реакций.Скачать

Количественное определение калия йодида
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

/ ГОСы Все предметы / Ответы для 5 курса / з3-калия йодид
Провести все виды внутриаптечного контроля для данной лекарственной формы согласно приказа МЗ РФ №214
Количественный анализ провести методом аргентометрии (вариант Фаянса)
Дать обоснование метода
Написать уравнения реакций
Сделать расчет допустимых норм отклонений
Рассчитать содержание калия йодида в лекарственной форме
К 1 мл лекарственной формы (пипетка Мора) прибавить 1 мл воды очищенной, 3 капли разбавленной кислоты уксусной и 1-2 капли эозината натрия. Титровать раствором серебра нитрата (0,1 моль/л) до образования розового осадка над раствором.
M.м. (KI) = 166,01 г/моль
Сделать заключение о качестве препарата (лекарственной формы)
На анализ поступила жидкая ЛФ для внутреннего применения – раствор калия йодида3% — 100 мл. Согласно приказа МЗ РФ № 214 проводят следующие виды контроля.
1. Физический контроль.
Бесцветная прозрачная жидкость без механических примесей; допустимая норма отклонений на объем
100 мл ± 3% ± 3 мл
97 мл ≤ х ≤ 103 мл
Вывод: объем ЛФ соответствует прописанному в рецепте.
2. Химический контроль.
Проводится по реакциям на подлинность ионов К+иI-.
а) Реакция с винно-каменной кислотой в присутствии ацетата натрия и этанола:
K
Образуется белый осадок гидротартрата калия.
Реакция проводится в присутствии ацетата натрия для создания необходимой кислотности среды.
б) Реакция с раствором кобальтинитрита натрия (гексанитрокобальтата натрия)
Реакцию проводят в уксуснокислой среде. Образуется желтый осадок.
в) Пирохимическая реакция.
Бесцветное пламя спиртовки окрашивается в присутствии К+ в фиолетовый цвет.
а) Реакция с раствором нитрата серебра в присутствии азотной кислоты.
Образуется желтый творожистый осадок. Осадок нерастворим в растворах аммиака.
б) Реакция окисления йодид-иона до элементарного галогена.
К раствору ЛФ добавляют разведенную серную кислоту, хлороформ, нитрит натрия или хлорид окисного железа (FeCl3), встряхивают, дают отстояться. Хлороформный слой окрашивается в фиолетовый цвет.
Вывод:ЛФ соответствует своему наименованию.
3. Количественный анализ
Количественное определение проводят методом аргентометрии, вариант Фаянса, среда уксусной кислоты, индикатор – эозинат натрия.
Йодиды нельзя определять методом Мора, так как титрование их сопровождается образованием коллоидных систем йодида серебра и адсорбцией, что затрудняет установление конечной точки титрования. Поэтому йодиды определяют титрованием нитратом серебра с применением адсорбционных индикаторов, являющихся солями слабых органических кислот, например эозината натрия
По мере титрования йодида нитратом серебра образуется коллоидный осадок AgI, частицы которого обладают большой адсорбционной способностью. Заряженные положительно, они адсорбируют на своей поверхности отрицательно заряженные анионы индикатора и в эквивалентной точке вызывают изменение цвета осадкаAgIот желтого до розового.
Т = 

1 мл 0,1 н. раствора нитрата серебра соответствует 0,01660 г калия йодида
Расчет допустимых норм отклонений:
Масса KI= 3,0 г (по рецепту)
X(KI) =
где V(AgNO3) – количество титрантаAgNO3, пошедшего на титрование;
k(AgNO3)·- поправочный коэффициент;
Т (KI) ·- титр калия йодида по серебра нитрату;
V(лф) – объем прописанной ЛФ;
а (лф) – навеска, взятая на титрование.
Заключение о качестве ЛФ.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

/ ДЛЯ ГОСОВ / Фарм-химия-прак-11 / ГАК-3-калия йодид
Гоу впо пензенский государственный университет
Итоговый междисциплинарный экзамен
Эталон ответа к ситуационной задаче №3А
На анализ поступила жидкая ЛФ для внутреннего применения – раствор калия йодида3% — 100 мл. Согласно приказа МЗ РФ № 214 проводят следующие виды контроля.
1. Физический контроль.
Бесцветная прозрачная жидкость без механических примесей; допустимая норма отклонений на объем
100 мл ± 3% ± 3 мл
97 мл ≤ х ≤ 103 мл
Вывод: объем ЛФ соответствует прописанному в рецепте.
2. Химический контроль.
Проводится по реакциям на подлинность ионов К+иI-.
а) Реакция с винно-каменной кислотой в присутствии ацетата натрия и этанола:
K
Образуется белый осадок гидротартрата калия.
Реакция проводится в присутствии ацетата натрия для создания необходимой кислотности среды.
б) Реакция с раствором кобальтинитрита натрия (гексанитрокобальтата натрия)
Реакцию проводят в уксуснокислой среде. Образуется желтый осадок.
в) Пирохимическая реакция.
Бесцветное пламя спиртовки окрашивается в присутствии К+ в фиолетовый цвет.
а) Реакция с раствором нитрата серебра в присутствии азотной кислоты.
Образуется желтый творожистый осадок. Осадок нерастворим в растворах аммиака.
б) Реакция окисления йодид-иона до элементарного галогена.
К раствору ЛФ добавляют разведенную серную кислоту, хлороформ, нитрит натрия или хлорид окисного железа (FeCl3), встряхивают, дают отстояться. Хлороформный слой окрашивается в фиолетовый цвет.
Вывод:ЛФ соответствует своему наименованию.
3. Количественный анализ
Количественное определение проводят методом аргентометрии, вариант Фаянса, среда уксусной кислоты, индикатор – эозинат натрия.
Йодиды нельзя определять методом Мора, так как титрование их сопровождается образованием коллоидных систем йодида серебра и адсорбцией, что затрудняет установление конечной точки титрования. Поэтому йодиды определяют титрованием нитратом серебра с применением адсорбционных индикаторов, являющихся солями слабых органических кислот, например эозината натрия
По мере титрования йодида нитратом серебра образуется коллоидный осадок AgI, частицы которого обладают большой адсорбционной способностью. Заряженные положительно, они адсорбируют на своей поверхности отрицательно заряженные анионы индикатора и в эквивалентной точке вызывают изменение цвета осадкаAgIот желтого до розового.
Т = 

1 мл 0,1 н. раствора нитрата серебра соответствует 0,01660 г калия йодида
Расчет допустимых норм отклонений:
Масса KI= 3,0 г (по рецепту)
X(KI) =
где V(AgNO3) – количество титрантаAgNO3, пошедшего на титрование;
k(AgNO3)·- поправочный коэффициент;
Т (KI) ·- титр калия йодида по серебра нитрату;
V(лф) – объем прописанной ЛФ;
а (лф) – навеска, взятая на титрование.
Заключение о качестве ЛФ.
Зам. председателя ГАК, доцент Сидорова Е.Ф.
Видео:8 класс. ОВР. Окислительно-восстановительные реакции.Скачать

/ АРГЕНТОМЕТРИЯ. остаток лекции
Аргентометрический методоснован на свойстве галогенид-ионов количественно осаждаться серебра нитратом с образованием галогенидов серебра.
F
Метод является фармакопейным и используется в экспресс-анализе
Для количественного определения натрия и калия галогенидов в ЛП используются варианты метода:
Вариант Мора (прямое титрование); индикатор — калия хромат.
Среда – нейтральная или слабо-щелочная рН=7,0 – 10,0.
Натрия хлорид, калия хлорид, натрия бромид, калия бромид.
(оранжево-желтый ГФ Х)
Осадок Ag2CrO4↓образуется только при полном осаждении хлорид и бромид-ионов, т.к. растворимость его больше растворимости AgCI↓ и AgBr↓.
А) В кислой среде рН,т.к. в кислой среде хромат-ион CrO42-переходит в дихроматCr2O72 и индикаторными свойствами не обладает вследствие высокой растворимостиAg2Cr2O7-(равновесие реакции диссоциации CrO42-смещено вправо)
Б) В щелочной среде рН>10 не работает титрант, т.к. образуется осадок AgOH, который распадается на оксид Ag2O и воду
Натрия йодид и калия йодид методом Мора не определяют, т.к.
1) йодиды адсорбируются на осадке AgI, окраска появиться до точки эквивалентности (заниженные результаты),
2) окраска осадков серебра йодида и серебра хромата близка по цвету.
Метод может быть использован для количественного определения хлоридов и бромидов в ЛП, содержащих ЛB слабо-основного характера (например, натрия бензоат), создающих слабощелочную реакцию среды.
Вариант Фаянса (прямое титрование). Титрант: раствор серебра нитрата.
Индикаторы — адсорбционные (натрия эозинат, бромфеноловый синий, флюоресциин). Среда разведенной уксусной кислоты необходима, т.к. индикаторы являются слабыми протолитами, а при титровании в уксусной кислоте преобладает ионная форма индикатора. Изменение окраски в т.э. происходит за счет адсорбционных процессов, протекающих на поверхности осадка AgI.
Натрия йодид, калия йодид; Титрант: раствор серебра нитрата.
индикатор — натрия эозинат. Среда — уксуснокислая (разбавленная CH3COOH).
а) NaInd ←→ Ind- + Na+
в) Ind- + AgI↓ + AgNO3 → [(AgI)Ag+]Ind-↓ + NO3-
Изб.капля Розовый осадок
В процессе титрования 0,1н AgNO3 идет осаждение иодид-ионов с образованием коллоидного осадка AgI. Частицы осадка йодида серебра до т.э. будут адсорбировать на своей поверхности вследствие химического сродства одноименные иод-ионы I- . Будет формироваться коллоидная частица
Ионы индикатора в этот момент не адсорбируются, а остаются в растворе.
В т.э. после полного осаждения йод-ионовI- в избытке Аg+ осадок будет адсорбировать Аg+ и знак заряда частиц осадка будет меняться на положительный
Ионная форма индикатора с отрицательным зарядом будет притягиваться положительным зарядом коллоидной частицы и образовывать окрашенное адсорбционное соединение
AgI·nAg+·nInd— (от розового в растворе до розового на осадке).
Т.о. титрование заканчивается при образовании розового осадка.
На точность фиксации т.э. влияет:
величина рН. Адсорбционные индикаторы являются слабыми протолитами, поэтому титрование при определенном значении рН в уксуснокислой среде
концентрация раствора. С ↑ площади поверхности осадка — ↑ количество адсорбированных молекул индикатора и более резкое изменение окраски в т.э. При увеличении концентрации иодид-ионов в растворе повышается точность.
посторонние ионы. Адсорбционные индикаторы чувствительны к значению ионизации посторонних ионов в растворе. Это учитывается при определении йодидов в многокомпонентных смесях.
Вариант Фаянса может быть применен для определения хлоридов и бромидов. В качестве индикаторов используются бромфеноловый синий или флуоресцеин. Используют для определения НCI и НBr азотистых оснований (новокаин — прокаин).
Натрия эозинат не применяют, т.к. он адсорбируется на осадках AgCI и AgBr раньше точки эквивалентности.
R ∙ НС1 + AgNO3 → AgCl↓ + R· HNO3
Фольгарда (обратное титрование). Галогены осаждаются избытком титранта серебра нитрата. Не вступивший в реакцию осаждения серебра нитрат, оттитровывается р-ром тиоцианата аммония, индикатор — железоаммонийные квасцы.
NaCI +AgNO3(избыток) → AgCI↓ + NaNO3
Вариант Кольтгофа (прямое титрование).
Используется для определения натрия и калия йодидов (селективный метод) в многокомпонентных ЛП, содержащих другие галогениды (например, NaCI, KCI, CaCl2, NaBr, KBr).Титрант: раствор серебра нитрата.
Индикатор: йодкрахмальный — 1 капля раствора калия йодата (0,1 моль/л) УЧ (1/6 KIO3), раствор крахмала (2 мл) и по каплям разведенной кислоты серной до появления синего окрашивания.
I2 + KI + крахмал синее окрашивание
По мере титрования из раствора осаждаются йодиды, связываясь с серебра нитратом:
В точке эквивалентности происходит обесцвечивание раствора, т. к. йодиды полностью исчезнут из раствора.
Хлориды и бромиды не мешают определению, т.к. могут осаждаться только после йодид-ионов (ПРAgI = 1,5 • 10-16; ПР AgBr = 4,4 • 10-13; ПР AgCI = 1,8· 10-10).
Аргентометрический метод дает точные результаты, быстр в выполнении. Недостаток: титрант серебра нитрат — дорогостоящий реактив, поэтому метод не экономичен.
2. Меркуриметрический метод.Основан на свойстве галогенид-ионов количественно взаимодействовать с солями ртути (II) с образованием труднодиссоциируемых (малоионизированных) галогенидов ртути (П). Применяют для всех галогенидов натрия и калия.
Титранты — легко ионизированные соли ртути (II): ртути (II) нитрат -Hg(NO3)2, ртути (II) перхлорат — Hg(CIO4)2. Среда: азотнокислая.
F
Йодиды натрия и калиятитруют в присутствии этанола, концентрация которого в конце титрования должна быть не менее 55%, т.к. ртути йодид мало растворим в воде и имеет ярко-красную окраску осадка, что затрудняет фиксирование точки эквивалентности. Используется свойство ртути (II) йодида растворяться в спирте с образованием бесцветных растворов.
Титрант:ртути (И) перхлорат (0,01 моль/л) УЧ [1/2Hg(ClO4)2]
F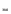
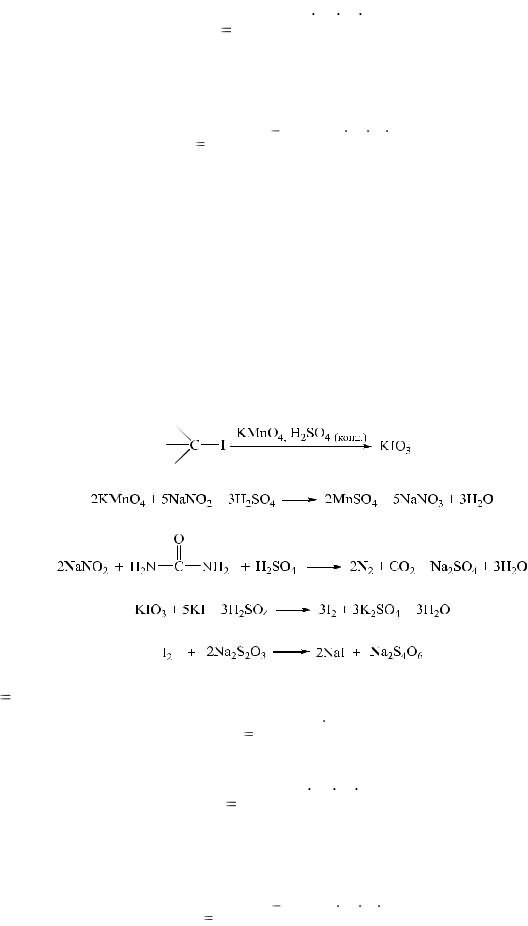
3. Броматометрический метод. Используется в анализе йодидов калия и натрия.
Метод основан на восстановительных свойствах йодидов. Йодид-ионы окисляются калия броматом в среде кислоты хлороводородной до йодмонохлорида:
6KI + KBrO3 + 6HCI → 3I2 + 6КС1 + KBr + ЗН2O
6KI + 2KBrO3 + 12HCI → 6ICI + 2KBr + 6KCI + 6Н2O
Уравнение после сокращения коэффициентов:
3KI + KBrO3 + 6HCI → 3ICI + KBr + 3KCI + 3Н2O
F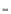

ХУТ – для хлорида калия и хлорида натрия, ХУТ + темное стекло – для бромида калия и бромида натрия, ХУТ +темное стекло + сухое место – для йодида калия и йодида натрия.
В хорошо укупоренной таре, в сухом месте (натрия бромид и йодид, калия йодид — гигроскопичны). Бромиды и йодиды легко окисляются до свободного галогена, поэтому их необходимо хранить в защищенном от света месте (в склянках темного стекла).
Натрия хлорид, Плазмозамещающее, дезинтоксикационное, гидратирующее, нормализующее кислотно-щелочное состояние (КЩС).
Калия хлорид. Нормализует КЩС, восполняет дефицит калия.
Натрия бромид и калия бромид. Седативные средства.
Натрия йодид и калия йодид. Восполняют дефицит йода. Проявляют противомикробное, протеолитическое, муколитическое действие.
Последовательное доказательство галогенидов в лекарственных формах.
В случае совместного присутствия галогенидов в лекарственных формах для их доказательства используют прием последовательного окисления сильным окислителем — калия перманганатом в кислой среде.
Сначала окисляются более сильные восстановители — йодиды, реакция сопровождается образованием свободного йода, придающего анализируемому раствору темно-бурую окраску; если добавить хлороформ, его слой окрашивается в фиолетовый цвет
При дальнейшем добавлении окислителя образовавшийся на первой стадии йод окисляется до йодата (йодноватой кислоты), при этом водный и хлороформный слои обесцвечиваются
После того, как йодиды будут окислены до йодатов, дальнейшее добавление окислителя — калия перманганата приведет к окислению бромидов
Раствор при этом окрашивается в желто-бурый цвет; добавляют хлороформ — бром лучше растворяется в хлороформе, чем в воде, взбалтывают анализируемый раствор с хлороформом до полного обесцвечивания (хлороформный слой окрашен в желто-бурый цвет) водного слоя. После отстаивания слоев водный слой отделяют, избыток калия перманганата удаляют добавлением по каплям раствора пероксида водорода и затем в этом растворе доказывают наличие хлорид-иона реакцией с серебра нитратом.
Видео:Решение задач по уравнениям реакций, если одно из реагирующих веществ взято в избытке. 1 ч. 9 класс.Скачать

Количественное определение галогенидов
Эту реакцию можно положить в основу количественного определения фторсодержащих веществ фотоэлектроколориметрическим методом или титриметрическим, используя в качестве титранта циркония нитрат.
Также фториды можно определять по реакции с солями кальция по образованию нерастворимого белого осадка кальция фторида:
Для количественного определения галогенидов используются аргентометрические методы Фольгарда и Фаянса, меркуриметрические методы.
1. Метод Фольгарда (аргентометрия).
Этот метод является универсальным. После переведения ковалентносвязанного галогена в ионное состояние подходящими методами проводят титрование избытка серебра нитрата раствором аммония тиоцианата в азотнокислой среде, в качестве индикатора используют раствор железоаммониевых квасцов:
Сэ(AgNO )M (1/ z)препарата
K NH4 NCS ) T 100
Расчетная формула содержания препарата с учетом контрольного опыта:
2. Метод Фаянса (аргентометрия).
После перевода галогена в ионное состояние осуществляют титрование в слабо уксуснокислой среде в присутствии адсорбционных индикаторов. При титровании хлоридов и бромидов применяют бромфеноловый синий, а при титровании йодидов – эозинат натрия:
Сэ(AgNO )M (1/ z)препарата,
VAgNO3 


3. Меркуриметрический метод.
После перевода галогена в ионное состояние проводят титрование раствором ртути (II) нитрата в азотнокислой среде. В качестве индикатора используют дифенилкарбазид:
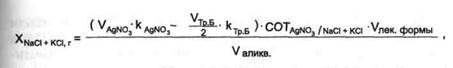 |
где VAgNO — объем 0,1 н. раствора серебра нитрата, пошедший на титрование суммы хлоридов натрия, калия и кальция; VT Б — объем трилона Б, пошедший на титрование кальция хлорида; COT^q /Naci+Kci — сРеДний ориентировочный титр при титровании натрия и калия хлоридов 0,1 н. раствором серебра нитрата.
Значение СОТ 0,1 н. раствора серебра нитрата для суммы натрия и калия хлоридов рассчитывают следующим образом:
Специфическими примесями для калия и натрия бромида быть ионы йодидов, бария, кальция, броматов. Йодиды удаляют с помощью слабого окислителя, каким является железо хлорид, не окисляющий бромиды:
Выделяющийся йод обнаруживают в присутствии крахмала по синему окрашиванию.
Ионы бария, кальция и бромат-ион идентифицируют одним реактивом — концентрированной H2S04. При добавлении реагента к испытуемому раствору не должно, согласно требованиям ГФ появляться помутнения или окрашивания (соли бария и кальция дают нерастворимые сульфаты, а броматы в присутствии 6poма в кислой среде выделяют бром, придающий раствору желтый оттенок
Общий способ количественного определения йодидов по ГФ — прямая аргентометрия с применением адсорбционного индикатора (метод Фаянса).
Сущность метода заключается в том, что адсорбционный индикатор (по ГФ — натрия эозинат) не меняет своего окрашивания (желтовато-красного) до наступления точки эквивалентности.
 |
В точке эквивалентности индикатор адсорбируется на осадке серебра йодида, и цвет осадка становится красно-фиолетовым. Это объясняется тем, что до точки эквивалентности на осадке серебра йодида адсорбируется неоттитрованный йодид-ион (как ион, входящий в состав осадка). Возникающий на поверхности осадка отрицательный заряд препятствует адсорбции на нем индикатора в виде аниона. После того как йодид будет оттитрован полностью, на поверхности осадка будут адсорбироваться ионы серебра (также входящие в состав осадка). При этом на поверхности осадка возникает вызванный ионами серебра положительный заряд, и тогда происходит адсорбция анионов индикатора, вызывающая переход окрашивания осадка. В итоге соединение, находящееся в осадке, примет следующий вид:
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Ситуационная задача №. 1. При проведении оценки качества калия йодида в образцах одной серии внешний вид не отвечал требованиям НД по разделу «Описание» — порошок был влажным и
1. При проведении оценки качества калия йодида в образцах одной серии внешний вид не отвечал требованиям НД по разделу «Описание» — порошок был влажным и желтоватого цвета. Дайте обоснование причинам изменения его качества по данному показателю в соответствии с условиями хранения и свойствами. Приведите другие испытания, характеризующие его качество.
· Приведите русское, латинское и рациональное название препарата. Охарактеризуйте физико-химические свойства (внешний вид, растворимость) и их использование для оценки качества.
· В соответствии с химическими свойствами предложите реакции идентификации и методы количественного определения. Напишите уравнения реакций.
Kalii jodidum Калия йодид
Potassium Yodide М.м. 166,01
Получение.
1) Из йодида закисно — окисного железа действия калия карбонатом
Fe3J8 + 4К2СО3 + 4Н2О →8KJ + Fe(OH)2↓ + 2Fe(OH)3↓ + 4СО2↓
2) Путем действия йода на калия гидроксид.
6КОН + 3J2 → KJО3 + 5KJ + ЗН2О
Описание.Бесцветные или белые кубические кристаллы или белый кристаллический порошок без запаха, солено — горького вкуса. На влажном воздухе сыреет.
Растворимость.Очень легко растворим в воде, легко растворим в спирте.
Одна из серий фармацевтической субстанции калия йодида не отвечал требованиям НД по разделу «Описание» — порошок был влажный и желтоватого цвета, т.к. хранился в плохо закупоренной склянке во влажном воздухе и, обладая восстановительными свойствами под действием кислорода воздуха, окислился до свободного йода и стал жёлтым.
Подлинность.
Препарат дает характерные реакции на йодид-ион и калий.
1)Качественные реакции на йодид-ион.
1.1 KJ + AgNО3 → AgJ↓ + KNO3
Образуется желтый творожистый осадок йодида серебра
СНС13 фиолетовое окрашивание
2)Качественные реакции на катион К+ :
белый кристаллический осадок
2.2 2KJ + Na3[Co(NО2)6] → K2Na[Co(NО2)6] + 2NaJ
Гексанитрокобальтат натрия желтый кристаллический осадок
2.3 Соль калия окрашивает бесцветное пламя горелки в фиолетовый цвет.
Видео:Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Количественное определение
К 2 мл разведенного раствора (10:100) прибавляют 25 мл воды, 5 ил аммиачного буферного раствора, 0,1 г индикаторной смеси кислотного хромчерного специального и титруют 0,05 моль/л раствором трилона Б до синего окрашивания. Параллельно проводят контрольный опыт.1 мл 0,05 моль/л раствора трилона Б соответствует 0,01232 г магния сульфата
Видео:Расчеты по уравнениям химических реакций. 1 часть. 8 класс.Скачать

ФС.2.2.0008.15 Калия йодид
Содержимое (Table of Contents)
Видео:Реакции ионного обмена. 9 класс.Скачать

ФС.2.2.0008.15 Калия йодид
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
ФАРМАКОПЕЙНАЯ СТАТЬЯ
Калия йодид ФС.2.2.0008.15
Калия йодид Взамен ГФ Х, ст. 364;
Kalii iodidum взамен ФС 42-3805-99
Cодержит не менее 99,0 % калия йодида KI в пересчете на сухое вещество.
Видео:Химические уравнения. Урок 15. Химия 7 классСкачать

Описание
Бесцветные или белые кубические кристаллы или белый мелкокристаллический порошок. Гигроскопичен.
Видео:Химия. 8 класс. Составление уравнений химических реакций /25.09.2020/Скачать

Растворимость
Очень легко растворим в воде, легко растворим в глицерине, растворим в спирте 96 %.
Видео:Качественные реакции на катионы. 9 класс.Скачать

Подлинность
Субстанция дает характерные реакции на калий и йодиды (ОФС «Общие реакции на подлинность»).
Видео:Гидролиз солей. 9 класс.Скачать

Прозрачность раствора
Раствор 1 г субстанции в 10 мл воды, свободной от диоксида углерода, должен быть прозрачным (ОФС «Прозрачность и степень мутности жидкостей»).
Видео:Качественные реакции на хлорид-, бромид- и йодид-ионыСкачать

Цветность раствора
Раствор, полученный в испытании «Прозрачность раствора», должен быть бесцветным (ОФС «Степень окраски жидкостей»).
Видео:Составление уравнений реакций горения. 11 класс.Скачать

Щелочность
К 12,5 мл раствора, полученного в испытании «Прозрачность раствора», прибавляют 0,1 мл 0,05 % раствора бромтимолового синего. Цвет раствора должен измениться от прибавления не более 0,5 мл 0,01 М раствора хлористоводородной кислоты.
Видео:ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Сульфаты
Не более 0,015 % (ОФС «Сульфаты», метод 2). 1 г субстанции растворяют в 15 мл воды.
Примечание. Если после прибавления хлористоводородной кислоты разведенной 8,3 % в анализируемом растворе появляется желтая окраска, для ее обесцвечивания прибавляют 0,05 – 0,10 мл 0,1 М раствора натрия тиосульфата; равный объем 0,1 М раствора натрия тиосульфата прибавляют в раствор сравнения.
Видео:Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Цианиды
0,5 г субстанции растворяют в 5 мл воды, прибавляют 0,25 мл раствора железа(II) сульфата в серной кислоте, 0,1 мл 3 % раствора железа(III) хлорида, 1 мл 10 % раствора натрия гидроксида и нагревают. После подкисления хлористоводородной кислотой разведённой 8,3 % раствор не должен окрашиваться в синий цвет.
Примечание. Приготовление раствора железа(II) сульфата в серной кислоте. 3,0 г железа(II) сульфата растворяют в смеси 3 мл свежепрокипячённой и охлажденной воды и 3 мл серной кислоты разведенной 9,8 %.
Видео:Взаимодействие твердого иодида калия с концентрированной серной кислотойСкачать

Барий
0,5 г субстанции растворяют в 10 мл воды, прибавляют 1 мл хлористоводородной кислоты разведенной 8,3 % и 1 мл серной кислоты разведенной 16 %; раствор должен оставаться прозрачным в течение 15 мин.
Видео:ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать

Тяжелые металлы
Не более 0,001 % (ОФС «Тяжёлые металлы»). 1 г субстанции растворяют в 10 мл воды.
Железо
Не более 0,002 % (ОФС «Железо», метод 2). 0,5 г субстанции растворяют в 10 мл воды.
Йодноватая кислота, тиосульфаты, сульфиты
0,5 г субстанции растворяют в 10 мл свежепрокипяченной и охлажденной воды, прибавляют по 0,1 мл раствора крахмала и серной кислоты разведенной 16 %. В течение 30 с не должно появляться синее окрашивание, заметное при рассмотрении жидкости по оси пробирки. Синее окрашивание должно появиться от прибавления не более 1 капли 0,1 М раствора йода.
Нитраты
К 1 г субстанции прибавляют 5 мл 10 % раствора натрия гидроксида, 0,5 г цинковых и 0,5 г железных опилок и нагревают. Выделяющиеся пары не должны вызывать синего окрашивания влажной красной лакмусовой бумаги.
Мышьяк
Не более 0,0001 % (ОФС «Мышьяк»). Для определения используют 1,0 г субстанции.
Потеря в массе при высушивании
Не более 1,0% (ОФС «Потеря в массе при высушивании», способ 1). Для определения используют около 1,0 г (точная навеска) субстанции.
Микробиологическая чистота
Количественное определение
Около 0,3 г (точная навеска) субстанции, предварительно высушенной при температуре от 100 до 105 °С в течение 4 ч, растворяют в 30 мл воды, прибавляют 1,5 мл уксусной кислоты разведенной 30 % и титруют 0,1 М раствором серебра нитрата до перехода окраски осадка от желтой к розовой (индикатор – 0,3 мл 0,1 % раствора эозина Н).
Параллельно проводят контрольный опыт.
1 мл 0,1 М раствора серебра нитрата соответствует 16,60 мг калия йодида KI.
Хранение
В хорошо укупоренной упаковке, в защищенном от света месте.