Тема. «Контроль качества неорганических лекарственных средств элементов VII группы периодической системы
Кислота хлороводородная
Acidum hydrochloricum HCl
Лекарственными средствами являются растворы хлороводорода: кислота хлороводородная (содержание хлороводорода 24,8 – 25,2%) и кислота хлороводородная разведенная (8,2 – 8,4%).
Оба препарата – бесцветные прозрачные жидкости с кислой реакцией среды. Кислота хлороводородная – летучая жидкость, поэтому ее хранят в склянках с притертыми пробками.
Подлинность.
Хлорид-ион в препарате определяют качественной реакцией на гало-
гениды с серебра нитратом или по взаимодействию с окислителями. Хло-
рид-ион проявляет слабые восстановительные свойства и окисляется до
молекулярного хлора при действии сильных окислителей, таких как калия
перманганат, марганца оксид (IV), калия дихромат:
Количественное определение.
Фармакопейной методикой количественного определения кислоты
хлороводородной является алкалиметрия.
Титрант – 0,1 моль/л р-р NaOH
HCl + NaOH → NaCl + H2O
Титруют до желтого окрашивания в точке эквивалентности.
Натрия и калия хлориды
Natrii chloridum NaCl
Kalii chloridum KCl
Оба препарата – белые кристаллические порошки без запаха, соленого вкуса, легко растворимы в воде.
Подлинность.
1. Катионы натрия и калия окрашивают пламя соответственно в желтый и фиолетовый цвета.
2. Соли натрия образуют желтый кристаллический осадок (нераствори-
мый в кислоте уксусной) с цинка уранилацетатом:
3. Соли калия с раствором гексанитрокобальтата (III) натрия образуют желтый кристаллический осадок гексанитрокобальтата (III) натрия и калия:
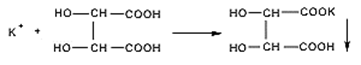
4. С раствором кислоты винно-каменной соли калия образуют осадок калия гидротартрата, который не растворяется в кислоте уксусной, но растворяется в минеральных кислотах и щелочах:
5. Хлорид-ион в данных лекарственных веществах определяют по взаимодействию с раствором серебра нитрата; образуется белый творожистый осадок:
Особенность серебра хлорида, в отличие от бромида и йодида, заключается в
способности легко растворяться в растворах аммиака:
По фармакопее проводят методом прямой аргентометрии по Мору. Титрование ведут в нейтральной среде стандартным раствором серебра нитрата в присутствии калия хромата в качестве индикатора.
Далее, после полного осаждения хлорид-ионов, выпадает красно-оранжевый осадок серебра хромата:
Натрия и калия бромиды
Natrii bromidum NaBr
Kalii bromidum KBr
Бромиды натрия и калия – белые кристаллические порошки хорошо растворимые в воде; реакция среды водных растворов нейтральна. Натрия бромид гигроскопичен.
Подлинность.
1. Бромиды с раствором серебра нитрата образуют желтоватый творожистый осадок:
2. Бромиды окисляются до свободного галогена легче хлоридов, поэтому их идентифицируют также по реакции выделения брома в результате окислительно-восстановительной реакции с хлорамином в кислой среде. Выделяющийся в результате реакции бром извлекают хлороформом, в котором он растворяется лучше, чем в воде, окрашивая его в желто-бурый цвет:
Количественное опредение.
Количественное определение калия и натрия бромидов (как и калия и натрия хлоридов) по ГФ проводят методом прямого аргентометрического титрования по Мору.
Натрия и калия йодиды
Natrii iodidum NaI
Kalii iodidum KI
Калия и натрия йодиды – бесцветные или белые кристаллические порошки; гигроскопичны, отсыревают на влажном воздухе. Являясь энергичными восстановителями, вступают в реакцию с кислородом воздуха, выделяя при этом йод, вследствие чего порошки и растворы данных лекарственных веществ желтеют при неправильном хранении. Свет, примеси тяжелых металлов, кислород воздуха инициируют процессы окисления йодидов.
Подлинность.
1. Йодиды с нитритом натрия в кислой среде окисляются до свободного йода, который окрашивает хлороформный слой в фиолетовый цвет.
2NaNO22 + 2KI + 4HCl ⇒ 2NaCl + 2KCl + I2 + NO + H2O
2. Йодиды с раствором серебра нитрата образуют желтый осадок:
Количественное определение.
Общий способ количественного определения йодидов по ГФ – прямая аргентометрия с применением адсорбционного индикатора (метод Фаянса). Сущность метода заключается в том, что адсорбционный индикатор (по ГФ – натрия эозинат) не меняет своего окрашивания (желтовато- красного) до наступления точки эквивалентности.
Затем, в точке эквивалентности, индикатор адсорбируется на осадке серебра йодида и цвет осадка становится красно-фиолетовым. Это объясняется тем, что до точки эквивалентности на осадке серебра йодида адсорбируется неоттитрованный йодид-ион (как ион, входящий в состав осадка). Возникающий на поверхности осадка отрицательный заряд препятствует адсорбции на нем индикатора в виде аниона. После того как йодид будет оттитрован полностью – на поверхности осадка будут адсорбироваться ионы серебра (также входящие в состав осадка). При этом на поверхности осадка возникает вызванный ионами серебра положительный заряд и тогда
происходит адсорбция анионов индикатора, вызывающая переход окрашивания осадка.
[AgI ∙ I — ]→[AgI ∙ Ag + ]
В итоге соединение, находящееся в осадке, примет следующий вид:
Серовато-черные с металлическим блеском пластинки или сростки кристаллов характерного запаха. Летуч при комнатной температуре, при нагревании возгоняется, образуя фиолетовые пары. Очень мало растворим в воде, легко растворим в водном растворе йодидов, растворим в 10 ч. 95% спирта, эфире и хлороформе.
Solutio Iodi spirituosa 1%, 2%, 3% aut 5%. Раствор йода спиртовой 1%, 2%, 3% или 5%
Прозрачная жидкость красно-бурого цвета с характерным запахом.
Подлинностьйода подтверждают реакцией водных растворов лекарственного вещества с крахмалом, в результате которой образуется синее окрашивание.
Количественно йод определяют титрованием раствора лекарственного вещества (в присутствии калия йодида для лучшего растворения йода) стандартным раствором натрия тиосульфата:
В качестве индикатора используют крахмал, поэтому титрование ве-
- ФС.2.2.0014.15 Натрия хлорид
- ФС.2.2.0014.15 Натрия хлорид
- Описание
- Растворимость
- Подлинность
- *Прозрачность раствора
- *Цветность раствора
- Кислотность или щелочность
- Щелочноземельные металлы и магний
- Барий
- Железо
- Мышьяк
- Сульфаты
- Фосфаты
- Ферроцианиды
- Нитриты
- Бромиды
- Йодиды
- *Алюминий
- *Калий
- *Аммоний
- Тяжелые металлы
- Потеря в массе при высушивании
- Микробиологическая чистота
- *Бактериальные эндотоксины
- Количественное определение
- Хранение
- Количественное определене
Видео:Определение хлорид-ионовСкачать

ФС.2.2.0014.15 Натрия хлорид
Содержимое (Table of Contents)
Видео:Качественная реакция на хлорид, бромид, йодид ион.Скачать

ФС.2.2.0014.15 Натрия хлорид
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
ФАРМАКОПЕЙНАЯ СТАТЬЯ
Натрия хлорид ФС.2.2.0014.15
Натрия хлорид Взамен ГФ Х, ст. 426;
Natrii chloridum взамен ФС 42-2572-95
Содержит не менее 99,0 % натрия хлорида NaCl в пересчете на сухое вещество для субстанции, предназначенной для производства нестерильных лекарственных препаратов.
Содержит не менее 99,5 % натрия хлорида NaCl в пересчете на сухое вещество для субстанции, предназначенной для производства лекарственных препаратов для парентерального применения и глазных капель.
Видео:Натрия хлорид раствор инструкция по применению препарата: Показания, как применять, обзор препаратаСкачать

Описание
Белый кристаллический порошок или крупинки, или бесцветные кристаллы.
Видео:натрия хлорид инструкция по применениюСкачать

Растворимость
Легко растворим в воде, мало растворим в спирте 96 %.
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Подлинность
Раствор 0,1 г субстанции в 2 мл воды должен давать характерную реакцию А на натрий и характерную реакцию на хлориды (ОФС «Общие реакции на подлинность»).
Видео:Количественный анализ. ЛР#2 Определение содержания натрия карбоната и натрия гидрокарбоната в смесиСкачать

*Прозрачность раствора
20,0 г субстанции растворяют в свежепрокипяченной и охлажденной воде и разбавляют водой до 100 мл; полученный раствор должен быть прозрачным (ОФС «Прозрачность и степень мутности жидкостей»).
Видео:Распознавание растворов хлорида бария, сульфата натрия и серной кислотыСкачать

*Цветность раствора
Раствор, полученный в испытании «Прозрачность раствора», должен быть бесцветным (ОФС «Степень окраски жидкостей»).
Видео:Занятие 8. Определение фактора показателя преломления препарата хлорида натрияСкачать

Кислотность или щелочность
К 20 мл раствора, приготовленного в испытании на «Прозрачность раствора», прибавляют 0,1 мл 0,05 % раствора бромтимолового синего. Окраска раствора должна измениться от прибавления не более 0,5 мл 0,01 М раствора натрия гидроксида или не более 0,5 мл 0,01 М раствора хлористоводородной кислоты.
Видео:Техника заполнения системы для внутривенного введения раствора натрия хлоридаСкачать

Щелочноземельные металлы и магний
Не более 0,01 % в пересчете на кальций. К 200 мл воды прибавляют 0,1 г гидроксиламина гидрохлорида, 10 мл буферного раствора аммония хлорида, рН 10,0, 1 мл 0,1 М раствора цинка сульфата и 150 мг индикаторной смеси эриохрома черного Т. Нагревают до температуры 40 °С. Титруют 0,01 М раствором натрия эдетата до перехода окраски из фиолетовой в синюю. К полученному раствору прибавляют 100 мл раствора, содержащего 10,0 г субстанции, и перемешивают. Если цвет раствора изменился на фиолетовый, то его титруют 0,01 М раствором натрия эдетата до появления синего окрашивания. На второе титрование должно пойти не более 2,5 мл 0,01 М раствора натрия эдетата.
Видео:Как в народе называют хлорид натрия? #shortsСкачать

Барий
К 5 мл раствора, приготовленного в испытании на «Прозрачность раствора», прибавляют 5 мл воды, 2 мл раствора серной кислоты разведенной 9,8 % и перемешивают. Через 2 ч мутность полученного раствора не должна превышать мутность эталонного раствора, содержащего 5 мл раствора, приготовленного в испытании «Прозрачность раствора», и 7 мл воды.
Видео:электролиз хлорида натрияСкачать
Железо
Не более 0,0002 %. Определение проводят в соответствии с требованиями ОФС «Железо», метод 2, с использованием эталонного раствора, содержащего 4 мл стандартного раствора железо(III)-иона (1 мкг/мл) и 6 мл воды. Для анализа используют раствор, приготовленный в испытании «Прозрачность раствора».
Видео:хлорид бария + сульфат натрияСкачать

Мышьяк
Не более 0,0001 % (ОФС «Мышьяк»). Определение проводят с использованием эталонного раствора, содержащего 1 мл стандартного раствора мышьяк-иона (1 мкг/мл). Для анализа отбирают 1,0 г субстанции.
Видео:Электролиз. 10 класс.Скачать

Сульфаты
Не более 0,02 % (ОФС «Сульфаты», метод 2). 7,5 мл раствора, приготовленного в испытании «Прозрачность раствора», разводят водой до 30 мл.
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Фосфаты
Не более 0,0025 % (ОФС «Фосфаты»). К 2 мл раствора, приготовленного для испытания «прозрачность раствора», прибавляют 98 мл воды и перемешивают.
Видео:МОЛЯРНАЯ МАССА ХИМИЯ // Урок Химии 8 класс: Относительная Молекулярная МассаСкачать

Ферроцианиды
К 2,0 г субстанции, растворенной в 6 мл воды, прибавляют 0,5 мл раствора, состоящего из 5 мл 1 % раствора железа(III) аммония сульфата в 2,5 % растворе серной кислоты, 95 мл 1 % раствора железа(II) сульфата, и перемешивают; в течение 10 мин не должно появляться синее окрашивание.
Видео:Гидролиз солей. 9 класс.Скачать

Нитриты
К 10 мл раствора, приготовленного в испытании «Прозрачность раствора», прибавляют 10 мл воды и перемешивают. Оптическая плотность полученного раствора, измеренная в кювете с толщиной слоя
10 мм при длине волны 354 нм относительно воды, должна быть не более 0,01.
Видео:Хлорид натрияСкачать

Бромиды
Испытуемый раствор. К 0,5 мл раствора, приготовленного в испытании «Прозрачность раствора», прибавляют 4 мл воды.
Эталонный раствор. 5 мл раствора калия бромида (3 мкг/мл).
К испытуемому и эталонному растворам прибавляют по 2,0 мл 1,65 % раствора фенолового красного, 1 мл 0,01 % раствора хлорамина Т и тотчас перемешивают. Точно через 2 мин прибавляют по 0,15 мл 0,1 М раствора натрия тиосульфата, перемешивают, доводят объемы растворов водой до 10 мл, перемешивают и измеряют оптическую плотность при 590 нм относительно воды.
Оптическая плотность испытуемого раствора не должна превышать оптическую плотность эталонного раствора.
Видео:Роль натрия в организме ► Что происходит с организмом при нехватке натрия?🤔Скачать

Йодиды
5 г субстанции увлажняют по каплям свежеприготовленной смесью, состоящей из 0,15 мл 10 % раствора натрия нитрита, 2 мл 0,5 М раствора серной кислоты, 25 мл 1 % раствора крахмала и 25 мл воды. Через
5 мин увлажненную субстанцию просматривают при дневном освещении – голубое окрашивание должно отсутствовать.
Видео:Введение в титрование (видео 1)| Титриметрический анализ | ХимияСкачать

*Алюминий
Не более 0,00002 % (ОФС «Алюминий», метод 1 или 2).
Испытуемый раствор. 20,0 г субстанции растворяют в
100 мл воды, прибавляют 10 мл ацетатного буферного раствора, рН 6,0 и перемешивают.
Эталонный раствор. К 2 мл стандартного раствора алюминий-иона
(2 мкг/мл) прибавляют 10 мл ацетатного буферного раствора, рН 6,0, 98 мл воды и перемешивают.
Контрольный раствор. К 10 мл ацетатного буферного раствора, рН 6,0 прибавляют 100 мл воды и перемешивают.
Метод 2. Определение проводят из навески субстанции 10,0 г.
Видео:ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать

*Калий
Не более 0,05 %. Испытание проводят одним из методов.
Стандартный раствор 20 мкг/мл калий-иона. 0,446 г калия сульфата, высушенного при температуре от 100 до 105 °С до постоянной массы, помещают в мерную колбу вместимостью 100 мл, доводят объем раствора водой до метки и перемешивают. 1 мл полученного раствора помещают в мерную колбу вместимостью 100 мл, доводят объем раствора водой до метки и перемешивают.
Испытуемый раствор. 0,2 г субстанции растворяют в 10 мл воды.
Эталонный раствор. К 5 мл стандартного раствора калий-иона
(20 мкг/мл) прибавляют 5 мл воды и перемешивают.
К испытуемому и эталонному растворам прибавляют по 2 мл 1 % раствора натрия тетрафенилбората и перемешивают. Через 5 мин опалесценция испытуемого раствора не должна превышать опалесценцию эталонного раствора.
Стандартный раствор калий-иона (600 мкг/мл). 1,14 г калия хлорида, высушенного до постоянной массы при температуре 100 – 105 о С, помещают в мерную колбу вместимостью 1000 мл, растворяют в воде, доводят объем раствора водой до метки и перемешивают.
Испытуемый раствор. 1,00 г субстанции помещают в мерную колбу вместимостью 100 мл, растворяют в воде, доводят объем раствора водой до метки и перемешивают.
Разбавление стандартного и испытуемого раствора производят в соответствии с инструкцией к прибору и проводят определение содержания ионов калия методом атомной эмиссии (метод прямой калибровки) или атомной абсорбции при длине волны 766,5 нм.
*Аммоний
Не более 0,004 % (ОФС «Аммоний»). Определение проводят с использованием раствора 0,5 г субстанции в 10 мл воды.
Тяжелые металлы
Не более 0,0005 % (ОФС «Тяжёлые металлы»). Для определения используют раствор, приготовленный в испытании «Прозрачность раствора».
Потеря в массе при высушивании
Не более 0,5 % (ОФС «Потеря в массе при высушивании», способ 1). Для определения используют около 1,0 г (точная навеска) субстанции.
Микробиологическая чистота
*Бактериальные эндотоксины
Количественное определение
Около 0,1 г (точная навеска) субстанции растворяют в 50 мл (при определении конечной точки титрования потенциометрически) или 20 мл воды (при определении конечной точки титрования с помощью индикатора) и титруют 0,1 M раствором серебра нитрата с потенциометрическим определением точки эквивалентности или до оранжево-желтого окрашивания (индикатор – 5 % раствор калия хромата).
Параллельно проводят контрольный опыт.
1 мл 0,1 М раствора серебра нитрата соответствует 5,844 мг натрия хлорида NaCl.
Хранение
В хорошо укупоренной упаковке.
* Контроль по показателям качества «Прозрачность раствора», «Цветность раствора», «Алюминий», «Калий», «Аммоний» и «Бактериальные эндотоксины» проводят для субстанции, предназначенной для приготовления лекарственных форм для парентерального применения.
Количественное определене
1. Аргентометрический метод. Основан на свойстве галогенид-ионов количественно осаждаться серебра нитратом с образованием галогенидов серебра.
1.1. Натрия хлорид, калия хлорид, натрия бромид, калия бромид.
Вариант Мора (прямое титрование); индикатор – калия хромат. Среда – нейтральная.
Осадок коричневато- красного цвета
Метод может быть использован для количественного определения хлоридов и бромидов в ЛП, содержащих ЛВ слабо-основного характера (например, натрия бензоат), создающих слабо-щелочную реакцию среды.
Натрия йодид и калия йодид не определяют, т.к. йодиды адсорбируются на осадке AgI, окраска появиться до точки эквивалентности (заниженные результаты).
1.2. Натрия йодид, калия йодид.
1.2.1. Вариант Фаянса (прямое титрование); индикатор – натрия эозинат (адсорбционный индикатор). Среда – уксуснокислая (разбавленная CH3cooh).
а) NaInd Ind + Na +
в) Ind — + AgI + AgNO3 [(AgI)Ag + ]Ind + NO
Изб. капля Розовый осадок
Вариант Фаянса может быть применен для определения хлоридов и бромидов натрия и калия. В качестве индикаторов используются бромфеноловый синий и флуоресцеин. Натрия эозинат не применяют, т.к. он адсорбируется на осадках AgCI и AgBr раньше точки эквивалентности.
1.2.2. Вариант Кольтгофа(прямое титрование). Используется для определения натрия и калия йодидов (селективный метод) в многокомпонентных ЛП, содержащих другие галогениды (например, NaСI, KСI, CaCl2, NaBr, KBr). Титрант: раствор серебра нитрата.
Индикатор: йодкрахмальный – 1 капля раствора калия йодата
(0,1 моль/л) УЧ (1/6 KIO3), раствор крахмала (2 мл) и по каплям разведенной кислоты серной до появления синего окрашивания.
I2 + КI + крахмал синее окрашивание индикации
По мере титрования из раствора осаждаются йодиды, связываясь с серебра нитратом:
В точке эквивалентности происходит обесцвечивание раствора, т. к. йодиды полностью исчезнут из раствора.
Хлориды и бромиды не мешают определению, т.к. могут осаждаться только после йодид-ионов (ПР AgI = 1,5 10 16 ; ПР AgBr = 4,4 10 13 ; ПР AgCI = 1,8 10 10 ).
1.3. Для количественного определения натрия и калия хлоридов, бромидов и йодидов в ЛП используются также варианты:
1.3.1. Фольгарда (обратное титрование).
1.3.2. Фольгарда в модификации Кольтгофа (косвенный или видоизмененный вариант Фольгарда).
(См. МУ «Фармацевтический анализ по функциональным группам и общие титриметрические методы анализа, Пермь, 2008 – с. 85-87).
Аргентометрический метод дает точные результаты, быстр в выполнении. Недостаток: титрант серебра нитрат – дорогостоящий реактив, поэтому метод не экономичен.
2. Меркуриметрический метод. Основан на свойстве галогенид-ионов количественно взаимодействовать с солями ртути (II) с образованием труднодиссоциируемых (малоионизированных) галогенидов ртути (II).
Применяют для всех галогенидов натрия и калия.
Титранты– легко ионизированные соли ртути (II): ртути (II) нитрат – Hg(NO3)2, ртути (II) перхлорат – Hg(CIO4)2.
Йодиды натрия и калия титруют в присутствии этанола, концентрация которого в конце титрования должна быть не менее 55%, т.к. ртути йодид мало растворим в воде и имеет ярко-красную окраску осадка, что затрудняет фиксирование точки эквивалентности. Используется свойство ртути (II) йодида растворяться в спирте с образованием бесцветных растворов.
Титрант: ртути (II) перхлорат (0,01 моль/л) УЧ [1/2 Hg(ClO4)2]
3. Броматометрический метод. Используется в анализе йодидов калия и натрия.
Метод основан на восстановительных свойствах йодидов. Йодид-ионы окисляются калия броматом в среде кислоты хлороводородной до йодмонохлорида:
6KI + KBrO3 + 6HCI → 3I2 + 6KCI + KBr + 3H2O
6KI + 2KBrO3 + 12HCI → 6ICI + 2KBr + 6KCI + 6H2O
Уравнение после сокращения коэффициентов:
3KI + KBrO3 + 6HCI → 3ICI + KBr + 3KCI + 3H2O
Хранение
В хорошо укупоренной таре, в сухом месте (натрия бромид и йодид, калия йодид – гигроскопичны). Бромиды и йодиды легко окисляются до свободного галогена, поэтому их необходимо предохранять от действия света (хранят в склянках темного стекла).
Применение
Натрия хлорид. Плазмозамещающее, дезинтоксикационное, гидратирующее, нормализующее кислотно-щелочное состояние (КЩС) средство.
Калия хлорид. Нормализует КЩС, восполняет дефицит калия.
Натрия бромид и калия бромид. Седативные средства.
Натрия йодид и калия йодид. Восполняют дефицит йода. Проявляют противомикробное, протеолитическое, муколитическое действие.
Натрия фторид Sodium fluoride (МНН)
NaF Natrii phthoridum(ЛН)
Получение
Из минерала флюорита (CaF2,), который сплавляют с натрия карбонатом и кремния (IV) оксидом:
Натрия фторид вымывают из плава водой и раствор упаривают до кристаллизации.