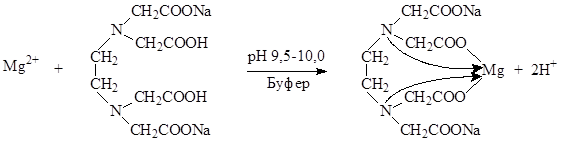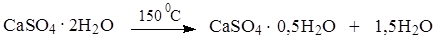1. Комплексонометрический метод. Вариант прямого титрования. Метод основан на свойстве ионов магния количественно вступать в реакцию с комплексоном (трилоном Б) с образованием прочных, растворимых в воде, бесцветных внутрикомплексных соединений.
Титрант: раствор трилона Б – динатриевая соль этилендиаминотетрауксусной кислоты (сокращенно – Na2H2ТrБ).
Индикаторы: металлоиндикаторы – органические красители, имеющие различную окраску в свободном виде и виде комплекса с металлом, который менее прочный, чем комплекс трилона Б с металлом. Изменение окраски металлоиндикаторов зависит от pH среды.
Определение солей магния проводят в среде аммиачного буфера при рН 9,5-10,0. Индикатор – кислотный хром черный специальный (эриохром черный Т). Переход окраски от красно-фиолетовой к синей.
Магния оксид предварительно растворяют в кислоте хлороводородной разведенной.
Mg 2+ + H2Ind MgInd + 2H +
Окраска раствора за счет
комплекса металла с индикатором
В точке эквивалентности:
Окраска раствора за счет
2. Ацидиметрический метод нейтрализации (вариант обратного титрования). Используется для количественного определения магния оксида. Метод основан на свойстве магния оксида количественно взаимодействовать с кислотой хлороводородной с образованием соли:
HCI + NaOH → NaCI + H2O
fэкв (магния оксида) = Ѕ
Хранение
По общему списку, в хорошо укупоренной таре. Магния сульфат при нарушении условий хранения постепенно теряет кристаллизационную воду (выветривается); магния оксид взаимодействует с углекислым газом и влагой, содержащимися в воздухе, образуя примесь карбоната и магния гидроксида:
Применение
Магния оксид – антацидное средство с легким послабляющим эффектом.
Магния сульфат – спазмолитическое, противосудорожное, успокаивающее, желчегонное и слабительное средство.
СОЕДИНЕНИЯ КАЛЬЦИЯ
| Лекарственное вещество. Химическая формула | МНН и латинское название | Формы выпуска |
| Кальция хлорид CаCI2 6H2O | Calcium chloride * Calcii chloridum | Субстанция; раствор для инъекций 10% |
| Кальция сульфат жженый (гипс медицинский) CaSO4 0,5H2O | Calcium sulfate * Calcii sulfas ustus | Субстанция |
Получение
Кальция хлорид получают из природного минерала – кальцита:
Сопутствующие примеси (соли железа и магния) осаждают раствором кальция гидроксида:
Осадки железа и магния гидроксидов отфильтровывают.
Избыток кальция гидроксида нейтрализуют кислотой хлороводородной разведенной:
Кальция сульфат жженый получают из природного минерала – гипса дигидрата (CaSO4 2H2O). При нагревании до 150 0 С гипс природный теряет часть кристаллизационной воды и превращается в гипс медицинский:
Дата добавления: 2016-03-20 ; просмотров: 10871 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
- ФС.2.2.0010.15 Магния сульфат
- ФС.2.2.0010.15 Магния сульфат
- Описание
- Растворимость
- Подлинность
- *Прозрачность раствора
- *Цветность раствора
- Кислотность или щелочность
- Хлориды
- Тяжелые металлы
- Железо
- Марганец
- Мышьяк
- Потеря в массе при прокаливании
- *Бактериальные эндотоксины
- Микробиологическая чистота
- Количественное определение
- Хранение
- Магния сульфат (ФС.2.2.0010.15). Magnesii sulfas
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

ФС.2.2.0010.15 Магния сульфат
Содержимое (Table of Contents)
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

ФС.2.2.0010.15 Магния сульфат
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
ФАРМАКОПЕЙНАЯ СТАТЬЯ
Магния сульфат ФС.2.2.0010.15
Магния сульфат Взамен ГФ Х, ст. 383;
Magnesii sulfas взамен ГФ XII, ч.1, ФС 42-0253-07
Сульфат магния, гептагидрат
Cодержит не менее 99,0 % и не более 101,0 % магния сульфата MgSO4 . 7H2O.
Видео:ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать

Описание
Белый или почти белый кристаллический порошок или бесцветные призматические кристаллы.
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Растворимость
Очень легко растворим в кипящей воде, легко растворим в воде, практически нерастворим в спирте 96 %.
Видео:МОЛЯРНАЯ МАССА ХИМИЯ // Урок Химии 8 класс: Относительная Молекулярная МассаСкачать

Подлинность
Препарат дает характерные реакции на магний и сульфаты (ОФС «Общие реакции на подлинность»).
Видео:Как за 4 МИНУТЫ выучить Химию? Химическое Количество, Моль и Закон АвогадроСкачать

*Прозрачность раствора
2 г субстанции растворяют в воде и разбавляют водой до 20 мл; полученный раствор должен быть прозрачным (ОФС «Прозрачность и степень мутности жидкостей»).
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

*Цветность раствора
Раствор, полученный в испытании на «Прозрачность раствора», должен быть бесцветным (ОФС «Степень окраски жидкостей»).
Видео:Количество вещества. Моль. Число Авогадро. 8 класс.Скачать

Кислотность или щелочность
К 5 мл раствора, полученного в испытании на «Прозрачность раствора», прибавляют 5 мл воды и 0,05 мл 1 % раствора фенолфталеина; раствор должен быть бесцветным. Розовое окрашивание должно появляться от прибавления не более 0,1 мл 0,01 М раствора натрия гидроксида.
Видео:Первый день голодания, прием сульфата магния, обязательные процедуры.Скачать

Хлориды
Не более 0,004 % (ОФС «Хлориды»). К 5 мл раствора, полученного в испытании «Прозрачность раствора», прибавляют 5 мл воды.
Видео:ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Тяжелые металлы
Не более 0,0005 % (ОФС «Тяжёлые металлы»). Для определения используют 10 мл раствора, полученного в испытании «Прозрачность раствора».
Видео:АПТЕЧКА | Магния сульфатСкачать

Железо
Не более 0,002 % (ОФС «Железо»). 1,5 г субстанции растворяют в воде и доводят водой до 10 мл.
Видео:Молярная масса. 8 класс.Скачать

Марганец
1,25 г субстанции растворяют в 5 мл воды, прибавляют
0,5 мл серной кислоты концентрированной, 0,2 мл 0,1 М раствора серебра нитрата и нагревают до кипения. Прибавляют 2 мл 20 % раствора аммония персульфата и снова нагревают до кипения.
Проводят контрольный опыт с 5 мл воды и теми же реактивами.
Оба раствора охлаждают и переносят в одинаковые пробирки. В пробирку с контрольным опытом прибавляют из микробюретки 0,01 М раствор калия перманганата до тех пор, пока окраска не сравняется с окраской испытуемого раствора. Сравнение окрасок проводят на белом фоне по оси пробирок.
1 мл 0,01 М раствора калия перманганата соответствует 0,11 мг марганца, которого в субстанции должно быть не более 0,004 %.
Если субстанция предназначена для производства лекарственных препаратов для парентерального применения, используют раствор сравнения без добавления 0,01 М раствора калия перманганата; в такой субстанции марганца не должно быть.
Видео:🔴 МАГНЕЗИЯ. Магния сульфат 25 (по назначению врача) 🔴 РЕЦЕПТЫ ЗДОРОВЬЯ. ВРАЧ ОНЛАЙН.Скачать

Мышьяк
Не более 0,0002 % (ОФС «Мышьяк»). Для определения используют 0,25 г субстанции.
Видео:ХИМИЯ С НУЛЯ — Как решать задачи по Химии на Массовую ДолюСкачать

Потеря в массе при прокаливании
От 48,0 до 52,0 %. Около 1,0 г (точная навеска) субстанции сушат в течение 2,5 ч при температуре от 100 до 105 ºС, а затем прокаливают при температуре красного каления до постоянной массы.
Видео:Сернокислый магний. Сульфат магния.Скачать

*Бактериальные эндотоксины
Не более 0,07 ЕЭ на 1 мг магния сульфата (ОФС «Бактериальные эндотоксины»).
Для проведения испытания готовят исходный раствор субстанции (концентрация 250 мг/мл), затем разводят его не менее чем в 100 раз.
Видео:ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Микробиологическая чистота
Видео:Магния сульфат порошок инструкция по применению препарата: Показания, как применять, обзор препаратаСкачать

Количественное определение
Около 0,15 г субстанции (точная навеска) растворяют в 50 мл воды, прибавляют 5 мл аммиачного буферного раствора и титруют при энергичном перемешивании 0,05 М раствором натрия эдетата до появления синего окрашивания (индикатор – кислотный хром черный специальный).
Параллельно проводят контрольный опыт.
1 мл 0,05 М раствора натрия эдетата соответствует 12,32 мг магния сульфата MgSO4 . 7H2O.
Видео:Как ЛЕГКО понять Химию с нуля — Массовая доля вещества // ХимияСкачать

Хранение
В хорошо укупоренной упаковке.
*Контроль по показателям качества «Прозрачность раствора», «Цветность раствора», «Бактериальные эндотоксины» проводят в субстанциях, предназначенных для производства лекарственных препаратов для парентерального применения.
Видео:8 класс. Массовая доля растворенного вещества. Решение задач.Скачать

Магния сульфат (ФС.2.2.0010.15). Magnesii sulfas
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
Магния сульфат (ФС.2.2.0010.15)
ФАРМАКОПЕЙНАЯ СТАТЬЯ
ФС.2.2.0010.15 Магния сульфат – Magnesii sulfas
Взамен ГФ Х, ст. 383; взамен ГФ XII, ч.1, ФС 42-0253-07
Сульфат магния, гептагидрат
Cодержит не менее 99,0 % и не более 101,0 % магния сульфата MgSO4 . 7H2O.
Описание. Белый или почти белый кристаллический порошок или бесцветные призматические кристаллы.
Растворимость. Очень легко растворим в кипящей воде, легко растворим в воде, практически нерастворим в спирте 96 %.
Подлинность. Препарат дает характерные реакции на магний и сульфаты (ОФС «Общие реакции на подлинность»).
*Прозрачность раствора. 2 г субстанции растворяют в воде и разбавляют водой до 20 мл; полученный раствор должен быть прозрачным (ОФС «Прозрачность и степень мутности жидкостей»).
*Цветность раствора. Раствор, полученный в испытании на «Прозрачность раствора», должен быть бесцветным (ОФС «Степень окраски жидкостей»).
Кислотность или щелочность. К 5 мл раствора, полученного в испытании на «Прозрачность раствора», прибавляют 5 мл воды и 0,05 мл 1 % раствора фенолфталеина; раствор должен быть бесцветным. Розовое окрашивание должно появляться от прибавления не более 0,1 мл 0,01 М раствора натрия гидроксида.
Хлориды. Не более 0,004 % (ОФС «Хлориды»). К 5 мл раствора, полученного в испытании «Прозрачность раствора», прибавляют 5 мл воды.
Тяжелые металлы. Не более 0,0005 % (ОФС «Тяжёлые металлы»). Для определения используют 10 мл раствора, полученного в испытании «Прозрачность раствора».
Железо. Не более 0,002 % (ОФС «Железо»). 1,5 г субстанции растворяют в воде и доводят водой до 10 мл.
Марганец. 1,25 г субстанции растворяют в 5 мл воды, прибавляют
0,5 мл серной кислоты концентрированной, 0,2 мл 0,1 М раствора серебра нитрата и нагревают до кипения. Прибавляют 2 мл 20 % раствора аммония персульфата и снова нагревают до кипения.
Проводят контрольный опыт с 5 мл воды и теми же реактивами.
Оба раствора охлаждают и переносят в одинаковые пробирки. В пробирку с контрольным опытом прибавляют из микробюретки 0,01 М раствор калия перманганата до тех пор, пока окраска не сравняется с окраской испытуемого раствора. Сравнение окрасок проводят на белом фоне по оси пробирок.
1 мл 0,01 М раствора калия перманганата соответствует 0,11 мг марганца, которого в субстанции должно быть не более 0,004 %.
Если субстанция предназначена для производства лекарственных препаратов для парентерального применения, используют раствор сравнения без добавления 0,01 М раствора калия перманганата; в такой субстанции марганца не должно быть.
Мышьяк. Не более 0,0002 % (ОФС «Мышьяк»). Для определения используют 0,25 г субстанции.
Потеря в массе при прокаливании. От 48,0 до 52,0 %. Около 1,0 г (точная навеска) субстанции сушат в течение 2,5 ч при температуре от 100 до 105 ºС, а затем прокаливают при температуре красного каления до постоянной массы.
*Бактериальные эндотоксины. Не более 0,07 ЕЭ на 1 мг магния сульфата (ОФС «Бактериальные эндотоксины»).
Для проведения испытания готовят исходный раствор субстанции (концентрация 250 мг/мл), затем разводят его не менее чем в 100 раз.
Микробиологическая чистота. В соответствии с требованиями ОФС «Микробиологическая чистота».
Количественное определение. Около 0,15 г субстанции (точная навеска) растворяют в 50 мл воды, прибавляют 5 мл аммиачного буферного раствора и титруют при энергичном перемешивании 0,05 М раствором натрия эдетата до появления синего окрашивания (индикатор – кислотный хром черный специальный).
Параллельно проводят контрольный опыт.
1 мл 0,05 М раствора натрия эдетата соответствует 12,32 мг магния сульфата MgSO4 . 7H2O.
Хранение. В хорошо укупоренной упаковке.
*Контроль по показателям качества «Прозрачность раствора», «Цветность раствора», «Бактериальные эндотоксины» проводят в субстанциях, предназначенных для производства лекарственных препаратов для парентерального применения.