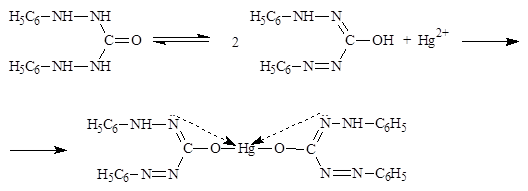| Название | Кафедра фармацевтической химии фдпо и фзо |
| Анкор | Калий хлорид |
| Дата | 17.10.2019 |
| Размер | 32.77 Kb. |
| Формат файла |  |
| Имя файла | КАЛИЯ ХЛОРИД.docx |
| Тип | Реферат #90640 |
| Подборка по базе: Фармацевтической химии.doc, 2021-2022 Кафедра хаттамалары.doc, Семинар 21.Барчук ФДПО.docx, реферат по химии.docx, Зачет по химии ШПОРА.docx, График консультаций по химии и биологии.docx, Реферат по химии.docx, Питомник КАФЕДРА ЛАНДШАФТНОГО СТРОИТЕЛЬСТВА.docx, Реферат по химии.docx, реферат по химии.docx ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ «ПЕРМСКАЯ ГОСУДАРСТВЕННАЯ ФАРМАЦЕВТИЧЕСКАЯ АКАДЕМИЯ» МИНЗДРАВА РОССИИ по фармацевтической химии «КОНТРОЛЬ КАЧЕСТВА ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ ЗАВОДСКОГО ПРОИЗВОДСТВА» ФС.3.2.0006.18. Калия хлорид, раствор для инъекций (подлинность, прозрачность, цветность, рН, количественное определение). Студента (ки) VI курса ____ группы факультета заочного обучения Ф.И.О. (полностью) ________________ Домашний адрес: почтовый индекс, обл. (край, республика, город, село) улица, дом, квартира. Глава I. Испытания на подлинность ………………………………………….4 Глава III. Количественное определение ……………………………………. 9 Для фармакопейного анализа предоставлена готовая лекарственная форма заводского изготовления – раствор для инъекций калия хлорид. Раствор для инъекций – стерильный водный или неводный раствор действующего вещества/веществ в соответствующем растворителе, предназначенный для инъекционного введения в ткани или органы, или в сосудистое русло. Цель моей реферативной работы заключается:
На основании результатов, полученных при выполнении фармакопейного анализа, делается заключение о соответствии лекарственного препарата требованиям ФС.3.2.0006.18. Глава I. Испытания на подлинность. Согласно требованиям ФС.3.2.0006.18 подлинность калия хлорида раствора для инъекций устанавливается с помощью специфических реакций идентификации на катион калия и хлорид-ион.
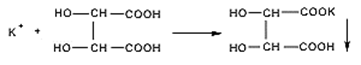
А) Реакция осаждения винной кислотой в присутствии натрия ацетата и спирта; постепенно образуется белый кристаллический осадок калия гидротартрата, растворимый в разведенных минеральных кислотах и растворах щелочей. Реакцию проводят в присутствии натрия ацетата (для связывания выделившейся кислоты), на холоду, слабокислая или нейтральная реакция раствора. HCl + CH3COONa NaCl + CH3COOH Б) Реакция осаждения 10 % раствором натрия кобальтинитрита в уксуснокислой среде; образуется желтый кристаллический осадок гексанитро(III) кобальтата калия и натрия. Реакцию нужно вести в слабокислой (уксусной) или нейтральной среде. Сильные кислоты разрушают реактив с выделением азотистой кислоты. Щелочная среда также недопустима, так как при действии щелочей реактив разрушается с образованием бурого осадка кобальта (III) гидроксида. В) Соль калия, внесенная в бесцветное пламя, окрашивает его в фиолетовый цвет или при рассматривании через синее стекло – в пурпурно-красный. Перед проведением данной реакции раствор калия хлорида для инъекций предварительно упаривают досуха. Далее на кончике графитового стержня или нихромовой проволоки вносят в пламя горелки несколько кристаллов калия хлорида.
Реакция осаждения серебра нитратом в азотнокислой среде; образуется белый творожистый осадок серебра хлорида. Осадок нерастворим в разведенной азотной кислоте и растворим в растворе аммиака. На основании хорошо заметных невооруженным глазом внешних эффектов реакций подлинности делаем заключение о соответствии раствора калия хлорида для инъекций требованиям ФС.3.2.0006.18. Глава II. Определение прозрачности, цветности и рН Ко всем инъекционным лекарственным средствам предъявляется высокая чистота. Для инъекционных растворов (истинных) обязательно отсутствие каких-либо взвешенных частиц. С этой целью инъекционные растворы контролируют по показателям «Прозрачность» и «Цветность». Согласно ФС.3.2.0006.18 раствор должен быть прозрачным. В соответствии с требованиями ОФС.1.2.1.0007.15 «Прозрачность и степень мутности жидкостей» визуальное испытание проводят в трех одинаковых пробирках с притертой пробкой из прозрачного бесцветного и нейтрального стекла с внутренним диаметром около 15 мм. Для сравнения берут равные объемы (по 5 мл) воды для инъекций, раствора калия хлорида и эталона I. Испытание проводят при освещении электрической лампой матового стекла мощностью 40 Вт, расположенной над образцом, просматривая растворы перпендикулярно вертикальной оси пробирок на черном фоне через 5 мин после приготовления эталона. Испытуемую жидкость считают прозрачной, если она по прозрачности не отличается от воды для инъекций, используемой при приготовлении испытуемого раствора, или ее опалесценция (мутность) не превышает опалесценцию (мутность) эталона I. Согласно ФС.3.2.0006.18 раствор должен быть бесцветным. Согласно ОФС.1.2.1.0006.15 испытания по показателю «Цветность» проводят в двух одинаковых пробирках из бесцветного, прозрачного, нейтрального стекла с внутренним диаметром от 15 до 25 мм, используя равные слои высотой 40 мм испытуемого раствора калия хлорида для инъекций, воды для инъекций. Сравнивают окраску при рассеянном дневном свете сверху вдоль вертикальной оси пробирок на матово-белом фоне. Бесцветной считается жидкость, если ее окраска не отличается от растворителя (воды для инъекций). Согласно ФС.3.2.0006.18 значение рН должно колебаться в пределах от 3,0 до 8,0. То есть это оптимальное значение рН, при котором гарантирована устойчивость раствора калия хлорида для инъекций. Потенциометрическое определение рН заключается в измерении ЭДС элемента, состоящего из двух электродов: индикаторного, потенциал которого зависит от активности ионов водорода, и электрода сравнения — стандартного электрода с известной величиной потенциала (насыщенный каломельный или хлорсеребряный электроды). В качестве индикаторных электродов для измерения рН на практике применяют стеклянный и хингидронный электроды. Для измерения рН применяют высокоомные потенциометры различных систем или рН-метры, шкала которых градуирована в милливольтах или непосредственно в единицах рН. Определение рН проводят при 25 +/-2 0 С, в противном случае необходимо сделать соответствующие поправки. На практике для измерения рН применяют метод градуировочного графика. рН испытуемого раствора связан с рН стандартного раствора следующим уравнением: Е – потенциал электрода в испытуемом растворе, мВ; ЕS – потенциал того же электрода в растворе с известным значением рН (стандартном растворе), мВ; k — коэффициент, который означает изменение электродвижущей силы на единицу изменения рН, мВ; pHs – pH стандартного раствора. Раствор калия хлорида имея нейтральную реакцию (рН=7), близок к значениям рН крови (норма рН для венозной крови 7,30-7,43, норма рН артериальной крови 7,36-7,45). Что позволит избежать раздражающего и аллергизирующего действия на организм. По проведенным испытаниям даем заключение о соответствии или несоответствии раствора Калия хлорида для инъекций требованиям ФС.3.2.0006.18 . Глава III. Количественное определение. Калия хлорид определяют согласно ФС.3.2.0006.18 методом аргентометрии (вариант Мора). Метод основан на осаждении хлорид-ионов серебра нитратом в виде труднорастворимого осадка серебра хлорида. Титрование прямое. Титрантом метода является раствор 0,1 М раствор серебра нитрата. В качестве индикатора используют раствор калия хромата. Суть метода заключается в том, что при титровании галогенид-ионов в присутствии хромат-ионов в первую очередь осаждаются хлорид-ионы: Когда хлорид-ионы практически полностью осаждаются в виде серебра хлорида AgCl, только тогда начинает выпадать кирпично-красный осадок серебра хромата Ag2СrО4: Титрование заканчивают, когда взмученный в жидкости осадок от одной капли титранта (раствора серебра нитрата) приобретает оранжево-желтую окраску (начало выпадения осадка серебра хромата). В соответствии с требованиями ФС.3.2.0006.18 процентное содержание калия хлорида в растворе для инъекций должно составлять не менее 90% и не более 110%. По полученным результатам делают заключение о соответствии раствора калия хлорида для инъекций требованиям ФС.3.2.0006.18. Таким образом, в ходе изучения фармакопейной статьи на Калия хлорид раствор для инъекций мною были приведены реакции подлинности и методики количественного определения калия хлорида. В ходе написания реферата приведено обоснование реакций подлинности, которые сопровождаются внешним эффектом, например, выпадением или растворением осадков, окрашиванием пламени горелки. Также приведено расширенное обоснование методик определения прозрачности, цветности и рН раствора калия хлорида для инъекций согласно соответствующим ФС. Количественное определение является заключительным этапом фармакопейного анализа, поэтому он должен отличаться избирательностью и высокой точностью. В нашем случае таким является специфический метод для калия хлорида – аргентометрия. В работе приведено обоснование аргентометрического метода количественного определения калия хлорида, выведен титр и формула расчета процентного содержания калия хлорида в растворе. Список литературы
Дайте заключение о качестве калия хлорида 4% раствора для инъекций по количественному содержанию по методике ФС, если на титрование 5,0 мл препарата израсходовалось 6,80 мл 00,1М раствора серебра нитрата (К=1,0014). На контрольный опыт израсходовалось 0,05 мл титранта. Количественно определяют аргентометрическим методом, вариант Мора. Метод основан на осаждении хлорид-ионов в виде труднорастворимых осадков серебра хлорида. Титрование прямое. Титрантом метода является раствор 0,1 М серебра нитрата. В основе метода лежит образование осадков серебра хлорида. В качестве индикатора используют 5% раствор калия хромата. Применяемый в методе осаждения индикатор не должен изменять цвет до тех пор, пока определяемые ионы полностью не перейдут в осадок: В точке эквивалентности индикатор Ag2СrО4 вступает в реакцию с титрантом и наблюдается изменение окраски (желто-оранжевой), что свидетельствует о конце титрования: С%=Т*(VAgNO3 – Vко)*Кп*100*Vмк/а*1000*Vпип = 7,455*1,0014*(6,80 – 0,05)*100*200/(0,2*1000*50) = 100,8 % Заключение: раствор калия хлорида для инъекций по количественному содержанию удовлетворяет требованиям ФС.3.2.0006.18 (содержится не менее 90 % и не более 110,0 % KCl) Видео:ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать  Количественное определение.Тема. «Контроль качества неорганических лекарственных средств элементов VII группы периодической системы Кислота хлороводородная Acidum hydrochloricum HCl Лекарственными средствами являются растворы хлороводорода: кислота хлороводородная (содержание хлороводорода 24,8 – 25,2%) и кислота хлороводородная разведенная (8,2 – 8,4%). Оба препарата – бесцветные прозрачные жидкости с кислой реакцией среды. Кислота хлороводородная – летучая жидкость, поэтому ее хранят в склянках с притертыми пробками. Подлинность. Хлорид-ион в препарате определяют качественной реакцией на гало- гениды с серебра нитратом или по взаимодействию с окислителями. Хло- рид-ион проявляет слабые восстановительные свойства и окисляется до молекулярного хлора при действии сильных окислителей, таких как калия перманганат, марганца оксид (IV), калия дихромат: Количественное определение. Фармакопейной методикой количественного определения кислоты хлороводородной является алкалиметрия. Титрант – 0,1 моль/л р-р NaOH HCl + NaOH → NaCl + H2O Титруют до желтого окрашивания в точке эквивалентности. Натрия и калия хлориды Natrii chloridum NaCl Kalii chloridum KCl Оба препарата – белые кристаллические порошки без запаха, соленого вкуса, легко растворимы в воде. Подлинность. 1. Катионы натрия и калия окрашивают пламя соответственно в желтый и фиолетовый цвета. 2. Соли натрия образуют желтый кристаллический осадок (нераствори- мый в кислоте уксусной) с цинка уранилацетатом: 3. Соли калия с раствором гексанитрокобальтата (III) натрия образуют желтый кристаллический осадок гексанитрокобальтата (III) натрия и калия: 4. С раствором кислоты винно-каменной соли калия образуют осадок калия гидротартрата, который не растворяется в кислоте уксусной, но растворяется в минеральных кислотах и щелочах: 5. Хлорид-ион в данных лекарственных веществах определяют по взаимодействию с раствором серебра нитрата; образуется белый творожистый осадок: Особенность серебра хлорида, в отличие от бромида и йодида, заключается в способности легко растворяться в растворах аммиака: По фармакопее проводят методом прямой аргентометрии по Мору. Титрование ведут в нейтральной среде стандартным раствором серебра нитрата в присутствии калия хромата в качестве индикатора. Далее, после полного осаждения хлорид-ионов, выпадает красно-оранжевый осадок серебра хромата: Натрия и калия бромиды Natrii bromidum NaBr Kalii bromidum KBr Бромиды натрия и калия – белые кристаллические порошки хорошо растворимые в воде; реакция среды водных растворов нейтральна. Натрия бромид гигроскопичен. Подлинность. 1. Бромиды с раствором серебра нитрата образуют желтоватый творожистый осадок: 2. Бромиды окисляются до свободного галогена легче хлоридов, поэтому их идентифицируют также по реакции выделения брома в результате окислительно-восстановительной реакции с хлорамином в кислой среде. Выделяющийся в результате реакции бром извлекают хлороформом, в котором он растворяется лучше, чем в воде, окрашивая его в желто-бурый цвет: Количественное опредение. Количественное определение калия и натрия бромидов (как и калия и натрия хлоридов) по ГФ проводят методом прямого аргентометрического титрования по Мору. Натрия и калия йодиды Natrii iodidum NaI Kalii iodidum KI Калия и натрия йодиды – бесцветные или белые кристаллические порошки; гигроскопичны, отсыревают на влажном воздухе. Являясь энергичными восстановителями, вступают в реакцию с кислородом воздуха, выделяя при этом йод, вследствие чего порошки и растворы данных лекарственных веществ желтеют при неправильном хранении. Свет, примеси тяжелых металлов, кислород воздуха инициируют процессы окисления йодидов. Подлинность. 1. Йодиды с нитритом натрия в кислой среде окисляются до свободного йода, который окрашивает хлороформный слой в фиолетовый цвет. 2NaNO22 + 2KI + 4HCl ⇒ 2NaCl + 2KCl + I2 + NO + H2O 2. Йодиды с раствором серебра нитрата образуют желтый осадок: Количественное определение. Общий способ количественного определения йодидов по ГФ – прямая аргентометрия с применением адсорбционного индикатора (метод Фаянса). Сущность метода заключается в том, что адсорбционный индикатор (по ГФ – натрия эозинат) не меняет своего окрашивания (желтовато- красного) до наступления точки эквивалентности. Затем, в точке эквивалентности, индикатор адсорбируется на осадке серебра йодида и цвет осадка становится красно-фиолетовым. Это объясняется тем, что до точки эквивалентности на осадке серебра йодида адсорбируется неоттитрованный йодид-ион (как ион, входящий в состав осадка). Возникающий на поверхности осадка отрицательный заряд препятствует адсорбции на нем индикатора в виде аниона. После того как йодид будет оттитрован полностью – на поверхности осадка будут адсорбироваться ионы серебра (также входящие в состав осадка). При этом на поверхности осадка возникает вызванный ионами серебра положительный заряд и тогда происходит адсорбция анионов индикатора, вызывающая переход окрашивания осадка. [AgI ∙ I — ]→[AgI ∙ Ag + ] В итоге соединение, находящееся в осадке, примет следующий вид: Серовато-черные с металлическим блеском пластинки или сростки кристаллов характерного запаха. Летуч при комнатной температуре, при нагревании возгоняется, образуя фиолетовые пары. Очень мало растворим в воде, легко растворим в водном растворе йодидов, растворим в 10 ч. 95% спирта, эфире и хлороформе. Solutio Iodi spirituosa 1%, 2%, 3% aut 5%. Раствор йода спиртовой 1%, 2%, 3% или 5% Прозрачная жидкость красно-бурого цвета с характерным запахом. Подлинностьйода подтверждают реакцией водных растворов лекарственного вещества с крахмалом, в результате которой образуется синее окрашивание. Количественно йод определяют титрованием раствора лекарственного вещества (в присутствии калия йодида для лучшего растворения йода) стандартным раствором натрия тиосульфата: В качестве индикатора используют крахмал, поэтому титрование ве- Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать  Количественное определене1. Аргентометрический метод. Основан на свойстве галогенид-ионов количественно осаждаться серебра нитратом с образованием галогенидов серебра. 1.1. Натрия хлорид, калия хлорид, натрия бромид, калия бромид. Вариант Мора (прямое титрование); индикатор – калия хромат. Среда – нейтральная. Осадок коричневато- красного цвета Метод может быть использован для количественного определения хлоридов и бромидов в ЛП, содержащих ЛВ слабо-основного характера (например, натрия бензоат), создающих слабо-щелочную реакцию среды. Натрия йодид и калия йодид не определяют, т.к. йодиды адсорбируются на осадке AgI, окраска появиться до точки эквивалентности (заниженные результаты). 1.2. Натрия йодид, калия йодид. 1.2.1. Вариант Фаянса (прямое титрование); индикатор – натрия эозинат (адсорбционный индикатор). Среда – уксуснокислая (разбавленная CH3cooh). а) NaInd Ind + Na + в) Ind — + AgI + AgNO3 [(AgI)Ag + ]Ind + NO Изб. капля Розовый осадок Вариант Фаянса может быть применен для определения хлоридов и бромидов натрия и калия. В качестве индикаторов используются бромфеноловый синий и флуоресцеин. Натрия эозинат не применяют, т.к. он адсорбируется на осадках AgCI и AgBr раньше точки эквивалентности. 1.2.2. Вариант Кольтгофа(прямое титрование). Используется для определения натрия и калия йодидов (селективный метод) в многокомпонентных ЛП, содержащих другие галогениды (например, NaСI, KСI, CaCl2, NaBr, KBr). Титрант: раствор серебра нитрата. Индикатор: йодкрахмальный – 1 капля раствора калия йодата I2 + КI + крахмал синее окрашивание индикации По мере титрования из раствора осаждаются йодиды, связываясь с серебра нитратом: В точке эквивалентности происходит обесцвечивание раствора, т. к. йодиды полностью исчезнут из раствора. Хлориды и бромиды не мешают определению, т.к. могут осаждаться только после йодид-ионов (ПР AgI = 1,5 10 16 ; ПР AgBr = 4,4 10 13 ; ПР AgCI = 1,8 10 10 ). 1.3. Для количественного определения натрия и калия хлоридов, бромидов и йодидов в ЛП используются также варианты: 1.3.1. Фольгарда (обратное титрование). 1.3.2. Фольгарда в модификации Кольтгофа (косвенный или видоизмененный вариант Фольгарда). (См. МУ «Фармацевтический анализ по функциональным группам и общие титриметрические методы анализа, Пермь, 2008 – с. 85-87). Аргентометрический метод дает точные результаты, быстр в выполнении. Недостаток: титрант серебра нитрат – дорогостоящий реактив, поэтому метод не экономичен. 2. Меркуриметрический метод. Основан на свойстве галогенид-ионов количественно взаимодействовать с солями ртути (II) с образованием труднодиссоциируемых (малоионизированных) галогенидов ртути (II). Применяют для всех галогенидов натрия и калия. Титранты– легко ионизированные соли ртути (II): ртути (II) нитрат – Hg(NO3)2, ртути (II) перхлорат – Hg(CIO4)2. Йодиды натрия и калия титруют в присутствии этанола, концентрация которого в конце титрования должна быть не менее 55%, т.к. ртути йодид мало растворим в воде и имеет ярко-красную окраску осадка, что затрудняет фиксирование точки эквивалентности. Используется свойство ртути (II) йодида растворяться в спирте с образованием бесцветных растворов. Титрант: ртути (II) перхлорат (0,01 моль/л) УЧ [1/2 Hg(ClO4)2] 3. Броматометрический метод. Используется в анализе йодидов калия и натрия. Метод основан на восстановительных свойствах йодидов. Йодид-ионы окисляются калия броматом в среде кислоты хлороводородной до йодмонохлорида: 6KI + KBrO3 + 6HCI → 3I2 + 6KCI + KBr + 3H2O 6KI + 2KBrO3 + 12HCI → 6ICI + 2KBr + 6KCI + 6H2O Уравнение после сокращения коэффициентов: 3KI + KBrO3 + 6HCI → 3ICI + KBr + 3KCI + 3H2O Хранение В хорошо укупоренной таре, в сухом месте (натрия бромид и йодид, калия йодид – гигроскопичны). Бромиды и йодиды легко окисляются до свободного галогена, поэтому их необходимо предохранять от действия света (хранят в склянках темного стекла). Применение Натрия хлорид. Плазмозамещающее, дезинтоксикационное, гидратирующее, нормализующее кислотно-щелочное состояние (КЩС) средство. Калия хлорид. Нормализует КЩС, восполняет дефицит калия. Натрия бромид и калия бромид. Седативные средства. Натрия йодид и калия йодид. Восполняют дефицит йода. Проявляют противомикробное, протеолитическое, муколитическое действие. Натрия фторид Sodium fluoride (МНН) NaF Natrii phthoridum(ЛН) Получение Из минерала флюорита (CaF2,), который сплавляют с натрия карбонатом и кремния (IV) оксидом: Натрия фторид вымывают из плава водой и раствор упаривают до кристаллизации. 📽️ ВидеоПолучение хлорида калия (synthesis of potassium chloride) KClСкачать  Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать  Электролиз. 10 класс.Скачать  9 класс. ОГЭ. Химия. Часть 2 (задания 20, 21, 22, 23, 24),Скачать  Взаимодействие хлорида железа III с роданидом калияСкачать  Как за 4 МИНУТЫ выучить Химию? Химическое Количество, Моль и Закон АвогадроСкачать  Количество вещества. Моль. Число Авогадро. 8 класс.Скачать  Перекристаллизация, или очистка хлорида калия! [ChemistryToday]Скачать ![Перекристаллизация, или очистка хлорида калия! [ChemistryToday]](https://i.ytimg.com/vi/naxeGRmhnSI/0.jpg) Типы Химических Связей — Как определять Вид Химической Связи? Химия 9 классСкачать  9 класс. ОГЭ. Химия. Часть 2 (задания 20, 21, 22, 23,24).Скачать  Взаимодействие твердого хлорида калия с концентрированной серной кислотойСкачать  8 класс. Массовая доля растворенного вещества. Решение задач.Скачать  Гидролиз солей. 9 класс.Скачать  Установление эмпирической и молек. формул по массовым долям элем., входящих в состав в-ва. 10 класс.Скачать  МОЛЯРНАЯ МАССА ХИМИЯ // Урок Химии 8 класс: Относительная Молекулярная МассаСкачать  Кристаллы из хлорида калияСкачать  Количественный анализ. ЛР#2 Определение содержания натрия карбоната и натрия гидрокарбоната в смесиСкачать  Стандартизация раствора натрия тиосульфата по калия дихроматуСкачать  |